Biochimica degli ormoni
Biochimica degli ormoni
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Biochimica degli ormoni
Natura e azione degli ormoni
Quasi tutti i tessuti immettono nel circolo sanguigno prodotti chimici atti ad influenzare tessuti più o meno lontani, ma solo alcune cell., raggruppate a formare le GHIANDOLE ENDOCRINE, si sono specializzate in questa funzione, producendo ormoni.
Tra questi ci sono:
- ormoni paracrini à interagiscono con e influenzano cell. vicine
- ormoni autocrini à agiscono sulle stesse cell. che li hanno prodotti
Gli ormoni esplicano la loro attività solo a livello di cell. bersaglio, dotate di recettori capaci di riconoscerli.
Le modificazioni funzionali (e a volte anche strutturali) indotte dagli ormoni soddisfano in genere l’esigenza di adattare l’organismo alle condizioni imposte dall’ambiente esterno o interno (OMEOSTASI).
Gli ormoni si possono classificare in:
- ormoni proteici e peptidici (insulina, glucagone, ormoni ipofisari, paratormone, calcitonina e quasi tutti gli ormoni tissutali)
- ormoni steroidei (corticosurrenalici e sessuali)
- ormoni derivati dagli amminoacidi (adrenalina, noradrenalina, tiroxina e triiodotironina)
- ormoni derivati dagli acidi grassi (eicosanoidi)
- ormoni derivati dalla vitamina D2 e D3
Gli ormoni peptidici e proteici come pure adrenalina, noradrenalina (di natura idrofilica) circolano nel sangue liberi.
Gli ormoni steroidei, la tiroxina, la triiodotironina e l’1, 25 – diidrossicalciferolo (derivato dalla D3), tutti di natura idrofobica, sono veicolati nel sangue da proteine leganti specifiche.
Nessun ormone viene prodotto e secreto con ritmo uniforme ma secondo cicli o in seguito a determinati stimoli (secrezione pulsatoria).
La vita media degli ormoni è piuttosto breve, infatti, esplicata la loro azione, vengono rapidamente inattivati ed eventualmente secreti. Ciò soddisfa l’esigenza di una risposta ormonale adeguatamente controllata e transitoria.
Caratteristica degli ormoni è di operare a concentrazioni ematiche estremamente basse (10 alla meno nove – 10 alla meno dodici M)
Recettori ormonali
I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l’ormone. L’interazione ormone-recettore è caratterizzata da un’elevata specificità.
L’affinità elevatissima dei recettori risponde alla esigenza del tessuto bersaglio di legare il maggior numero possibile delle non molto molecole dell’ormone rilasciate in circolo dalle ghiandole endocrine.
Interazioni ormone-recettore
Il legame tra ormone [H] e recettore [R] e la conseguente formazione del complesso ormone-recettore costituisce il primo atto dell’azione ormonale (K1 e K2 sono le velocità dei processi di associazione e dissociazione dell’ormone al e dal recettore).
[H] + [R] [HR]
All’equilibrio di reazione la costante di associazione, Ka, è uguale all’inverso della costante di dissociazione, Kd:
Ka = [HR] / [H] + [R] = K1 /K2 = 1/Kd
Il valore di Ka è indice dell’affinità dell’ormone per il suo recettore; è importante anche la Bmax ovvero la massima capacità legante da parte del recettore.
Sperimentalmente, in un sistema in cui il recettore rimane costante e l’ormone è aggiunto in quantità crescente, dopo un tempo prestabilito di incubazione tale da consentire di raggiungere l’equilibrio di reazione, si misurano la quota di ormone legata ([B]) cioè [HR] e la quota libera ([F]).
La relazione che esiste tra B e la quantità di ormone aggiunto è di tipo iperbolico.
La rappresentazione secondo Scatchard degli stessi dati in cui sull’ascissa sono riportati i valori di [HR] e sulle ordinate il rapporto [HR]/[H] è espressa da una retta la cui intercetta sull’asse dell’ascissa dà il valore di Bmax e la cui pendenza è uguale a – 1/Kd e quindi dà il valore di Kd (o Ka).
Con [H] = quantità totale di ormone usato
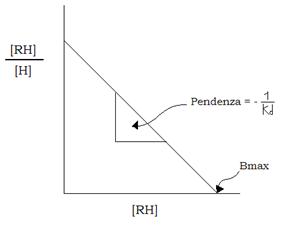
La saturazione del recettore si ottiene con concentrazioni di ormone 20 volte maggiori rispetto al valore della Kd.
Inoltre il grafico di prima può indicare anche la presenza nel recettore di siti di maggiore o minore affinità; infatti se al posto della retta, si trovasse una spezzata con una prima porzione rettilinea di maggiore pendenza e una seconda porzione di minore pendenza, il primo tratto indicherebbe la presenza di un sito ad alta affinità, il secondo tratto un sito a bassa affinità.
Caratteristiche molecolari dei recettori
La gran parte degli ormoni trovano i corrispondenti recettori sulle membrane plasmatiche delle cell. bersaglio: recettori di membrana.
Gli altri ormoni, di natura idrofobica, trovano i corrispondenti recettori all’interno della cell.:
- nel citoplasma à ormoni corticosteroidi
- nel nucleo à ormoni steroidei, sessuali, tiroidei e ormone derivante dalla vitamina D
L’azione degli ormoni che hanno recettori di membrana consiste nell’attivare, attraverso l’interazione col recettore, un processo di trasduzione dei segnali attraverso la membrana con produzione spesso di un secondo messaggero.
Il messaggero secondario a sua volta dà inizio ad una cascata di reazioni con produzione dell’effetto metabolico-funzionale finale che è proprio dell’ormone.
Per interagire con i recettori citoplasmatici o nucleari, i relativi ormoni devono invece entrare nella cell.. Il loro passaggio attraverso la membrana avviene di solito per trasporto facilitato con intervento di specifiche proteine carrier di membrana. In tal modo anche per questi ormoni la membrana esplica un riconoscimento specifico.
Recettori citoplasmatici
La struttura di questi recettori presenta 4 principali motivi o domini funzionali, a partire dall’estremità amino terminale:
- il dominio a struttura variabile, (detto anche antigenico) responsabile delle interazione che riguardano la modulazione del processo di trascrizione
- il dominio di interazione con il DNA che lega specifiche porzioni del DNA dette elementi di risposta all’ormone (HRE) ed è responsabile dell’innesco del processo di trascrizione. Contiene strutture a dita di zinco in grado di legare DNA.
- il dominio di riconoscimento e orientamento nel nucleo
- il dominio di interazione con l’ormone, il quale, quando occupato dall’ormone, conferisce al recettore la conformazione attiva con conseguente avvio della trascrizione. In questo sono presenti due sottodomini, uno pure partecipante alla modulazione del processo di trascrizione e l’altro legante particolari proteine chaperon (da shock termico, HSP).
L’ingresso dell’ormone, provocando dimerizzazione del recettore, spiazza le HSP, fa assumere al recettore la forma attiva, con conseguente attacco all’HRE: la trascrizione del gene strutturale specifico ha così inizio.
L’HRE, associato a diverse proteine implicate nel processo di repressione/attivazione della trascrizione costituisce l’unità di risposta ormonale, HRU.
Recettori nucleari
La struttura è simile a quella qui sopra descritta, ma il dominio di legame con l’ormone è sprovvisto dei sottodomini leganti le HSP e modulante la trascrizione.
Uno dei meccanismi con cui un tessuto può modificare la risposta ad un ormone è la variazione del numero dei recettori. Per esempio un eccesso di ormone può indurre la diminuzione abbastanza rapida dei relativi recettori, dovuta ad internalizzazione del complesso ormone-recettore con meccanismo endocitotico (down regulation).
Meccanismi di azione degli ormoni
La cell. risponde allo stimolo creato dall’interazione ormone-recettore in 3 modi:
1) incentivando la sintesi di determinate proteine
2) modificando la permeabilità delle membrane cell. a sostanze specifiche
3) modulando (stimolando o inibendo) l’attività di determinati enzimi.
Il meccanismo 1 implica risposte piuttosto lente ma durature; i meccanismi 2 e 3 evocano risposte rapide ma fugaci.
Alcuni ormoni agiscono tramite uno di questi meccanismi, altri tramite più meccanismi contemporaneamente.
L’insulina, ad es., agisce con i meccanismi 1 e 2 e probabilmente anche 3.
Lo stesso ormone può anche agire con meccanismi diversi a livello di differenti tessuti bersaglio.
Azione sulla sintesi proteica
Stimolazione della trascrizione
Modalità tipica di molti ormoni di natura lipofilica. In alcuni casi l’interazione tra il complesso ormone-recettore e il corrispondente HRE è sufficiente ad attivare il sistema genico promotore consentendo l’inizio della trascrizione del gene strutturale.
In altri casi il processo di attivazione è più complesso e richiede l’intervento oltre che dell’HRE, di altri elementi di DNA e di fattori proteici di trascrizione.
L’insieme di tutti questi elementi costituisce l’HRU, l’unità di risposta all’ormone.
La comunicazione tra una HRU e l’apparato trascrizionale richiede a sua volta la partecipazione di una o più proteine che costituiscono la classe dei co-regolatori. Co-regolatori sono ad es.:
- la proteina legante CREB, detta CBP
- la proteina p300, spesso associata a CBP
Il complesso CBP-p300 può esprimere attività acil-trasferasica su gruppi amminici di istoni facilitando il distacco di questi dal DNA.
Anche ormoni idrofilici hanno la possibilità di innescare la trascrizione di geni strutturali specifici, promuovendo la attivazione di particolari proteine intranucleari, a loro volta attivanti co-regolatori della trascrizione.
Gli effetti di questi ormoni sono inibiti da parte della Actinomicina D, un inibitore appunto della trascrizione!
Stimolazione della traduzione
Alcuni ormoni stimolano la sintesi proteica attivando la fase di traduzione.
Nel caso di questi ormoni, i loro effetti funzionali non sono inibiti da parte della Actinomicina D!
I meccanismi molecolari di questi effetti sono poco noti.
Azione sulla permeabilità delle membrane cell.
Alcuni ormoni agiscono modificando il trasporto di taluni nutrienti attraverso le membrane cell.. Tipico esempio è quello dell’insulina, a livello del sarcolemma delle cell del muscolo scheletrico o della membrana plasmatica degli adipociti. Il trasporto del glucosio o degli aminoacidi attraverso queste membrane è attivo solo in presenza di insulina.
I carrier dei nutrienti vengono cioè attivati nel momento in cui l’ormone si lega al suo specifico recettore di membrana.
Controllo della proliferazione cell. : proto-oncogeni e geni soppressori della crescita tumorale
Sono noti geni mutati, chiamati oncogeni, che producono proteine non più regolabili, con conseguente proliferazione non controllata e sviluppo di tumori.
I corrispondenti geni normali sono chiamati proto-oncogeni.
Sono pure noti geni (chiamati geni soppressori della crescita tumorale) che esprimono proteine il cui ruolo fisiologico è di interrompere il processo proliferativo.
Ormoni polipeptidici
Molti organismi e moltissime cell. sono capaci di produrre ormoni di natura polipeptidica. Vengono sintetizzati con il meccanismo generale della sintesi proteica e per quelli di natura glicoproteica, il completamento della molecola per aggiunta della porzione glicidica, avviene nell’apparato di Golgi.
Gli ormoni polipeptidici vengono inattivati per degradazione idrolitica catalizzata o da proteasi specifiche, come nel caso dell’insulina (insulinasi) e della angiotensina II (angiotensinasi) o da proteasi non specifiche.
Ormoni del pancreas
Insulina
Struttura
La molecola d’insulina è formata da 2 catene polipeptidiche (A e B) formate rispettivamente da 21 e 30 amminoacidi. La struttura tridimensionale è assai compatta, anche per i numerosi legami salini ed idrogeno che, in aggiunta ai due legami disolfuro, tengono coese le due catene A e B.
In soluzione le molecole di insulina tendono ad aggregarsi in strutture dimeriche, tetrameriche o esameriche.
La struttura quaternaria più facilmente assunta dall’insulina in presenza di zinco (è appunto la zinco-insulina che viene secreta dal pancreas) è quella esamerica. Due atomi di Zn ubicati nel cuore di tale struttura servono a stabilizzarla.
Si ritiene che l’insulina venga secreta dalle cell. β- (o B) pancreatiche (isole di Langerhans) in forma esamerica, ma che la sua azione a livello delle cell. bersaglio venga esplicata nella forma monomerica.
Biosintesi e catabolismo
Il gene dell’insulina nell’uomo si trova nel braccio corto del cromosoma 11 e viene sintetizzata in forma di precursore inattivo, la proinsulina. Questa consta di una unica catena polipeptidica formata da 78 a 86 residui. I due segmenti N- e C- terminali andranno a costituire rispettivamente le catene B e A dell’insulina, mentre il segmento intermedio (peptide C o peptide di connessione) viene distaccato al momento della conversione proinsulina à insulina.
È la lunghezza del peptide C di connessione a variare da specie a specie; questo è connesso con i due segmenti esterni da due coppie di amino acidi basici.
In realtà la catena della proinsulina viene sintetizzata in forma di una proteina più complessa, la pre-proinsulina. È nell’ambito della pre-proinsulina che si formano i ponti disolfuro che caratterizzano l’insulina.
La trasformazione pre-proinsulina à proinsulina è catalizzata da un enzima tripsino simile negli spazi luminali del reticolo endoplasmatico non appena la pre-proinsulina vi penetra a sintesi ultimata.
Il peptide N-terminale della pre-proinsulina è detto peptide leader, in quanto dirige la neo formata pre-proinsulina alla sua specifica destinazione: le vescicole del reticolo endoplasmatico.
La capacità della pre-proinsulina di attraversare le membrane intracell. è conferita dalla idrofobicità del segmento leader, ricco di aminoacidi idrofobici.
La proinsulina viene trasformata in insulina nell’apparato di Golgi e in parte anche in vescicole gemmate del Golgi (vescicole β) nelle quali insulina e una residua parte di proinsulina vengono depositate:
pre-proinsulina à proinsulina à insulina
(104 ammin.) (81 ammin.) (51 ammin.)
La esocitosi delle vescicole β è preceduta dalla fusione della membrana delimitante le vescicole con la membrana plasmatica.
È infatti la secrezione dell’insulina preformata, non la sua sintesi, l’evento immediatamente conseguente alla stimolazione delle cell.β.
La secrezione nel sangue di quantità stechiometriche di insulina e di peptide C consente di utilizzare la concentrazione ematica di quest’ultimo come indice di secrezione dell’insulina endogena nei soggetti diabetici, ai quali viene somministrata insulina (esogena).
Il rilascio dell’insulina dalle cell.β è preceduto da un aumento della concentrazione citoplasmatica dei Ca²+, condizione necessaria per la fusione delle vescicole β con la membrana plasmatica!
L’insulina viene secreta nella vena pancreatica, che si riversa nel sistema portale. Prima di entrare nel circolo generale passa quindi attraverso il fegato, dove viene in parte demolita.
Nell’uomo la vita media dell’insulina circolante è di 7-15 minuti. Responsabili della sua inattivazione sono enzimi proteolitici contenuti nei lisosomi dei tessuti che la utilizzano. Il fegato possiede anche la glutatione-insulina-trans-idrogenasi che inattiva l’insulina riducendo in tioli i ponti disolfuro che tengono unite le due catene A e B:
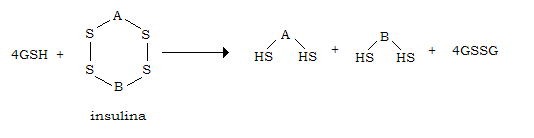
Una volta separate, le due catene vengono demolite da proteasi lisosomali denominate complessivamente “insulinasi”.
Regolazione della secrezione dell’insulina
La quantità di insulina secreta pro die è circa 1unità/kg di peso.
Nei soggetti adulti la quantità immagazzinata nel pancreas, sia in forma di insulina che di proinsulina, è pari a 350-400 unità.
I due principali fattori di regolazione della secrezione dell’insulina sono:
- la glicemia
- il glucagone
Lo stimolo da glucosio implica due processi:
- il legame del glucosio al suo recettore specifico (glucorecettore)
- la formazione di un intermedio metabolico, connesso alla glicolisi, entro le cell.
La combinazione di questi due processi determina un aumento di Ca²+ nelle cell.β ed una ridistribuzione intracell. di questo catione.
La risposta secretoria di insulina alla stimolazione da glucosio è tipicamente bifasica con un primo picco meno accentuato e più breve, seguito da un secondo picco più accentuato e di maggior durata.
Il meccanismo di stimolazione da parte del glucagone è certamente secondario alla sua azione sulla formazione del cAMP, ma il modo con cui l’aumentata concentrazione cell. di cAMP si traduce in aumentata secrezione di insulina non è ancora noto.
Pertanto Ca²+ e cAMP segnalano entro le cell.β l’azione del glucosio e del glucagone rispettivamente; in entrambi i casi ne consegue stimolazione della secrezione insulinica.
I recettori dell’insulina
Fondamentalmente i tessuti bersaglio di questo ormone sono il fegato, il muscolo e il tessuto adiposo.
I recettori dell’insulina, di natura glicoproteica, sono saldamenti ancorati alla membrana plasmatica.
Sono recettori ad unica porzione α-elicizzata intramembrana in forma di dimeri tenuti legati da un ponte disolfuro. Altri recettori si trovano all’interno della cell.
Il numero dei recettori di superficie può diminuire o per diminuita sintesi o per aumentata demolizione o per internalizzazione. Questa possibilità di variazione nel numero dei recettori costituisce il più importante fattore di controllo della sensibilità delle cell. all’insulina!!
La insulino resistenza è infatti spesso determinata da una diminuzione nel numero dei recettori di membrana.
Un epatocita contiene 1700 recettori circa ed un adipocita ne contiene 10.000 circa; è tuttavia sufficiente che l’insulina si leghi ad un decimo circa di questi recettori per evocare nell’adipocita una sensibile risposta metabolica. La elevata affinità dell’insulina per i suoi recettori è necessaria per la cattura delle poche molecole di insulina circolanti nel sangue.
Cooperatività negativa à la capacità dei recettori liberi di legare l’insulina è tanto minore quanti più recettori si sono già legati all’ormone.
Azione dell’insulina
L’azione dell’insulina si esplica:
- sia modificando i processi di permeabilità di membrana
- sia modificando l’attività di alcuni enzimi intracell.
- sia promuovendo la sintesi di alcune proteine, quali la glucochinasi.
Parte di queste azioni derivano dall’attività tirosino-chinasica propria del recettore attivato e dal conseguente innesco della catena di attivazione di proteine chinasi.
Alcune azioni, particolarmente quelle “metaboliche” sono invece conseguenti alla attivazione di proteine fosfatasi e suggerirebbero il coinvolgimento di uno specifico messaggero secondario (es. glicano-fosfoinositide).
La funzione principale dell’insulina è quella di stimolare la fase sintetica del metabolismo, promuovendo l’assunzione di glucosio e di aminoacidi da parte delle cell di numerosi tessuti e stimolando la sintesi di glicogeno, degli acidi grassi (e dei trigliceridi) e delle proteine.
Azione sul metabolismo glucidico
L’insulina stimola l’utilizzazione del glucosio in tutti i tessuti con l’eccezione forse del cervello.
Nel muscolo e nel t.adiposo la maggiore utilizzazione del glucosio è primariamente dovuta ad attivazione della sua diffusione facilitata attraverso la membrana cell.
Nel fegato l’azione di stimolo dell’insulina sulla utilizzazione dei glucidi consegue innanzitutto ad induzione della sintesi della glucochinasi.
L’aumentato ingresso del glucosio o l’incremento della sua fosforilazione da parte della glucochinasi comporta un aumento della glicolisi e, specie nel fegato, una più intensa sintesi di glicogeno.
L’incremento della glicogeno sintesi e la restrizione della glicogenolisi sono causati da stimolazione della glicogeno sintetasi e da inibizione della glicogeno fosforilasi da parte dell’insulina, per il tramite di proteine-fosfatasi attivate per azione dell’ormone. È anche possibile che l’insulina attenui l’azione del cAMP, stimolando la formazione del suo antagonista, il cGMP.
È stimolando analogamente la de fosforilazione degli enzimi che l’insulina incrementa l’attività della fosfofruttochinasi II e della piruvato deidrogenasi, promovendo la formazione e l’uso di acetil-CoA di origine glicidica nel ciclo di Krebs.
In aggiunta, l’insulina inibisce la gluconeogenesi, reprimendo la biosintesi di alcuni enzimi che partecipano al processo: in particolare la fosfoenolpiruvato carbossichinasi e la glucosio-6-P-fosfatasi.
Quindi, stimolando la utilizzazione del glucosio e inibendone la formazione da metaboliti non glucidici, l’insulina previene l’accumulo di glucosio nel sangue (iperglicemia).
La somministrazione di insulina altera l’equilibrio che c’è tra assorbimento/immissione del glucosio da/nel sangue facilitandone l’uscita dal sangue, inducendo ipoglicemia.
Se l’ipoglicemia è particolarmente rapida ed intensa le funzioni del cervello vengono compromesse a volte drammaticamente con la comparsa di uno stato di shock e coma.
Un regolare ma bilanciato livello di insulina è dunque necessario per un normale funzionamento dell’organismo.
Tenendo presente che la secrezione di insulina dal pancreas è stimolata in senso positivo dal livello di glucosio nel sangue e che l’azione dell’insulina produce una maggiore utilizzazione del glucosio, si può concludere che l’insulina segnala un’abbondanza di glucosio! Per contro i due ormoni antagonisti, glucagone e adrenalina, segnalano una scarsità di glucosio.
Azione sul metabolismo lipidico
L’insulina stimola la sintesi degli acidi grassi (lipogenesi) e la loro esterificazione in trigliceridi. Entrambe queste azioni sono conseguenza dell’aumentata utilizzazione del glucosio. L’accelerata trasformazione del glucosio in piruvato e quindi in acetil-CoA e ossaloacetato spiega l’aumento della lipogenesi.
Anche la formazione degli enzimi del sistema di biosintesi degli acidi grassi è stimolata dall’insulina.
Con il “governo” dell’insulina l’approvvigionamento di acetil-CoA per il funzionamento del ciclo di Krebs avviene a carico del glucosio.
All’aumento dei trigliceridi concorre anche la potente azione inibitrice dell’insulina sulla lipasi del tessuto adiposo, probabilmente riferibile ad una diminuzione di cAMP per stimolazione della fosfodiesterasi.
L’effetto antilipolitico dell’insulina si realizza a concentrazione di insulina molto più basse di quelle richieste per altri effetti metabolici dell’ormone!
La rallentata corrente degli acidi grassi dal t.adiposo al fegato spiega anche l’azione antichetosica dell’insulina: infatti la carenza di acidi grassi con
abbondanza di glucosio, porta a forte riduzione della produzione di corpi chetonici da parte del fegato.
Azione sulla sintesi delle proteine
La somministrazione dell’insulina stimola in quasi tutti i tessuti la incorporazione degli amino acidi nelle proteine. L’accelerata sintesi proteica è espressione sia di un attivato trasporto degli aminoacidi attraverso le membrane cell., sia di una aumentata capacità dei ribosomi a sintetizzare le catene polipeptidiche.
È per questa stimolazione della sintesi proteica che l’insulina viene considerata un tipico ormone anabolico!!
Effetti di stimolazione della biosintesi proteica, replicazione cell e crescita tissutale, simili a quelli dell’insulina, sono evocati anche dagli ormoni polipeptidici detti IGF-I e IGF-II; il primo, prodotto dal fegato e da altri tessuti, stimola la crescita delle ossa e della cartilagine; il secondo, prodotto da vari tessuti extraepatici, svolge probabilmente un ruolo nello sviluppo embrionale.
Diabete mellito
Una deficienza di insulina o un difetto della sua azione produce il diabete pancreatico o diabete mellito, che si manifesta con alterazioni metaboliche dovute fondamentalmente ad una diminuita capacità dei vari tessuti ad utilizzare glucosio.
Ne deriva la iperglicemia. Quando la glicemia supera il valore soglia (160-180mg/100mL) il glucosio viene eliminato dai reni e compare nelle urine: glicosuria.
A determinare l’iperglicemia concorre anche l’accentuata gluconeogenesi a spese di amino acidi che vengono distolti dalla loro funzione primaria, la sintesi proteica.
La diminuita utilizzazione del glucosio obbliga i tessuti a ricavare energia dai lipidi e dagli amino acidi. La conseguente accentuata “mobilizzazione” degli acidi grassi dal t.adiposo induce aumento dei NEFA nel sangue. La captazione da parte del fegato di una maggior quantità di acidi grassi e glicerolo liberati dal t.adiposo produce steatosi epatica e aumento delle lipoproteine a bassissima densità nel sangue (VLDL).
Inoltre quando la maggior produzione dei corpi chetonici non è controbilanciata da una adeguata utilizzazione ossidativa nei tessuti extraepatici, si ha loro accumulo nel sangue (chetonemia) ed eliminazione con le urine (chetonuria).
Un eccesso di corpi chetonici è dannoso, in quanto può alterare l’equilibrio acido-base ed idrico-salino del plasma e dell’organismo con istaurarsi di acidosi; questa condizione, nota come chetosi o acidosi diabetica, può portare al coma.
- La insulino deficienza produce il diabete di tipo I o insulina dipendente.
- La insulino resistenza produce il diabete di tipo II o insulina indipendente. I diabetici di tipo II sono generalmente obesi, hanno elevati tassi ematici di insulina e recettori insulinici superficiali scarsi per “down regulation”.
Resistenza all’insulina o insulino resistenza
Per insulino resistenza si intende ogni condizione nella quale una determinata quantità di insulina evoca una risposta biologica subnormale.
- Anomala composizione dell’insulinaà la sostituzione di un amino acido con un altro per mutazione genica può diminuire o annullare l’attività dell’insulina quando l’amino acido sostituito occupa posizione critica per l’azione dell’ormone.
- Incompleta conversione della proinsulina in insulinaà questo difetto, ancora riferibile ad anomalia del gene della pre-proinsulina, consiste nella sostituzione di un residuo di un aminoacido con un altro nella zona di distacco del peptide di connessione con l’insulina. Questa sostituzione previene l’attacco proteolitico della proteasi responsabile della conversione proinsulina à insulina.
- Elevata concentrazione in circolo degli antagonisti insulinicià può trattarsi di antagonisti ormonali (cortisolo, ormone dell’accrescimento, glucagone e catecolamine) o di anticorpi anti insulinici che vengono prodotti nei pazienti trattati cronicamente con insulina esogena. Questi anticorpi, legando e non rilasciando l’insulina presente nel plasma, modificano il decorso dell’azione dell’insulina esogena. Altra possibilità è costituita dalla formazione di (auto) anticorpi anti-recettori dell’insulina che legandosi agli stessi recettori, ne prevengono il legame con l’insulina.
- Deficienza dei recettori insulinicià un diminuito numero dei recettori di membrana è alla base di alcune situazioni patofisiologiche, le più comuni delle quali sono l’obesità e il diabete di tipo II. La diminuzione del numero dei recettori porta ad una diminuita sensibilità all’insulina.
- Difetti post-recettorialià consistono in un anomalo accoppiamento tra complesso “insulina-recettore” e trasporto del glucosio ed altri eventi metabolici indotti dall’insulina (diminuita capacità di risposta all’insulina).
Glucagone
Struttura e secrezione
È un polipeptide composto da 29 amminoacidi che viene sintetizzato nelle cellule α (o A) del pancreas in forma di pre-ormone e accumulato in vescicole di secrezione.
Il precursore primario (proglucagone) viene prima scisso in due frammenti, il più piccolo dei quali, detto gli centina, viene prodotto per proteolisi selettiva del glucagone.
La secrezione del glucagone che, analogamente all’insulina, viene immesso nel circolo portale per esocitosi, è stimolata da un basso livello di glucosio nel sangue (ipoglicemia).
Oltre che dal pancreas il glucagone viene prodotto dalle cell. L dell’intestino tenue con l’ingresso del bolo alimentare: enteroglucagone. La principale funzione dell’enteroglucagone è di produrre un anticipato stato di iperglicemia e di stimolare la secrezione dell’insulina. A sua volta la secrezione dell’enteroglucagone è stimolata da una elevata concentrazione di glucosio nel lume intestinale.
Azione
I tessuti bersaglio sono il fegato e il t.adiposo.
Nelle cell. di questi tessuti, legandosi a specifici recettori di membrana, il glucagone stimola l’adenilato ciclasi aumentando la concentrazione intracell di cAMP.
Nel fegato il glucagone stimola in tal modo la glicogenolisi e nel t.adiposo la lipolisi: così si spiega l’aumento ematico della glicemia e, rispettivamente, dei NEFA.
Si tratta di un’azione contraria a quella dell’insulina ed analoga a quella dell’adrenalina; tuttavia va notato che il fegato è molto più sensibile all’azione del glucagone che non dell’adrenalina mentre il muscolo è sensibile solo all’adrenalina!!!
L’aumentata produzione dei corpi chetonici indotta dal glucagone è conseguenze dell’aumentato apporto al fegato di acidi grassi provenienti dal t.adiposo, nonché dall’induzione promossa dall’ormone, della carnitina aciltrasferasi I, il che incrementa l’ingresso degli acidi grassi nei mitocondri e quindi la loro degradazione, particolarmente nel fegato.
Stimolando il catabolismo (ormone catabolico) il glucagone controbilancia l’azione anabolica dell’insulina!
Il glucagone ha un’azione diabetogena. Si ritiene infatti che la iperglicemia a digiuno, manifestazione di un diabete di una certa gravità, consegua ad eccesso di glucagone, mentre una deficienza di insulina sarebbe responsabile solo dell’iperglicemia postprandiale (dopo pranzo).
Tuttavia è il glucagone che, stimolando l’immissione del glucosio nel sangue, provvede al congruo sostentamento energetico dei tessuti più vitali, cervello in primis, la cui sorgente energetica è costituita dal glucosio!
La secrezione del glucagone, come pure dell’insulina, è stimolata da varie sostanze, tra cui amino acidi, in particolare l’arginina.
Somatostatina
È un ormone polipeptidico presente in due forme, provenienti entrambe dalla frammentazione selettiva di un precursore di 116 amino acidi.
È secreta dalle cell. D delle isole pancreatiche, sede di maggiore produzione, dall’ipotalamo e da alcune cell. dell’epitelio intestinale.
La sua azione, dovuta ad una diminuita formazione di cAMP e riduzione della liberazione di Ca²+ nel citosol, consiste nella diminuzione delle secrezioni del tratto gastrointestinale durante il passaggio del materiale alimentare.
Inibisce pure la secrezione dell’ormone della crescita, insulina e glucagone.
Paratormone e calcitonina
Sono ormoni adibiti all’omeostasi degli ioni calcio e fosfato. Da questa omeostasi dipende la costanza della normale calcemia, il cui valore è ~ 10mg/100mL di sangue. Il mantenimento di questo valore e di quello della fosfatemia (5mg/100mL) è fondamentalmente dipendente dall’equilibrio dei due sistemi endocrini antagonisti:
- il paratormone e il calcitriolo à azione ipercalcemizzante
- la calcitonina à azione ipocalcemizzante
Lo scambio di calcio tra tessuto osseo e sangue è di circa 500mg al dì.
Se si considera che l’equilibrio degli ioni calcio e fosfato è necessario per la calcificazione delle ossa e dei denti, per il controllo dell’attività del sistema nervoso e muscolare, per la trasduzione di segnali attraverso la membrana plasmatica e per la regolazione dell’adesività delle cell, si comprende l’importanza di un equilibrio fisiologico fra questi ormoni.
Paratormone
Struttura e azione
È un polipeptide secreto dalle paratiroidi in forma di pre-proparatormone inattivo che viene trasformato per proteolisi selettiva in paratormone nelle vescicole del Golgi.
La proteolisi consiste nel distacco dapprima di un segmento amino terminale da 25 aminoacidi (sequenza segnale), con formazione del proparatormone e quindi di un esapeptide.
La porzione attiva dell’ormone è costituita dai primi 35 aminoacidi a partire dall’estremità amino terminale.
Il paratormone viene secreto in circolo per esocitosi.
L’azione di questo ormone si esplica
- direttamente sui tubuli renali e sulle ossa
- indirettamente sulle cell. intestinali
A livello dei tubuli renali previene il riassorbimento degli ioni fosfato, inducendone una maggiore eliminazione con le urine.
A livello delle ossa stimola, in sintonia con il calcitriolo, la “mobilizzazione” dei Ca²+ incrementando l’attività sia degli osteociti che degli osteoclasti, aumentando in tal modo il turn over dei Ca²+.
A livello dell’intestino stimola l’assorbimento dei Ca²+; tuttavia questa azione non è diretta ma mediata dal calcitriolo, la forma fisiologicamente attiva della vitamina D3.
All’aumento della calcemia provocato dal paratormone concorrono quindi:
- l’aumentato riassorbimento renale dei Ca²+
- il rilascio dei Ca²+ dalle ossa indotto sia direttamente che indirettamente come conseguenza della ipofosfatemia
- l’aumentato assorbimento intestinale dei Ca²+ indotto con la mediazione del calcitriolo.
Sulle cell degli organi bersaglio (reni ed ossa) il paratormone agisce stimolando l’adenilato ciclasi ed inducendo un aumento del cAMP.
La biosintesi di questo ormone viene innanzitutto regolata dalla calcemia: una diminuzione di questa ha effetto stimolante, mentre un aumento effetto inibitorio.
Un secondo fattore che influenza la sintesi del paratormone sono è costituito dai livelli ematici del calcitriolo: bassi livelli l’aumentano, alti livelli la deprimono.
Inoltre la ipomagnesiemia inibisce la secrezione, mentre la prostaglandina PGE1 e i β–antagonisti dell’adrenalina la aumentano.
Iper- e ipoparatiroidismo
Una iperattività paratiroidea determina ipercalcemia, che consegue soprattutto ad un aumentato riassorbimento renale e ad assorbimento intestinale di Ca²+. Il maggior rilascio di Ca²+ da parte delle ossa non sembra altrettanto importante, come è anche dimostrato dalla relativamente scarsa decalcificazione delle ossa.
L’ipoparatiroidismo si manifesta come ipocalcemia che a volte, ma non frequentemente, produce tetania e più raramente disturbi psichici.
Calcitonina
Struttura e azione
È elaborata dalle cell C parafollicolari della tiroide ed è un polipeptide di 32 aminoacidi che viene sintetizzato in forma di pro-ormone inattivo, trasformato in ormone attivo per proteolisi nelle vescicole del Golgi e secreto in circolo per esocitosi.
I 7 amino acidi N-terminali della calcitonina sono ciclizzati da un ponte disolfuro tra i due residui 1 e 7 della cisteina.
Da notare che l’amino acido C-terminale, la prolina, è amidato.
La calcitonina abbassa i Ca²+ e il Pi del sangue, diminuendone il rilascio da parte delle ossa; questa diminuzione si accompagna anche a diminuita produzione di fosfatasi alcalina e a diminuita eliminazione di idrossiprolina con le urine.
La calcitonina aumenta anche la eliminazione renale di Ca²+ e Pi e ciò contribuisce ulteriormente all’abbassamento dei Ca²+ e del Pi ematico.
Non influenza invece l’assorbimento intestinale dei Ca²+.
La secrezione di questo ormone aumenta in risposta ad un aumento della calcemia e viceversa. Queste risposte sono opposte a quelle del paratormone.
In virtù della sua azione mineralizzante, la calcitonina viene impiegata nella terapia del morbo di Paget (malattia cronica dell’osso in cui porzioni di questo crescono in maniera anomala, ingrandendosi, deformandosi e diventando più morbide) e di altre forme di decalcificazione ossea.
Ormoni ipofisari
L’ipofisi è costituita da 3 porzioni che elaborano corrispondentemente 3 classi di ormoni:
- ormoni dell’ipofisi anteriore
- ormoni dell’ipofisi intermedia
- ormoni dell’ipofisi posteriore
Ormoni anteroipofisari
Di natura polipeptidica o glicoproteica, questi ormoni, esclusa la somatotropina, hanno come bersaglio altre ghiandole endocrine di cui regolano il trofismo (nutrimento), la produzione e secrezione ormonale; per questo vengono chiamati anche ormoni trofici (o tropici) o tropine.
Somatotropina (SH)
Nota anche come ormone dell’accrescimento è costituita da una catena polipeptidica che nelle diverse specie animali presenta sequenze non identiche di amino acidi.
Stimola la sintesi proteica sia in quanto agevola l’assorbimento cell. degli amino acidi, sia in quanto stimola le varie fasi dell’incorporazione degli amino acidi nelle proteine.
Questa azione anabolica spiega l’azione di stimolo sull’accrescimento corporeo. In particolare stimola la cartilagine di accrescimento provocando l’allungamento delle ossa, nei bambini, e la crescita ossea per apposizione negli adulti.
Una sua deficienza durante lo sviluppo induce nanismo ed un suo eccesso gigantismo; una iperproduzione a sviluppo completato produce invece acromegalia (malattia che provoca una progressiva deformazione del volto, di mani e piedi).
Con la sua azione anabolica contrasta l’azione glucagone-simile della SH che si manifesta con un aumento dei NEFA, dei corpi chetonici e della glicemia: diabete ipofisario.
La somatotropina è anche in grado di legarsi ai recettori della prolattina, evocando effetti galattogeni simili a quelli della prolattina.
Alcune delle azioni peculiari della SH non sono esplicate direttamente dall’ormone, ma mediate da peptidi somatotropina dipendenti, denominati complessivamente somatomedine. Finora ne sono state identificate 6 e vengono prodotte nel fegato su stimolo della SH. Per esempio la proliferazione della cartilagine è mediata dalle somatomedine.
La secrezione ipofisaria della SH è sotto controllo ipotalamico: viene infatti stimolata dal SFR (fattore di rilascio della somatotropina) ed inibita dal SIF (fattore inibitorio somatotropina), entrambi utilizzanti il sistema di trasduzione cAMP dipendente.
Anche un elevato livello ematico di amino acidi ed in particolare di istidina, ha azione stimolante la secrezione della SH.
Il sistema trasduzionale utilizzato dall’SH è basato sull’attività tirosino-chinasica del suo recettore che attiva, per fosforilazione, la proteina chinasi JAK2, ad esso associata. La JAK2 attiva, a sua volta, altre proteine chinasi quali la STAT e la SHC con innesco di cascate di fosforilazione che raggiungono il nucleo dove promuovono la trascrizione di geni specifici.
Prolattina (PRL)
Una glicoproteina contenente 3 ponti disolfuro, presente nel sangue prevalentemente in forma monomerica (più attiva) ma anche in forme dimeriche e polimeriche molto meno attive.
Stimola lo sviluppo e la secrezione della ghiandola mammaria al momento della “montata lattea”. Tale stimolazione consiste nella induzione della sintesi della α-lattoalbumina che segnala l’inizio della sintesi del lattosio.
Inoltre stimola la attività della glucosio-6-P e della 6-fosfogluconato deidrogenasi, gli enzimi della ossidazione del glucosio adibiti alla sintesi del NADPH(H+).
Stimola poi anche la proliferazione dell’apparato di Golgi, che nella ghiandola mammaria funzionante assume il ruolo di assemblaggio dei componenti del latte (lattosio, proteine e trigliceridi).
La secrezione della prolattina è stimolata dal PRF (fattore di rilascio della prolattina) e inibita dal PIF (fattore inibitorio della prolattina), che sono entrambi prodotti dall’ipotalamo.
Anche la dopamina esercita un marcato effetto inibitorio nella secrezione di prolattina, mediato dall’inattivazione dell’adenilato ciclasi.
Tirotropina (TSH)
Insieme con il LH e il FSH è uno dei 3 ormoni di natura glicoproteica elaborati dalla ipofisi anteriore. Il THS umano è costituito da 2 subunità delle quali una è identica a quella costituente il LH e il FSH, l’altra (β) è invece distinta.
La secrezione del TSH è stimolata dal fattore ipotalamico TRF ed è inibita con meccanismo feed-back dagli ormoni tiroidei.
Il TSH stimola lo sviluppo della tiroide, la produzione degli ormoni tiroidei e quindi tutte le funzioni da essi dipendenti. Stimola inoltre la lipolisi agendo direttamente sul t.adiposo.
L’azione di questo ormone è mediata dal cAMP.
Gonadotropine (FSH e LH)
Entrambe sono, come il TSH, delle glicoproteine costituite da 2 subunità (α e β). La catena comune ai 3 ormoni pare abbia la funzione di attivare l’adenilato ciclasi; le catene β, tra loro distinte, riconoscerebbero i recettori specifici delle ghiandole bersaglio, legandovi i rispettivi ormoni.
La secrezione delle gonadotropine è stimolata dallo stesso “fattore di rilascio” ipotalamico: FSH-LH releasing factor.
L’ormone follicolo stimolante (FSH) induce la maturazione dei follicoli ovarici e la secrezione degli estrogeni nella femmina; nel maschio stimola la spermatogenesi.
L’ormone luteneizzante (LH) stimola la ovulazione, la formazione del corpo luteo, la produzione di progesterone nella femmina e nel maschio la produzione di testosterone da parte delle cell. di Leydig.
Entrambi questi ormoni mediano la loro azione attraverso il sistema cAMP dipendente.
Corticotropina (ACTH)
Fa parte di una famiglia di molecole biologicamente attive che provengono dalla proteolisi selettiva di un comune progenitore, la pro-opiomelanocortina (POMC).
Questa proteina è prodotta nella ipofisi anteriore e intermedia, come pure in altri organi e tessuti, quali cervello, placenta, tratto gastrointestinale, polmone e linfociti.
La prima tappa degradativa che avviene nella ipofisi anteriore sotto stimolo dell’ormone ipotalamico di rilascio della corticotropina (ACTH) e dell’angiotensina II, produce corticotropina e β-lipotropina.
Eventi idrolitici successivi a sede nella ipofisi intermedia producono α-MSH e CLIP dall’ACTH e γ-lipotropina dalla β-lipotropina.
Dalla γ-lipotropina si ottiene infine, sempre per proteolisi selettiva, il β-MSH e dalla β-endorfina la metionina-encefalina C (o γ-endorfina).
L’ACTH è un polipeptide di 39 amino acidi di cui solo i primi 24 a partire da quello N-terminale sono necessari per l’attività biologica; gli altri 15 sono biologicamente superflui.
L’ACTH, con meccanismo cAMP dipendente, stimola la sintesi del pregnenolone, il precursore di tutti gli ormoni corticosteroidi.
Questi ultimi a loro volta inibiscono con meccanismo feed-back la produzione dell’ACTH che è invece stimolata dal CRF o CRH ipotalamico (fattore di rilascio della corticotropina).
Anche l’ACTH stimola la lipolisi a livello del t.adiposo.
Lipotropine
L’ipofisi anteriore elabora due lipotropine:
- la β-lipotropina (β-LPH)
- la α-lipotropina (α-LPH)
così denominate perché stimolano il rilascio degli acidi grassi dal t.adiposo.
La β-lipotropina funge anche da precursore di altri polipeptidi ormonali tra cui il β-MSH, la met-encefalina e la β-endorfina.
Le lipotropine utilizzano come messaggero secondario il cAMP.
Endorfine
α- ,β- e γ- endorfine si formano per proteolisi selettiva della β-lipotropina.
La β-endorfina è costituita dai 31 amino acidi carbossiterminali della β-lipotropina.
La α- e la γ- endorfina, derivano dalla β-endorfina per rimozione degli ultimi 15 o 14 amino acidi dell’estremità carbossiterminale.
Hanno un potente effetto analgesico e possono avere un ruolo nel controllo della percezione del dolore.
Ormoni dell’ipofisi intermedia
La pars intermedia dell’ipofisi produce l’ormone melanotropo (MSH).
Nei vertebrati inferiori questo ha funzione iperpigmentizzante in quanto ipertrofizza le cell. melanofore e ne incrementa il contenuto di pigmenti.
La pigmentazione della pelle umana, che non contiene melanociti, risulta da accumulo di melanina nelle cell. epidermiche. Più che dal MSH questa pigmentazione sembra essere dipendente dalla β-lipotropina.
Ormoni dell’ipofisi posteriore
Nell’ipofisi posteriore vengono depositati la vasopressina e la ossitocina, due ormoni polipeptidici che in realtà vengono sintetizzati nell’ipotalamo e da questo trasportati per via assonale all’ipofisi posteriore, legati ciascuno ad una proteina specifica: la neurofisina.
Vasopressina ed ossitocina sono due nonapeptidi che differiscono per due soli aminoacidi e sono entrambi caratterizzati da un ponte disolfuro fra i residui di cisteina 1 e 6 e dalla amidazione del gruppo carbossilico terminale.
Entrambi gli ormoni sono prodotti per proteolisi selettiva da precursori di molto più elevato P.M.:
- la pre-provasopressina (che è glicosilata nel segmento C-terminale) - la pre-proossitocina
Nel caso di una prima frammentazione si formano neurofisina II e pro-vasopressina (che ha un resto di glicina in più all’estremità C-terminale) dalla pre-provasopressina e neurofisina e proossitocina (pure con una glicina in più all’estremità C-terminale) nel caso delle pre-proossitocina.
Successivamente dalla vasopressina-Gly e ossitocina-Gly viene rimosso il resto di glicina ad opera di una carbossipeptidasi con formazione di vasopressina e ossitocina.
Vasopressina o ormone antidiuretico (ADH)
Agisce a livello dei tubuli contorti distali e dei collettori del rene, stimolando il riassorbimento dell’acqua dal filtrato glomerulare.
L’azione è mediata da recettori collegati con il sistema trasduzionale del cAMP.
Un deficit di questo ormone è causa del diabete insipido, nel quale si ha eliminazione di un abnorme volume di urine.
La secrezione della vasopressina, così chiamata perché produce anche un aumento della pressione del sangue, è sensibile a variazioni osmotiche e di volume del sangue, oltre che a variazioni della pressione sanguigna.
L’azione vasopressoria dell’ormone è mediata da recettori collegati con il sistema trasduzionale dell’IP3 e del diacilglicerolo.
Ossitocina
Stimola la contrazione della muscolatura liscia dell’intestino crasso, della vescica, della cistifellea e in particolare quella dell’utero (viene infatti usata in ostetricia per indurre il parto).
Ha anche azione galattogoga, nel senso che stimola la secrezione del latte facendo contrarre la muscolatura dei dotti galattofori.
Anche l’ossitocina utilizza il sistema trasduzionale dell’IP3 e del diacilglicerolo.
Regolazione dell’attività ormonale dell’ipofisi
La secrezione degli ormoni della ipofisi anteriore è stimolata dai corrispondenti “releasing factor o hormones” (Rf o Rh) ipotalamici. Ciascun ormone è stimolato dal suo specifico RF.
I fattori ipotalamici di rilascio sono 6, tanti quanti gli ormoni anteroipofisari; i fattori ipotalamici di inibizione sono invece solo 3.
Gli uni e gli altri sono peptidi formati da pochi aminoacidi che dall’ipotalamo vengono portati per via ematica all’ipofisi anteriore, dove stimolano o inibiscono la secrezione dei rispettivi ormoni.
Alcuni dei fattori ipotalamici esplicano azione additive:
- il TRF, ad es., stimola anche la secrezione della somatotropina e ha anche azione psichica antidepressiva
- il SRIF, o somatostatina, che viene prodotto anche da cell del pancreas e dello stomaco, oltre a inibire la secrezione della SH, inibisce anche quella dell’insulina, del glucagone, della gastrina e della secretina.
La secrezione delle tropine ipofisarie viene inibita con meccanismo feed-back dagli ormoni periferici di cui stimolano la secrezione.
Tale inibizione può esplicarsi con due meccanismi:
- inibizione diretta della secrezione dell’ormone ipofisario
- inibizione del corrispondente “releasing factor” ipotalamico
Gli ormoni tiroidei agiscono prevalentemente con il primo meccanismo, la corticotropina con il secondo.
Ormoni del tratto gastrointestinale
Questi ormoni sono peptidi (una ventina) ciascuno costituito da non più di 40 resti amino acilici che spesso presentano forti analogie di struttura primaria tra di loro.
Vengono prodotti da specifiche cell. endocrine collocate di solito nell’epitelio gastrointestinale e/o da neuroni del sistema nervoso enterico, situati negli strati sotto epiteliari.
Alcuni di essi provengono anche da neuroni extraenterici.
Possono avere una distribuzione regionale specifica oppure più generalizzata.
La secrezione è regolata dai nutrienti con il cibo e da fattori propri del lumen (pH, concentrazione di Ca²+, distensione della parete) nonché da ormoni e da neurotrasmettitori quali l’acetilcolina, la bombesina e il peptide di rilascio della gastrina (GRP).
Il periodo di dimezzamento di questi ormoni nel circolo varia da 1 a 30min; la loro degradazione operata da peptidasi, avviene prevalentemente nel fegato e nel rene.
Gli ormoni gastrointestinali controllano con azione attivatoria o inibitoria importanti funzioni degli organi addetti alla digestione e all’assorbimento dei nutrienti:
- la secrezione di acqua, elettroliti, muco, ormoni ed enzimi
- la motilità delle pareti
- la crescita delle cell della mucosa
- l’afflusso di sangue
A queste azioni se ne aggiungono altre su altri organi e tessuti (apparato respiratorio, circolatorio e urogenitale) tra cui il cervello, partecipando al controllo del senso della fame e della sazietà.
Gastrina
È presente in due forme, di 17 e 34 amino acidi, entrambe originate dalla pre-progastrina di 101 aminoacidi. Viene secreta dalle cell endocrine G dell’antro gastrico e del duodeno prossimale e stimola la secrezione di HCl e pepsina da parte delle cell parietali e principali della mucosa gastrica, rispettivamente.
Stimola pure la crescita delle cell della mucosa.
La secrezione di gastrina è a sua volta promossa dai peptidi e amino acidi contenuti nel lume gastrico ed è inibita da acetilcolina, bombesina e GRP oltreché dall’acidità gastrica.
Colecistochinina (pancreozimina)
Presente in varie forme, è prodotta dalle cell endocrine I dell’intestino tenue e da neuroni enterici ed extraenterici.
L’ormone ha due principali effetti:
- la contrazione della cistifellea, con concomitante rilassamento dello sfintere di Oddi (si trova a livello dell’orifizio di sbocco del coledoco e del dotto pancreatico nel duodeno)
- la secrezione del succo pancreatico col suo contenuto di enzimi e bicarbonato
Ha inoltre un importante effetto sul sistema nervoso centrale, inducendo il senso di sazietà!
La secrezione della colecistochinina è stimolata dai monogliceridi, dagli acidi grassi a lunga catena e da alcuni aminoacidi (triptofano, fenilalanina) presenti nel lume duodenale.
Gli effetti biologici di tale ormone sono mediati dall’elevazioni degli ioni Ca²+.
Secretina
È prodotta dalle cell S della mucosa dell’intestino tenue e la sua principale azione consiste nello stimolare la secrezione di acqua e bicarbonato da parte del pancreas.
Stimola inoltre la secrezione di pepsina e rallenta la peristalsi.
L’acidificazione del contenuto duodenale è il principale stimolo alla immissione di secretina nel sangue.
Il sistema cAMP dipendente è responsabile della trasduzione del segnale della secretina.
Polipeptide vaso attivo intestinale (VIP)
È prodotto esclusivamente da neuroni enterici ed extraenterici dove ha anche funzione di co-neuroattivatore.
Ha un ampio spettro di azione:
- rilascio della muscolatura liscia dei distretti intestinale, vascolare e respiratorio
- stimolazione della contrattilità cardiaca
- stimolazione della secrezione di acqua ed elettroliti a livello intestinale
- stimolazione delle secrezione endocrina del pancreas, dell’ipofisi e della corteccia surrenalica
- stimolazione della glicogenolisi e lipolisi nel fegato
Peptide inibitore gastrico (GIP)
Prodotto dalle cell K dell’intestino tenue, sotto stimolazione dei principali nutrienti e della bombesina.
I recettori del GIP sono funzionalmente accoppiati al sistema adenilato ciclasi.
Enteroglucagone
Si presenta in due forme:
- l’oxintomodulina
- la glicentina
derivate dallo stesso precursore prodotto dalle cell L dell’ileo e del colon.
Entrambi i peptidi sono potenti inibitori della secrezione gastrica e stimolatori della secrezione di insulina. Promuovono inoltre la glicogenolisi a livello epatico, con mediazione del sistema cAMP dipendente.
Gli stimoli alla secrezione dell’enteroglucagone sono di origine alimentare (intraluminari) in particolare glucosio e trigliceridi.
Motilina
Prodotta dall’intestino tenue.
La sua principale azione consiste nel dare inizio alle onde di contrazione muscolare a partire dalla regione antro-duodenale fino a tutto l’intestino tenue.
La secrezione è promossa dall’acidità del succo gastrico e dai secreti pancreatici del tenue.
Neurotensina
È prodotta dalle cell endocrine N del tratto distale del digiuno e dell’ileo, nonché da molti neuroni del sistema nervoso centrale.
La sua secrezione è stimolata da trigliceridi presenti nel lume.
È un inibitore della secrezione gastrica, della secrezione pancreatica esocrina, dell’irrorazione sanguigna a livello gastrico.
Provoca inoltre vasodilatazione a livello intestinale e cutaneo, ipotensione ed effetti inotropici e cromotropici nel miocardio.
Peptide di rilascio della gastrina (GRP)
La forma prevalente di GRP è un peptide di 27 aminoacidi prodotto a partire da un precursore dalla mucosa del fondo gastrico e dallo strato muscolare liscio dell’antro gastrico e dell’intestino tenue.
Induce il rilascio di gastrina e di secrezione acida da parte dello stomaco nonché stimola la secrezione esocrina pancreatica.
Modula pure la motilità del tratto gastroenterico.
Sostanza P
È un peptide proveniente dalla degradazione di due precursori:
- la pre-protachichinina α
- la pre-protachichinina β
dalle quali originano altri peptidi neuro attivi (sostanza K..ect..)
è prodotta da cell neuronali del tratto enterico, di altri comporti del sistema nervoso periferico e di alcune aree subcorticali.
A livello gastrointestinale la sostanza P provoca contrazione della muscolatura liscia e stimola la secrezione salivare, pancreatica e intestinale.
Azione sistematica importanza della sostanza P è la vasodilatazione arteriolare; nel sistema nervoso agisce da neurotrasmettitore.
Ormoni derivati dagli aminoacidi
Ormoni tiroidei
La tiroide è costituita da un gran numero di follicoli o acini, ciascuno delimitato da un monostrato di cell epiteliali, il cui lume è riempito da un materiale semifluido, la colloide. Questa contiene, tra l’altro, la tireoglobulina, una glicoproteina nell’ambito della quale si formano e rimangono depositati gli ormoni tiroidei.
La tireoglobulina è costituita da due subunità e contiene 115 residui di tirosina, ciascuno dei quali potenzialmente sottoponibile a iod iodinazione.
Biosintesi degli ormoni tiroidei
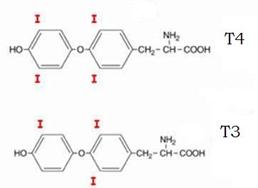
Gli ormoni tiroidei sono:
- la tiroxina (T4)
- la 3,5,3’-triiodotironina (T3)
derivati iodurati della tironina, un composto caratterizzato dal singolare gruppo difenil-etereo:
T3 e T4 vengono sintetizzate da residui di tirosina della tireoglobulina previamente iodurati per formare 3-monoiodotirosina (MIT) o 3,5-diiodotirosina (DIT). Questa iodurazione, catalizzata da una per ossidasi, avviene a spese degli ioni I¯ , in presenza di H2O2 che viene ridotta in H2O.
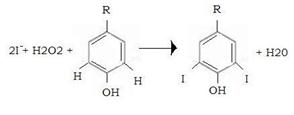
Nel processo gli ioni ioduro sono ossidati a iodio che viene inserito nell’anello fenilico della tirosina (organicazione dello iodio).
Il blocco del processo di iodinazione dei resti di tirosina è il meccanismo col quale operano i farmaci antitiroidei appartenenti alla classe della tiourea (tiouracile, propiltiouracile, metinazolo).
Gli ioni I¯ introdotti con la dieta vengono accumulati nella tiroide mediante un trasporto attivo contro gradiente, operato da un trasportatore tiroideo dello I¯ sostenuto da un processo ATP dipendente, accoppiato alla pompa sodio-potassio.
La capacità della tiroide di concentrare ioni I¯ è alla base dell’uso dello iodio radioattivo I131 come mezzo diagnostico per la funzionalità tiroidea e come mezzo terapeutico di irradiazione del tessuto tiroideo nel trattamento dell’ipertiroidismo e del carcinoma tiroideo.
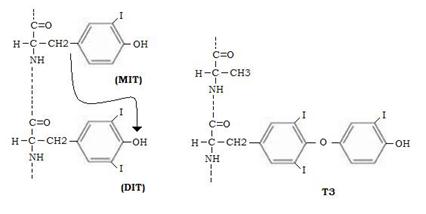
La T3 deriva dalla condensazione di un residuo di MIT con uno di DIT.
La T4 deriva da due residui di DIT.
La condensazione avviene nell’ambito della tireoglobulina per trasferimento del gruppo monoiodofenolico (nel caso della T3) sul gruppo diiodofenolico di un altro residuo di DIT.
La T3 e la T4 così formatesi rimangono covalentemente legate alla tireoglobulina, che si disloca dal lume delle cellule epiteliali periacinose, dove avvengono i processi descritti, alla cavità dell’acino dove viene depositata in attesa di utilizzazione.
Quando per stimolo della tireotropina ipofisaria (TSH) la tiroide viene indotta a rilasciare gli ormoni elaborati, la tireoglobulina rientra nelle cell periacinose attraverso un processo di fagocitosi e qui viene degradata da proteasi lisosomali. T4 e T3 vengono rilasciate nel sangue, mentre i residui di DIT e MIT, liberati dalla proteasi insieme con gli altri aminoacidi, vengono trattenuti e deiodurati da un enzima detto deiodinasi con il concorso di NADPH(H+).
Gli ioni I¯ così liberati vengono riutilizzati per la iodurazione di nuovi residui di tirosina.
T3 e T4 vengono sintetizzate nella quantità adeguata solo se con la dieta viene introdotta una sufficiente quantità di iodio!! Quando ciò non si verifica, si ha ipertrofia compensatoria (gozzo). Infatti la sottoproduzione di T3 e T4 implica una loro concentrazione ematica al di sotto del limite critico necessario per la inibizione del rilascio di TSH dalla ipofisi anteriore. La secrezione non più controllata di TSH stimola la tiroide alla ipertrofia.
Trasporto nel sangue e metabolismo degli ormoni tiroidei
La tiroide riversa nel sangue molto più T4 che T3.
Entrambi gli ormoni vengono trasportati in circolo da una globulina detta TBG, una glicoproteina che ha molto maggiore affinità per la T4 che la T3.
Anche una prealbumina, TBPA, lega T3 e T4, sia pure con un’affinità 100 volte inferiore a quella della TBG.
TBPA e albumina tengono legato il 20% del T4 e il 45% del T3 presente nel sangue circolante. Poiché T3 e T4 circolano nel sangue per la quasi totalità legate alle proteine, lo iodio trasportato dalle proteine plasmatiche (dette PBI) viene assunto come indice del contenuto degli ormoni tiroidei nel sangue.
Attualmente si ritiene che la T3 sia l’ormone tiroideo attivo e che la T4 si converta nella T3 nei tessuti periferici per azione di una deiodinasi associata al reticolo endoplasmatico.
D’altra parte la T4 può anche essere convertita nella triiodotironina inattiva, 3,3,5’ (T3 inversa) per azione di una seconda deiodinasi.
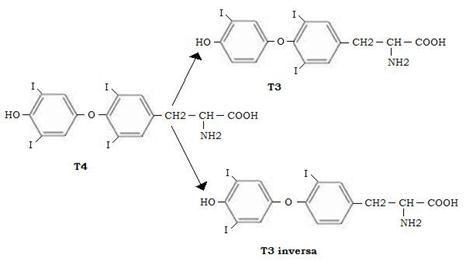
L’attività delle due deiodinasi sembra essere reciprocamente coordinata in quanto condizioni che inducono una diminuita concentrazione di T3 determinano un aumento della “T3 inversa” e viceversa.
Nel digiuno, ad es, la T3 diminuisce e aumenta la T3 inversa.
Si tratta di un meccanismo di compenso per limitare la proteolisi, stimolata sia dal digiuno che dalla T3.
Gli ormoni tiroidei vengono rimossi dal circolo principalmente dal fegato ed escreti nella bile coniugati con l’acido glucuronico. Una minor quota viene de iodurata e quindi inattivata da una deiodinasi presente nelle cell dei tessuti periferici.
Nei tessuti periferici T3 e T4 vengono trasformate rispettivamente in acido tetraiodotireoacetico (TETRAC) e triiodotireoacetico (TRIAC) in un processo di deaminazione e decarbossilazione. Questi due metaboliti che si ritrovano anche nelle urine, conservano parte dell’azione ormonale.
Azione degli ormoni tiroidei
Essi esplicano nel contempo
- azione anabolica (aumento della sintesi proteica)
- azione catabolica (aumento del consumo di ossigeno e della produzione di calore)
in tutti i tessuti, esclusi milza, cervello e gonadi.
L’azione anabolica consiste nell’innesco del processo di trascrizione di geni strutturali di alcune proteine, operato dai recettori nucleati attivati dal legame con l’ormone. Ne consegue una intensificata sintesi proteica.
Fra i numerosi enzimi la cui produzione viene incrementata dagli ormoni tiroidei, vi è la glicerolo-3-fosfato deidrogenasi, la Na+/K+ ATPasi di membrana e alcune proteine disaccoppianti, UCP2 e UCP3.
L’incremento di questi enzimi può spiegare l’aumento del consumo di ossigeno e della produzione di calore, indotto dagli ormoni tiroidei; infatti i primi due enzimi stimolano la respirazione mitocondriale e le proteine disaccoppianti favoriscono, in particolare, la produzione di calore.
Una ipotesi sostiene che il maggior consumo di ossigeno consegua al legame degli ormoni tiroidei con i recettori mitocondriali.
Il maggior consumo di ossigeno e la maggior produzione di calore sono entrambi espressione di aumentato metabolismo basale!!
Regolazione della secrezione degli ormoni tiroidei
Gli ormoni tiroidei vengono prodotti e secreti in risposta all’azione del TSH che, attivando il sistema cAMP dipendente delle cell tiroidee, stimola le varie tappe della sintesi e della secrezione degli ormoni tiroidei:
- captazione dello iodio
- iodurazione dei residui di tirosina
- formazione di T3 e T4
- proteolisi della tireoglobulina
- secrezione degli ormoni
A sua volta l’aumentata concentrazione ematica di T3 e T4 agisce sulla ipofisi inibendo la produzione di TSH (inibizione feed-back).
Per contro la secrezione di TSH è stimolata dal TRF ipotalamico e la secrezione del TRF è stimolata da basse concentrazioni ematiche di T3 e T4. Pertanto è il livello ematico di T3
e T4 che, tramite la regolazione della secrezione di TSH e TRF, regola la secrezione tiroidea.
Quindi, quando la concentrazione di T4 o T3 è bassa, viene incrementata la produzione di TRH e quindi di TSH e di ormoni tiroidei e viceversa!!
Ormoni della midollare surrenale
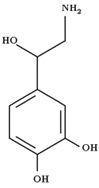
Questi sono la noradrenalina o norepinefrina e l’adrenalina o epinefrina:
 NORADRENALINA
NORADRENALINA
 CATECOLO
CATECOLO
 ADRENALINA
ADRENALINA
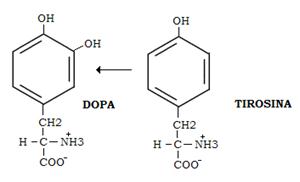
Come si può evincere dalle formule, l’adrenalina è il prodotto di metilazione della noradrenalina. Queste vengono rilasciate dalla midollare dei surreni in seguito a stimolo generato a livello delle terminazioni simpatiche. Oltre che nella midollare, noradrenalina e il suo precursore dopamina, vengono sintetizzate nelle placche terminali del sistema nervoso simpatico in corrispondenza delle giunzioni con i muscoli lisci.
Dopamina, noradrenalina e adrenalina, insieme con altri composti che contengono l’anello del catecolo (ortodiirdossibenzene) sono denominate comprensivamente catecolamine.
Metabolismo della noradrenalina e dell’adrenalina
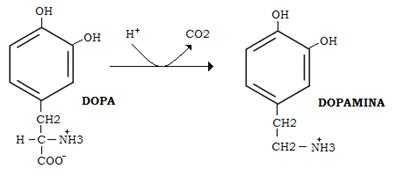
Queste derivano dalla DOPA, prodotto di idrossilazione della tirosina ad opera della tirosina idrossilasi. L’enzima è inibito da eccesso dei prodotti finali (inibizione a feed-back) ed è stimolato dal cAMP e indotto da stimolazioni nervose ripetute.
La DOPA viene decarbossilata in dopamina da una aspecifica decarbossilasi piridossalfosfato dipendente (DOPA decarbossilasi).
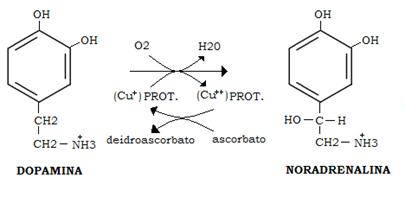
La dopamina viene idrossilata in noradrenalina per azione di una idrossilasi a rame (Dopamina β idrossilasi) che utilizza O2 e l’acido ascorbico come agente riducente.
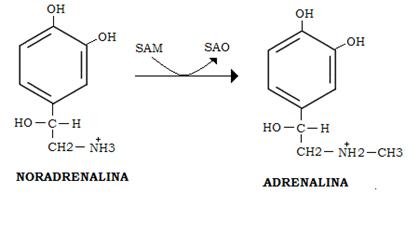
Per formare adrenalina, la noradrenalina viene metilata da una specifica transmetilasi (catecol-metil-O-metiltrasferasi) a spese della S-adenosilmetionina (SAM), enzima indotto dai glucocorticoidi.
Le catecolamine neo formate vengono accumulate in granuli cromaffini per trasporto attivo ATP-dipendente e vengono rilasciate dai granuli per esocitosi, processo calcio-dipendente, stimolato da agenti β-adrenergici e colinergici e inibito da agenti α-adrenergici.
Le catecolamine in genere vengono inattivate in un processo di O-metilazione, catalizzato dalla catecol-O-metiltrasferasi, che utilizza ancora la SAM come donatore di metili.
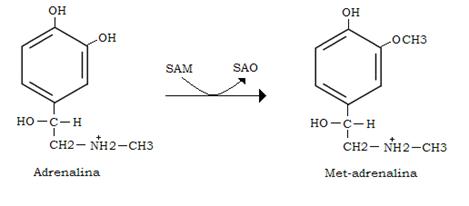
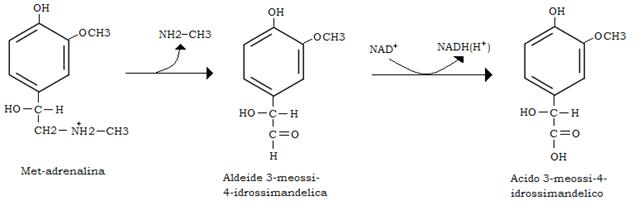
La met-adrenalina, così si chiama l’adrenalina O-metilata, può essere deaminata ossidativamente, con liberazione di metilamina (CH3-NH2) dalla monoamina ossidasi (MAO); la aldeide 3-metossi-4-idrossimandelica che così si forma viene ossidata in acido 3-metossi-4-idrossimandelico e questo eliminato con le urine.
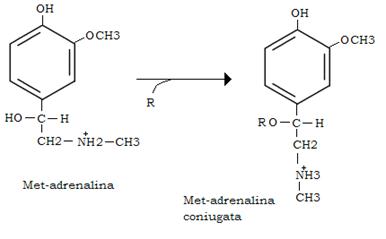
Alternativamente la met-adrenalina può essere coniugata con acido glucuronico o solforico (R) ed escreta in entrambe queste forme di coniugazione.
Il processo catabolico delle catecolamine ha sede prevalentemente epatica, dove la metilazione può precedere la ossidazione oppure seguirla, secondo circostanze non ancora ben definite.
Azione metabolica dell’adrenalina e della noradrenalina
L’adrenalina induce iperglicemia per stimolazione della glicogenolisi epatica. A differenza del glucagone che stimola solo la fosforilasi epatica, l’adrenalina stimola anche la fosforilasi muscolare e determina conseguentemente produzione e accumulo di acido lattico.
L’adrenalina stimola inoltre la lipolisi a livello del t.adiposo inducendo un aumento dei NEFA plasmatici.
Tali effetti sono mediati da aumento di cAMP, conseguente a stimolazione della adenilato ciclasi.
L’azione metabolica dell’adrenalina insieme con quella sul cuore e circolo è intesa a predisporre l’uomo o l’animale all’azione in condizioni di emergenza (combatti o scappa).
Questi effetti dipendono dalla sua interazione con i recettori β-adrenergici.
Altri effetti dell’adrenalina, dipendenti dalla sua interazione con i recettori α2-adrenergici, sono:
- vasocostrizione (azione ipertensiva)
- contrazione dell’utero
- dilatazione della pupilla
Anche la noradrenalina evoca gli effetti ricordati per l’adrenalina a seguito della sua interazione con α2 e β recettori adrenergici: l’azione della noradrenalina è però molto meno efficace di quella dell’adrenalina!!!
Recettori adrenergici
Le membrane delle cell bersaglio delle catecolamine sono dotate di 2 tipi di recettori:
- recettori adrenergici α (α1 e α2)
- recettori adrenergici β (β1 e β2)
L’adrenalina si lega a recettori sia α sia β, la noradrenalina a quelli α.
A seconda che si leghino con l’uno o con l’altro tipo, le catecolamine evocano effetti diversi.
I recettori β-adrenergici e α2-adrenergici hanno come secondo messaggero il cAMP; i recettori α1-adrenergici IP3 e Ca²+.
Il legame dell’ormone catecolaminico con recettori β-adrenergici porta all’attivazione dell’adenilato ciclasi, mentre il legame con i recettori α2-adrenergici ad inibizione dello stesso enzima, avendosi quindi nel primo caso aumento e nel secondo diminuzione dei cAMP.
I recettori β-adrenergici sono disattivati dalla fosforilazione che avviene nella porzione C-terminale della molecola ed è operata da una proteina chinasi A e da un recettore β-adrenergico chinasi.
Esistono farmaci molto usati in medicina che bloccano questi recettori prevenendo la risposta di determinate catecolamine. Il più comune è il propanolo, un β-bloccante che blocca l’azione dell’adrenalina sulla lipolisi e sulla glicogenolisi, abolendo conseguentemente l’innalzamento dei NEFA e del glucosio nel sangue.
Un α-bloccante è invece la fentolamina che abolisce molti effetti delle catecolamine a livello vasale.
Ormoni steroidei
Questi sono gli ormoni prodotti dalla corteccia surrenale e dalle ghiandole sessuali, derivanti dal colesterolo e comprendenti :
- progestigeni
- glucocorticoidi
- mineralcorticoidi (21C)
- androgeni (19C)
- estrogeni (18C)
Ormoni corticosteroidi
La corteccia surrenale elabora 3 tipi di ormoni steroidei:
- i mineralcorticoidi
- i glucocorticoidi
- gli androgeni (escluso il testosterone)
I primi 2 gruppi sono tipici della corteccia surrenale, gli androgeni sono elaborati anche ed in maggior quantità dalle ghiandole sessuali.
Chimica
Gli ormoni corticosteroidi, cortisolo, corticosterone e aldosterone, hanno le seguenti caratteristiche chimiche:
- catena laterale in C17
- 2 C e due OH in 11β e 21
- un doppio legame tra C4 e C5

Il cortisolo contiene un terzo OH (α) in 17; l’aldosterone un gruppo aldeidico in C18 (ex metile) che, idratato, può eliminare una molecola d’acqua con l’OH in 11 formando un semiacetale.
Azione
Mineralcorticoidi
Nell’uomo il principale è l’aldosterone, elaborato dalla zona glomerulosa della corteccia surrenale, stimola il riassorbimento dei Na+ e dei Cl¯ (trasporto per simporto) da parte dei tubuli renali. Il riassorbimento di questi ioni è accompagnato da riassorbimento di acqua; la pressione osmotica del sangue rimane uguale, ma il volume viene aumentato e con esso la pressione.
Una deficienza comporta un abnorme eliminazione di Na+ nelle urine, una diminuzione del volume ematico ed un’aumentata concentrazione del sangue.
L’aldosterone agisce inducendo una più intensi trascrizione del mRNA che sovrintende alla sintesi della proteina che facilita il trasporto dei Na+ nei tubuli renali.
Glucocorticoidi
Cortisolo e corticosterone sono detti glucocorticoidi perché inducono aumento della glicemia per stimolazione della gluconeogenesi epatica sostenuta dagli amino acidi, che si liberano per un accentuato catabolismo proteico soprattutto a livello dei muscoli scheletrici. La stimolazione della gluconeogenesi è ascrivibile all’induzione degli enzimi chiave che la catalizzano.
I glucocorticoidi stimolano anche la lipolisi, producendo aumento dei NEFA e dei corpi chetonici ematici.
Esplicano infine una rilevante azione anti-immunitaria, per cui trovano largo impiego in terapia come antiinfiammatori.
La loro sintesi dal colesterolo, che ha luogo nella zona fascicolata della corteccia, è stimolata dall’ACTH. A loro volta i glucocorticoidi presenti nel sangue inibiscono con meccanismo feed-back la secrezione di ACTH da parte dell’ipofisi anteriore.
Il cortisolo presente uno dei ritmi circadiani più marcati in natura!! La gran parte del cortisolo immesso in circolo nella giornata è formato nelle poche ore (2-3) che precedono il risveglio mattutino, costituendo un vero e proprio “picco” con apice circa 30 min prima del risveglio. Questo picco è preceduto di poco (poco più di un’ora) da quello dell’ACTH.
All’infuori del periodo cui corrisponde il picco, dal suo inizio alla sua estinzione (6-7 ore), la concentrazione ematica di cortisolo è pressoché nulla. Il ritmo circadiano del cortisolo è legato al ritmo riposo-attività lavorativa, piuttosto che al ritmo luce-oscurità.
I glucocorticoidi sono trasportati nel sangue da una specifica globulina, la trans cortina, glicoproteina biosintetizzata nel fegato e simile a quella addetta al trasporto degli ormoni tiroidei.
Il cortisolo di solito è eliminato come tale nelle urine.
Ormoni sessuali
Gli androgeni
Sono steroidi a 19C.
I due principali sono:
- l’androstenedione, che si forma anche nella corteccia surrenale
- il testosterone, che si forma solo nelle gonadi e che è anche il precursore degli estrogeni.
Il testosterone viene secreto in larga misura dai testicoli, dove viene sintetizzato nelle cell interstiziali (cell di Leydig) per riduzione reversibile dell’androstenedione.
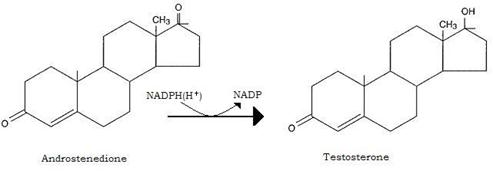
A livello degli organi bersaglio (prostata, vescicole seminali ed organi secondari maschili) agisce solo dopo sua riduzione in 5-α-diidrotestosterone ad opera di una 5-riduttasi; quest’ultimo androgeno si forma nel RE degli organi bersaglio, ma a differenza del testosterone, non può essere convertito negli estrogeni e neppure esercitare azione feed-back sulla ipofisi anteriore, dove il testosterone inibisce la secrezione di LH, l’ormone che ne stimola la sintesi e la secrezione.
Il diidrotestosterone esplica quindi pure azione “androgenica”.
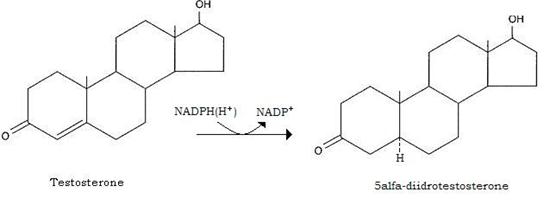
La funzione principale del testosterone è quella di incrementare la sintesi proteica attivando i sistemi di trascrizione genica a livello dei tessuti bersaglio: prostata e vescicole seminali.
È con questo meccanismo che il testosterone induce il normale sviluppo degli organi maschili addetti alla riproduzione ed i caratteri sessuali secondari (timbro voce, sviluppo peli e muscoli).
Il testosterone esplica anche azione anabolica generale stimolando la sintesi proteica anche al di fuori della sfera sessuale, per es a livello di muscoli.
È trasportato per il 75% da una β-globulina prodotta dalle cell del Sertoli (nel testicolo) in risposta all’azione degli ormoni LH e FSH.
La forma legata dell’ormone non è attiva. Le cell del Sertoli producono un ormone, l’inibina, eterodimero di unità α e β, legate con ponti disolfuro. L’inibina è liberata dallo stimolo della FSH ed esercita un effetto inibitorio sul rilascio di FSH.
Il principale catabolita degli androgeni è l’androsterone, pure dotato di attività androgena che si forma nel fegato (a partire dal 5α-diidrotestosterone ad opera della 3-idrossisteroide deidrogenasi) e che viene eliminato con la bile e le urine in forma di glucuronide.

Gli estrogeni
Sono steroidi a 18C.
Differiscono dagli altri ormoni steroidei per la natura aromatica (benzenoide) dell’anello A e per non possedere il metile angolare in C-10.
Il principale estrogeno è il 3,17-β-estradiolo che si forma nelle ovaie, ed in piccola quantità anche nei testicoli, dal testosterone.

Alto estrogeno, dotato di attività 10 volte inferiore, è l’estrone che si forma nella ghiandola corticosurrenale, nella placenta e nei testicoli, oltre che nelle ovaie, dall’androstenedione.
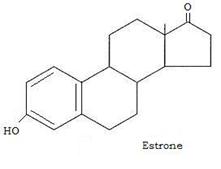
Estrone ed estradiolo sono interconvertibili in un processo enzimatico redox. Gli estrogeni vengono sintetizzati nei follicoli ovarici, il cui sviluppo è sotto il controllo del FSH ipofisario e sono trasportati nel sangue dalla stessa proteina che trasporta il testosterone (ovvero la β-globulina).
Gli estrogeni inducono i caratteri sessuali femminili e durante il ciclo mestruale la loro produzione è predominante durante la prima fase del ciclo.
Entrano nelle cell bersaglio (specialmente utero) per diffusione e si legano ad un recettore che li veicola nel nucleo.
Poiché androgeni ed estrogeni sono presenti, ma in quantità diverse, sia nei maschi che nelle femmine, mascolinità e femminilità derivano da un loro giusto equilibrio nei due sessi!!
Il progesterone
Il progesterone, che nella corteccia surrenale è l’intermedio da cui derivano gli ormoni corticosteroidi, viene sintetizzato in grande quantità nel corpo luteo ovarico in seguito a stimolo del LH ipofisario.
Ormone predominante nella seconda fase del ciclo mestruale, agisce essenzialmente a livello dell’utero per prepararvi l’impianto dell’uovo e la gestazione. In caso di gravidanza la secrezione del progesterone continua fino al parto.
È trasportato nel sangue dalla stessa glicoproteina addetta al trasporto dei corticosteroidi. Captato dal fegato, va incontro a modificazioni che lo inattivano e predispongono alla eliminazione urinaria.
Il principale metabolita del progesterone presente nelle urine è il pregnandiolo-20-glucuronide.
Sintesi degli ormoni steroidei
Tutti gli ormoni steroidei derivano dal colesterolo tramite il pregnenolone.
La reazione predominante della steroidogenesi è la idrossilazione, cioè la introduzione di gruppi –OH in corrispondenza dei vari carboni della catena laterale e del ciclopentanoperiidrofenantrene.
Gli enzimi sono le monoossigenasi od ossigenasi miste che utilizzano NADPH(H+) e O2:
R-H + O2 + NADPH(H+) à R-OH + NADP+ + H20
Dei 2 atomi dell’O2 uno va a costituire l’idrossile, l’altro a formare una molecola di acqua insieme con gli elettroni e protoni ceduti dal NADPH(H+).
L’attivazione dell’O2 avviene per trasporto di elettroni sull’ossigeno tramite una catena trasportatrice di elettroni, di cui sono molto ricchi i mitocondri delle cell della corteccia surrenalica come pure del testicolo e dell’ovaio e che ha come componente terminale il citocromo P450.
In particolare gli elettroni vengono ceduti dal NADPH(H+) ad una flavoproteina che li trasmette ad una proteina contenente centri Fe-S, denominata adrenodoxina e da questa al citocromo P450:
NADPH(H+) à Flavoproteina à Adrenodoxina à Citocromo P450
Formazione del pregnenolone
La trasformazione del colesterolo in pregnenolone implica innanzitutto la disponibilità di colesterolo, formatosi nel citosol, all’interno dei mitocondri delle cell steroidogenetiche.
Questo trasporto è assicurato da una proteina regolatrice neutra della steroidogenesi (STAR) che diventa attiva e quindi operativa per fosforilazione cAMP dipendente.
L’ACTH nella corteccia surrenalica e l’LH nelle cell ovariche e del Leydig sono responsabili dell’elevazione del livello di cAMP e quindi dell’innesco del processo che consiste nella idrossilazione successiva del C-20 e del C-22, catalizzata da specifiche monoossigenasi (20α,22 monoossigenasi).
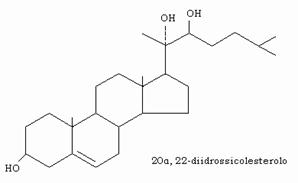
Si forma il 20α, 22-diidrossicolesterolo, che dalla colesterolo desmolasi, un enzima mitocondriale contenente eme, viene successivamente demolito in pregnenolone ed aldeide isocaproica.
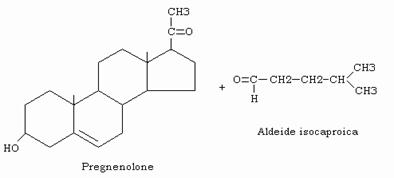
Anche questi enzimi sono indotti dall’ACTH nella corteccia surrenalica e dall’LH nei testicoli e nell’ovaio.
Sintesi del progesterone
La trasformazione del pregnenolone in progesterone avviene in due tappe:
- nella prima l’ossidrile in 3 viene ossidato a cheto gruppo dalla 3 β-olo-deidrogenasi
- nella seconda il doppio legame Δ5 viene trasferito in Δ4 dalla delta4,5 isomerasi
Entrambe queste reazioni hanno sede citosolica.
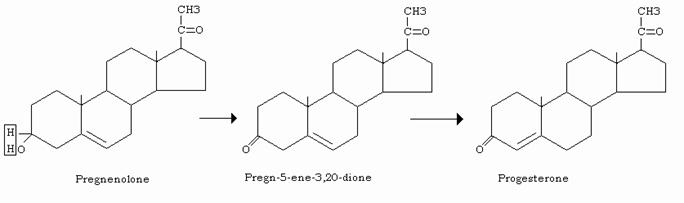
Una via alternativa, operativa nella zona fascicolata della corteccia surrenalica, consiste nella idrossilazione in C17 del pregnenolone, ad opera di una idrossilasi (pregnenolone-17-idrossilasi) residente nel RE, cui fanno seguito le reazioni catalizzate dalla 3 β-olo-deidrogenasi e delta4-isomerasi.
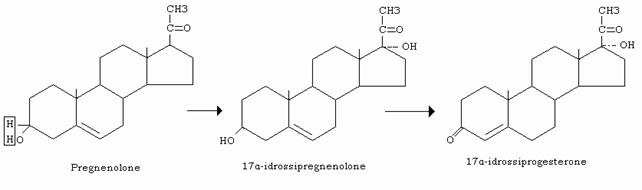
Mentre la sintesi del pregnenolone ha luogo prevalentemente nella corteccia surrenale, quella del progesterone è molto attiva anche nel corpo luteo, nella placenta e nei testicoli.
Sintesi dei corticosteroidi
Nella zona glomerulare della corteccia surrenale il progesterone viene trasformato in corticosterone per idrossilazione dei carboni 11 e 21.
La successiva ossidazione del metile angolare in 18 produce aldosterone che entra in circolo nella forma ciclizzata tra il C11 e il C18.
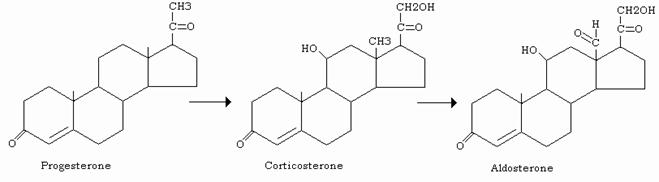
Invece nella zona fascicolata interviene dapprima la 17-idrossilasi, con formazione di 17-idrossipregnendone e quindi la 3 β-olo-deidrogenasi e la delta4,5-isomerasi e le idrossilasi in C11 e C21 con formazione finale di cortisolo.
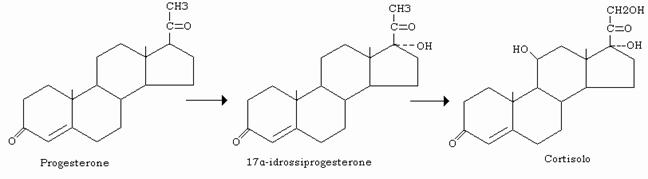
La 17-idrossilasi è sotto stretto controllo dell’ACTH e del cAMP.
Le 17- e 22-idrossilasi hanno sede citoplasmatica, mentre le 11- e 18-idrossilasi hanno sede mitocondriale.
Sintesi degli androgeni
Gli androgeni, ormoni steroidei a 19C, possono formarsi sia dal pregnenolone che dal progesterone.
Il primo processo, che ha luogo nei testicoli, nelle surrenali, nelle ovaie e nella placenta, consiste nella idrossilazione del C17 del pregnenolone con formazione di 17 α-idrossipregnenolone.
Il successivo distacco dei C20 e C21 produce il diidroepiandrosterone, che, per ossidazione del C3, forma androstenedione ed infine, per riduzione del C17, testosterone.
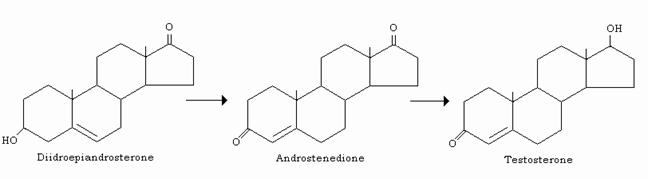
Gli enzimi coinvolti sono tutti a sede citoplasmatica.
Il testosterone viene metabolizzato a livello di tessuti a diidrotestosterone (DHT) per azione di una α-reduttasi NADPH(H+) dipendente. Il DHT è molto più attivo del testosterone.
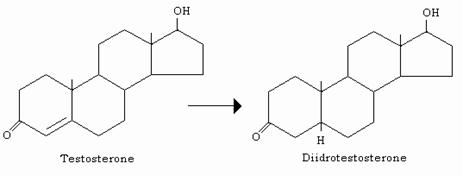
L’altra via sintetica, più attiva nelle gonadi che nella corteccia surrenale, inizia dal progesterone che viene α-idrossilato in C17 e successivamente decurtato della catena laterale (C20 e C21); si forma l’androstenedione e per riduzione del cheto gruppo in 17, il testosterone.
Sintesi degli estrogeni
Gli estrogeni, costituiti da 18C, si formano dal testosterone e dall’androstenedione principalmente nelle ovaie.
Dal testosterone deriva il 17 β-estradiolo (che è il più attivo) per azione di una aromatasi e di una 17-reduttasi.
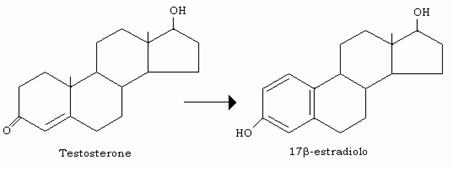
Dall’androstenedione deriva l’estrone, per azione della aromatasi.
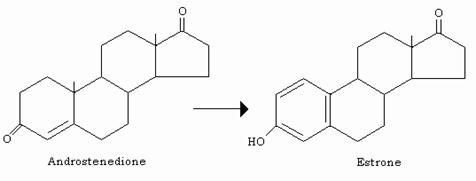
L’estrone si forma anche nella corteccia surrenale e nella placenta.
In questa sintesi viene perduto il metile angolare in C10 e l’anello A assume la configurazione benzenoide, a seguito delle reazioni catalizzate dall’aromatasi.
Ormoni placentari
La placenta produce un ormone polipeptidico, la somatomammotropina corionica o lattogeno placentare o gonadotropina corionica (CG) e due ormoni steroidei, l’estradiolo e progesterone.
La gonadotropina corionica umana (hCG) è una glicoproteina biosintetizzata dalle cell del sincizio trofoblasto della placenta; possiede la struttura di dimero α/β caratteristica delle gonadotropine.
La subunità α ha la stessa struttura di quella delle gonadotropine ipofisarie.
La subunità β ha una marcata omologia di sequenza con la β dell’LH ma ne è più lunga di 24 residui nella porzione C terminale.
Questo ormone ha attività lattogenica e luteotropica, con
- promozione dei processi di crescita e differenziamento (a carico del feto)
- inibizione dell’accumulo di glucosio,
- stimolazione del rilascio di acidi grassi e del glicerolo dal t.adiposo
- aumento della ritenzione di azoto e calcio.
Gli ormoni steroidei concorrono a indurre uno stato di resistenza all’insulina.
Eicosanoidi
Con il termine “eicosanoidi” si intendono i derivati degli acidi grassi a 20 atomi di C, a loro volta provenienti dagli acidi grassi essenziali ed in particolare dall’acido arachidonico.
Comprendono diverse classi di sostanze:
- le prostaglandine
- le prostacicline
- i trombossani
- i leucotrieni
- le lipossine
Sono considerati ormoni locali o tissutali, agiscono infatti come messaggeri a breve raggio (ormoni paracrini).
Vengono sintetizzati da quasi tutti i tessuti, nell’ambito dei quali esplicano la loro azione o in modo diretto oppure “modulando” l’azione di altri ormoni.
Struttura chimica dei principali eicosanoidi
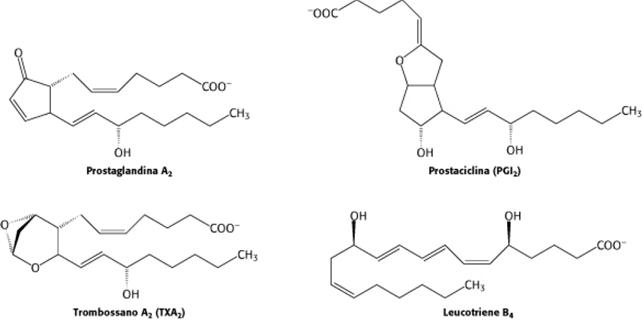
Le prostaglandine e le prostacicline sono derivati dell’acido prostanoico, un acido carbossilico a 20 C, costituito da un anello ciclo pentano e da due catene alifatiche:
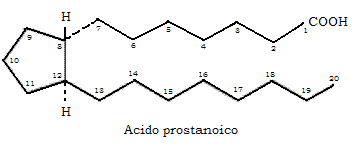
Le prostaglandine (PG) sono classificate in 8 serie a seconda delle caratteristiche dell’anello ciclo pentano (PGA, PGB, PGD, PGE, PGF, PGG/PGH e PGI).
I trombossani sono caratterizzati invece dalla presenza di un anello eterociclico contenente ossigeno e classificati in TXA e TXB, dove i primi contengono un ulteriore atomo di ossigeno tra il C9 e il C11.
Alla famiglia degli eicosanoidi appartengono alcuni intermedi metabolici:
- HPETE, idroperossidi
- HETE, idrossidi
- EET, epossidi
- diHETE, di idrossidi
degli acidi grassi progenitori degli eicosanoidi.
Biosintesi e catabolismo
Gli eicosanoidi sono sintetizzati a partire dall’acido arachidonico.
Allo stato libero questo è presente in tutti i tessuti in concentrazioni bassissime, pressoché inefficaci come substrato, mentre è presente in elevate quantità nei fosfolipidi di membrana, dai quali viene liberato per azione della fosfolipasi A2, enzima presente allo stato silente nelle membrane stesse e attivato dai Ca²+.
L’azione antiinfiammatoria degli steroidi è dovuta all’azione inibitoria da essi esercitata sulla fosfolipasi A2.
L’acido arachidonico è sempre nella posizione 2 del glicerolo!
La biosintesi degli eicosanoidi è governata da 2 enzimi fondamentali:
- la acido grasso cicloossigenasi che dà inizio alla formazione di prostaglandine, prostacicline e trombossani (via ciclica)
- la acido grasso lipoossigenasi che conduce alla produzione di leucotrieni, lipossine e HETE (via lineare)
La cicloossigenasi è parte del complesso enzimatico prostaglandina sintetasi, legato alle membrane del REL e del nucleo ed è costituita da un dimero contenente il gruppo eme come cofattore.
Il complesso enzimatico catalizza due reazioni consecutive:
- la prima, catalizzata dalla cicloossigenasi, consiste nell’addizione di due molecole di ossigeno, una in C9/C11 ed una in C15 con contemporanea formazione del legame fra C8 e C12. Si produce così la PGG2.
- la seconda, catalizzata da una idroperossidasi glutatione dipendente, è una idroperossidazione in C15 che porta alla trasformazione della PGG2 in PGH2.
La parte del processo biosintetico governato dalla prostaglandina sintetasi è comune a tutti i tessuti; le ulteriori tappe invece procedono in modo specifico nei singoli tessuti.
La cicloossigenasi presenta la peculiare proprietà di auto-inattivarsi dopo 15-30 secondi di attività (enzima suicida), dando quindi alla propria azione carattere di discontinuità.
L’aspirina esplica la sua azione farmacologica inibendo per acetilazione (addizione di un gruppo acetile su una serina della COX) e quindi irreversibilmente la cicloossigenasi e conseguentemente inibendo la sintesi delle prostaglandine e dei composti affini.
L’aspirina è stata scoperta da Edmund Stone che notò che il salice aveva proprietà terapeutiche nei confronti dei dolori e della febbre. Successivamente venne purificato il principio attivo, l’acido acetilsalicilico, dalla Spirea (una pianta) e il farmaco venne denominato aspirina.
È usata per le sue proprietà antidolorifiche e antipiretiche (contro la febbre) e, nei pazienti a rischio di infarto, per la sua capacità di inibire la coagulazione del sangue e l’aggregazione piastrinica.
L’uso prolungato può dare effetti collaterali seri: ulcere allo stomaco e danno renale. Sono allo studio nuovi NSAID (farmaci anti-infiammatori non steroidei).
L’ibuprofene è un altro farmaco antiinfiammatorio non steroideo (NSAID o FANS) che inibisce la stessa tappa della sintesi, ma con un meccanismo diverso: la imitazione del substrato.
 IBUPROFENE
IBUPROFENE
Ci sono due tipi di COX, la COX1 e la COX2, due isoenzimi che differiscono nella struttura primaria per il 35-40%.
La COX1 è espressa nell’epitelio gastrico ed è responsabile della secrezione della mucina gastrica.
La COX2 è responsabile della infiammazione del dolore e della febbre.
L’aspirina inibisce ugualmente la COX1 e la COX2.
NB: La trombossano sintasi presente nelle piastrine converte la PGH2 in trombossano A2 da cui derivano tutti i trombossani.
La lipoossigenasi, che pure è attiva sull’acido arachidonico liberato dai fosfolipidi di membrana, è un enzima citosolubile che catalizza l’addizione di una molecola di ossigeno a livello di un doppio legame con formazione di un gruppo idroperossido.
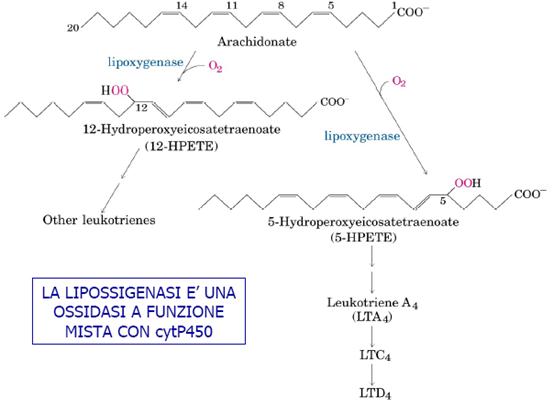
Gli eicosanoidi hanno vita molto breve in quanto vengono inattivati in situ (attraverso processi riduttivi a livello dei doppi legami) oppure, una volta in circolo, nel tessuto polmonare.
Il catabolismo polmonare degli eicosanoidi è così rapido che vi vengono completamente demoliti dopo un solo passaggio attraverso il letto polmonare!!
Funzione
Prostaglandìne
Esplicano una notevole varietà di azioni anche a concentrazioni molto basse (nano molari).
Sono innanzitutto i mediatori naturali dell’infiammazione e sono coinvolti nella regolazione della temperatura corporea.
Un secondo bersaglio delle prostaglandine è la muscolatura liscia, la cui contrazione può essere stimolata o inibita.
La PGE e la PGA, ad es, determinano vasodilatazione e broncodilatazione, le PGF vasocostrizione e broncocostrizione.
La PGF2 e la PGE2 inibiscono la mobilità e il tono dell’utero non gravido, mentre stimolano la contrazione dell’utero gravido.
Molte azioni delle prostaglandine sono mediate dal sistema adenilato ciclasi/cAMP/proteine chinasi A in senso sia attivatorio che inibitorio.
In molti tessuti agiscono modulando l’azione degli ormoni sulla adenilato ciclasi, a volte amplificandone l’effetto, come nel caso del TSH sulla tiroide o dell’ACTH sulle ghiandole surrenali, a volte riducendolo (freno metabolico) come nel caso dell’adrenalina sul t.adiposo.
A livello del sistema nervoso le prostaglandine possono modificare l’azione dei neurotrasmettitori. Le PGE ad es inibiscono il rilascio della noradrenalina nella stessa sinapsi e quindi la sua azione.
Trombossani e prostacicline
Agiscono in modo antagonistico su alcune funzioni.
I trombossani sintetizzati nelle piastrine hanno azione vasocostrittrice, specie sul distretto coronarico, fortemente aggregante le piastrine ed ipertensiva.
Per contro le prostacicline, prodotte dalle pareti dei vasi, hanno azione vaso dilatante, antiaggregante ed ipotensiva.
Leucotrieni e lipossine
Formatisi abbondantemente nei globuli bianchi i leucotrieni facilitano la chemotassi (movimento di una cell lungo un gradiente di concentrazione di una determinata sostanza chimica), i processi infiammatori e le reazioni allergiche.
L’LTC4 e LTD4 hanno azione vasocostrittiva bronchiolare 1000 volte superiore a quella esercitata dall’istamina.
I leucotrieni facilitano il rilascio di liquido da parte dei piccoli vasi sanguigni ed hanno effetto costrittore sulle arterie coronariche.
Le lipossine esercitano azione vasocostrittrice e hanno un ruolo immunodepressivo.
I recettori per gli eicosanoidi
Gli eicosanoidi esplicano la loro azione per lo più legandosi a recettori metabotropi specifici presenti sulle cell. bersaglio.
Questi recettori possono attivare o inibire l’adenilato ciclasi o attivare la fosfolipasi C.
Gli eicosanoidi sembrano anche agire tramite recettori nucleari.
Fonte: http://www.medwiki.it/sites/default/files/Biochimica%20degli%20ormoni.doc
Sito web da visitare :http://www.medwiki.it/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Biochimica degli ormoni tipo file : doc
Visita la nostra pagina principale
Biochimica degli ormoni
Termini d' uso e privacy