Biochimica del muscolo
Biochimica del muscolo
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Biochimica del muscolo
Il citoscheletro è costituito da:
- microtubuli
- microfilamenti
- filamenti intermedi
Microtubuli
Sono strutture cilindriche, cave all’interno, con diametro di 24nm, risultanti dalla polimerizzazione lineare della tubulina, proteina dimerica formata da 2 subunità globose:
- la α-tubulina
- la β-tubulina
Entrambe le tubuline legano il GTP in un’apposita nicchia.
Le 2 subunità saldamente coese in presenza di Ca²+, si giustappongono longitudinalmente formando protofilamenti che si allineano l’uno accanto all’altro: in una sezione trasversale compaiono 13 protofilamenti.
I microtubuli sono strutture dinamiche con continua aggregazione longitudinale di dimeri di tubulina e altrettanto continua disaggregazione. L’estremità dove avviene l’aggregazione è l’estremità più, quella dove avviene la disaggregazione l’estremità meno.
L’energia necessaria è fornita dall’idrolisi di GTP.
I microtubuli spesso si appaiono (vedi assonemi di ciglia e flagelli) con parziale fusione e condivisione di 3 protofilamenti, costituendo una coppia (o paio) in cui un sottotubulo (A) ha minore diametro e l’altro (B) un maggiore diametro.
Alla costituzione del microtubulo partecipano particolari proteine, tra cui le dineine, proteine ad attività ATPasica, costituite da 2 o 3 catene pesanti (α,β,γ) e parecchie catene leggere.
Le catene leggere, posizionate ad un’estremità della dineina, interagiscono con la parte flessibile delle catene pesanti le quali si continuano con una porzione globosa centrale e terminano con una porzione più allungata nella quale risiede l’ATP-asi.
La dineina è coinvolta nella motilità di ciglia e flagelli; essa infatti si ancora stabilmente ad un sottotubulo A di un paio di microtubuli attraverso le proprie catene leggere a loro volta collegate alla porzione “flessibile” delle catene pesanti. La porzione terminale delle catene pesanti si aggancia invece al sottotubulo B di un altro paio di microtubuli.
L’aggancio è ATP dipendente: in presenza di ATP l’aggancio è impedito; con intervento della ATPasi, che idrolizza ATP, la catena pesante subisce una modificazione conformazionale che le consente di arpionare il sottotubulo B e fare così allontanare questo paio di microtubuli da quello cui è stabilmente attaccata l’altra estremità della dineina.
L’ingresso di ATP sulla catena pesante riconduce allo stato di partenza.
L’attività intermittente e pulsatoria della ATPasi diventa quindi uno strumento di motilità!
Altre proteine implicate sono le chinesine e il processo interessato è il movimento intracell di organelli quali mitocondri, vescicole e corpi multi vescicolari: l’esempio tipico è il flusso assonale.
Le chinesine sono costituite da diverse subunità distinte in catene leggere poste ad un’estremità e catene pesanti (globose) all’altra.
Analogamente alle dineine, le catene leggere si ancorano stabilmente alla superficie dell’organulo mentre quelle pesanti, che posseggono attività ATPasica, si attaccano (con arpionamento), o staccano, alle strutture micro tubulari consentendo un “cammino” dell’organulo lungo il microtubulo nella direzione, in questo caso, dall’estremità meno a quella più.
L’energia necessaria è fornita dall’idrolisi di ATP e l’attività pulsatoria e intermittente dell’ATPasi ne è lo strumento operativo.
Dineine e chinesine sono tipici esempi di “motori molecolari”.
Microfilamenti
Derivano dalla polimerizzazione lineare di almeno 2 tipi di proteine globose:
- l’actina α
- l’actina γ
Le actine monomeriche sono actine-G, il filamento di actina, actina-F.
Due filamenti di actina si attorcigliano l’uno sull’altro formando una doppia elica. I filamenti di actina fluttuano nel citosol, si collegano l’uno con l’altro o con componenti della membrana plasmatica attraverso proteine globose di connessione chiamate filamine.
Nel contempo interagiscono con molecole di miosina, di solito aggregate in dimeri, che, arpionando i filamenti di actina con reazioni meccanico-chimiche ATP-dipendenti, provocano movimenti intracell.
I microfilamenti sono coinvolti nelle modificazione di conformazione delle cell e nel processo della citocinesi: formazione dell’anello contrattile.
Filamenti intermedi
Sono strutture fibrose di natura proteica formate da molecole allungate con dominio centrale a bastoncello ed estremità amino- e carbossi-terminale più affusolate, spesso associate in fasci a disposizione elicoidale.
Generalmente sono molecole stabili e costituiscono una sorta di impalcatura delle cell.
Filamenti intermedi sono:
- le cheratine, di tipo I (acide) e II (basiche), presenti nelle cell epiteliali, nei capelli e nelle unghie
- il gruppo delle vimentine, comprendenti
- la vimentina, presente in varie cell mesenchimali
- la desmina del muscolo
- la proteina acida fibrillare gliare presente nelle cell gliari
- la periferina abbondante nei neuroni
- neuro filamenti tipici delle cell neuronali
- le lamine presenti nei nuclei, che al momento della mitosi vanno incontro a fosforilazione e si dissociano, per poi riassociarsi a mitosi conclusa.
Il tessuto muscolare
Proprietà generali
Le cell muscolari, o miociti, hanno come prerogativa funzionale la capacità contrattile; infatti il loro citoplasma è molto ricco di strutture contrattili, le miofibrille.
Il t.muscolare si differenzia in:
- scheletrico
- cardiaco
- liscio
Le cell del t.muscolare scheletrico sono di forma cilindrica e provviste di numerosi nuclei, hanno lunghezza variabile da 1 a 40mm, e sono anche denominate fibre muscolari.
Nel muscolo cardiaco le cell (cardiomiociti) sono pure cilindriche, più piccole e prevalentemente mononucleate, connesse tra di loro con dischi intercalari. Costituiscono un sistema sinciziale.
I miociti del muscolo liscio sono cell fusiformi, mononucleate.
Caratteristica dei miociti scheletrici e cardiaci sono le strutture trasversali (striature) che riflettono l’architettura muscolare ordinata delle miofibrille.
Tra le proteine che si ritrovano nei muscoli vanno distinte:
- le proteine miofibrillari a funzione contrattile
- le proteine strutturali e regolatorie
- le proteine enzimatiche che sostengono il metabolismo muscolare
Il sistema muscolare scheletrico è sostenuto e controllato dal sistema nervoso volontario, quello cardiaco e liscio dal sistema nervoso vegetativo.
Tessuto muscolare scheletrico
Miofibrille e sarcomeri
L’unità costitutiva è la fibra o cell muscolare a forma cilindrica e molto allungata. Più unità cell sono riunite in parallelo l’una sull’altra, in un fascio. Ogni muscolo è costituito da più fasci, tenuti insieme da t.connettivo.
Ogni fibra o cell muscolare è delimitata dalla membrana plasmatica (sarcolemma) e contiene parecchi fasci di miofibrille.
Il sarcolemma presenta un’introflessione che delimita un “canalicolo” decorrente perpendicolarmente all’asse longitudinale della fibra muscolare: il sistema tubulare trasverso (sistema a T).
Il reticolo sarcoplasmatico è formato a una rete continua di canalicolo a decorso parallelo ai fasci di miofibrille; tali canalicoli confluiscono in un tubulo + grosso a disposizione trasversale che decorre contiguamente ai canalicoli sarcoplasmatici trasversi ed è chiamato cisterna terminale.
Ogni cell contiene più nuclei a forma ellissoidale con l’asse maggiore parallelo all’asse della cell; i nuclei si trovano immediatamente sotto il sarcolemma con l’apparato di Golgi ad essi adiacente.
I mitocondri sono dislocati in parte sotto il sarcolemma ed in parte tra le miofibrille in una disposizione molto ordinata; i primi fornirebbero l’ATP alle pompe del sarcolemma e del reticolo sarcoplasmatico, i secondi lo fornirebbero al sistema contrattile.
Ciascuna miofibrilla consta a sua volta di miofilamenti, di 2 tipi:
- spessi
- sottili
Essi sono intercalati ordinatamente tra loro in modo da conferire alla cell muscolare il classico aspetto striato per l’alternarsi di bande scure (birifrangenti o anisotropiche) o bande A e chiare (isotropiche) o bande I.
Le bande I sono a loro volta dimezzate da una linea densa, la linea Z, mentre le bande A possiedono al centro una banda molto meno densa, la banda H, a sua volta dimezzata da una linea densa, detta linea M.
Il sarcomero, o unità ripetitiva della miofibrilla, è il segmento che si estende tra due linee Z contigue.
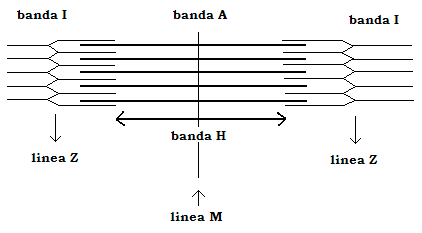
Banda A à contenente i miofilamenti spessi intercalati con una parte dei miofilamenti sottili
Banda (o zona) H à la parte della banda A in cui i miofilamenti spessi non si intercalano con quelli sottili
Banda I à la parte del sarcomero contenente la porzione dei miofilamenti sottili che non si intercalano con quelli pesanti
Linea Z à contiene le proteine strutturali a disposizione trasversale, alle quali si agganciano i miofilamenti sottili
Linea M à contiene le proteine strutturali, pure disposte trasversalmente, cui si agganciano “coda a coda” le due parti dei miofilamenti pesanti.
Struttura proteine miofibrillari
Miofilamenti spessi
La loro principale proteina è la miosina, a forma di lungo bastoncello, è costituita da due identiche catene pesanti e da due paia di catene leggere.
Alle estremità N-terminali le due catene pesanti, per il resto della loro lunghezza attorcigliate ad α-elica, formano due regioni globulari (teste), contenenti ε-N-metil ed ε-N-trimetilistidina alle quali sono associate le catene leggere che possono pure contenere ε-N-trimetilistidina.
Le catene leggere sono di due tipi:
- LC1 e LC3 con sequenza C-terminale identica di 141 aminoacidi
- LC2
Ciascuna testa della miosina si associa con una LC2, l’altra catena leggera può essere LC1 o LC3.
La regione globulare della miosina è sede dell’attività ATPasica e dei siti di interazione con l’actina.
La tripsina scinde la miosina in 2 frammenti:
- uno completamente fibroso (meromiosina leggera)
- uno in parte fibroso e in parte globulare (meromiosina pesante)
La papaina scinde invece la miosina nella frazione globulare e in quella pesante.
I siti di idrolisi delle due proteasi che non hanno struttura ad α-elica ma disordinata, costituiscono due “snodi” che consentono un certo movimento della parti articolantivisi e giocano un ruolo importante nel processo della contrazione.
I due fasci di miosine sono contrapposti tra di loro e si dispongono “coda a coda” per cui la porzione mediana del filamento è priva di “teste”; nel mezzo di questa porzione, in corrispondenza della linea M, le code dei due fasci di miosina si ancorano alle proteine della linea M, rimanendo così di fatto agganciate tra di loro.
Ogni testa della miosina si può suddividere in due regioni:
- il collo in continuità con la coda
- il dominio motore dove ha sede l’attività ATPasica (enzima Mg²+-dipendente)
Il collo è costituito da un dominio della catena pesante a struttura lineare; a questo dominio si associano le due catene leggere: una, LC2, fosforilabile su un resto di serina, con funzione regolatrice e un’altra (LC1 o LC3) con funzione stabilizzatrice.
È all’interno del collo che è collocato uno degli snodi o cerniere di ripiegamento della molecola.
La rimanente porzione della miosina contiene:
- il sito catalitico della ATPasi
- quattro siti di interazione con l’actina
- un dominio molto compatto, detto convertitore, che, a seguito dell’idrolisi di ATP e dell’attacco sulla miosina di ADP e Pi, imprime al collo un movimento rotatorio di 90° con arpionamento e trascinamento dell’actina. È questo il dominio motore della miosina quando si ancora all’actina!
Miofilamenti sottili
Sono costituiti dalle doppie eliche allungate dell’actina e da due proteine regolatrici: la tropomiosina e la troponina.
Actina
È una proteina globulare costituita da 376 residui di aminoacidi, uno dei quali è la ε-N-trimetilistidina.
Quando viene isolata dal muscolo, l’actina è in forma globulare legata ad una molecola di ATP (G-actina-ATP).
Sono riconoscibili 4 domini: i domini 1 e 2 esposti sulla superficie e più piccoli e i domini 3 e 4, più grandi, situati all’interno della molecola.
Il dominio 1 che contiene entrambe le estremità N- e C-terminali, è quello maggiormente coinvolto nelle interazioni con la miosina.
I domini 3 e 4 sono coinvolti nelle interazioni con altri monomeri di actina.
In un solco tra il dominio 2 e il 4 è collocato l’ATP.
Per aggiunta di Mg²+ o Ca²+ la actina-G polimerizza in actina-F costituita da 13-14 molecole di actina-G sistemate in sequenza a doppia elica allungata.
La reazione di polimerizzazione è la seguente:
nactina-G + nATP + nCa²+ à n-actina-ATP-Ca²+
n-actina-G-ATP-Ca²+ à actina-F-ADPn + nCa²+ + nPi
L’inserimento dell’ADP rende l’actina-F più stabile.
La funzione dell’actina è duplice:
- interagire con le teste della miosina, formando il complesso acto-miosina
- stimolare (circa 200 volte) l’attività ATPasica della miosina
Tropomiosina
Una proteina a forma di bastoncino, costituita da 2 catene (α e β) fra loro avvolte ad α-elica.
I filamenti di tropomiosina sono alloggiati in solchi formati da due sequenze di actina-F a contatto con 7 monomeri di actina.
In taluni tratti dei filamenti di actina molecole adiacenti di tropomiosina si sovrappongono in configurazione testa-coda; le zone di sovrapposizione sono quella in cui sono alloggiate le tre subunità di troponina.
La tropomiosina ha azione regolatrice sulla interazione actina-F/miosina alternativamente esponendo o mascherando i siti di legame dell’actina e della miosina in rapporto con la sua capacità di legarsi al Ca²+.
Troponina
È costituita da 3 subunità funzionalmente distinte:
- troponina C (Tn-C)
- troponina I (Tn-I)
- troponina T (Tn-T)
La troponina C presenta 3 domini, due a struttura globulare collocati nella estremità N- e C-terminali ed uno a struttura lineare.
Entrambe le strutture globulari hanno siti di leganti i Ca²+ (ad elevata affinità quelli collocati C-terminalmente, a bassa affinità quelli collocati N-terminalmente).
Quando la concentrazione dei Ca²+ raggiunge la 10¯ molarità la Tn-C, legandosi ai Ca²+, cambia la propria conformazione provocando:
- lo spostamento della tropomiosina dalla scanalatura dei filamenti di actina con conseguente smascheramento dei siti dell’actina capaci di interagire con la miosina
- la rimozione dell’azione inibitorie della Tn-I.
A seguito di queste modificazioni le teste della miosina possono arpionare e spostare le catene di actina.
La troponina I impedisce le interazioni tra actina e miosina e inibisce l’attività ATPasica della miosina. La sua azione viene completamente bloccata quando la Tn-C, satura di Ca²+, le si lega.
La troponina T, di conformazione allungata, possiede siti di legame con la tropomiosina, l’actina, la Tn-I e la Tn-C.
Alle basse concentrazioni di Ca²+ il complesso di tropomiosina e troponina è fissato all’actina attraverso la Tn-I con effetto di blocco alla formazione del complesso contrattile actina-miosina.
A più elevate concentrazioni di Ca²+, l’effetto inibitorio della Tn-I viene rimosso, la tropomiosina consente le interazioni tra actina e miosina e partecipa alla attivazione l’ATPasi miosinica.
Proteine strutturali e regolatorie
Miosina e actina costituiscono circa il 65% delle proteine totali del muscolo striato (43% la miosina, 22% l’actina); la tropomiosina e le troponine intorno al 5%.
Il rimanente 30% è suddiviso tra le proteine strutturali e regolatorie, strettamente correlate con gli eventi contrattili e proteine responsabili degli eventi metabolico-funzionali propri del muscolo (enzimi, pompe, canali, trasportatori..).
Proteine strutturali
Tra di esse figurano:
- la α-actinina, la desmina, la eu-actinina, la filamina, la vimentina, la sinemina, la proteina Z e la Z-nina. Tutte queste interagiscono con la actina in corrispondenza dei suoi contatti con la linea Z.
- la proteina M, la miomesina, la proteina H che fanno parte della linea M e interagiscono con le estremità N-terminali della miosina
- la titina e la nebulina che assieme costituiscono il 15% delle proteine totali del muscolo striato; la prima a struttura elastica e la seconda inestensibile si agganciano a due linee Z opposte e connettono le linee Z con le estremità vicine delle catene miosiniche, impedendo che a seguito di un’eccessiva distensione il sarcomero si sfibri
- le proteine che connettono il sarcolemma con l’apparato contrattile e quelle che, attraverso il sarcolemma, stabiliscono una comunicazione tra l’apparato contrattile e la matrice extracell;
- tra le prime figurano la spectrina, la viniculina, l’anchirina e la talina che stabilizzano i legami tra il sarcolemma e l’actina-F a livello della linea Z
- tra le seconde riveste particolare significato il complesso distrofina-glicoproteine di membrana, la cui parte centrale, inserita nel sarcolemma, è costituita dal β-distroglicano e dal sarcoglicano (a sua volta formato da 5 subunità: α,β,γ,δ,ε), molecole altamente glicosilate.
Il β-distroglicano, con la porzione esposta all’esterno della cell, è ancorato all’α-distroglicano, pure glicosilato, che funge da sito recettoriale; si può infatti agganciare, attraverso la laminina alle strutture della matrice extracell.
Lo stesso β-distroglicano, con la porzione esposta all’interno della cell, interagisce con la distrofina, proteina a struttura filamentosa.
Quattro filamenti si aggregano tra di loro e si avvolgono a spirale.
Le porzioni C-terminali dei filamenti di distrofina si ancorano all’estremità C-terminale del β-distroglicano, mentre le estremità N-terminali si legano all’actina-F.
La stessa regione C-terminale della distrofina interagisce anche con altre proteine, la distrobrevina e le sintrofine.

Al complesso distrofina-glicoproteine si attribuisce la funzione di stabilizzare la membrana sarcoplasmatica durante i cicli di contrazione e rilasciamento del muscolo, di correlare la forza contrattile generata dalla fibra con l’ambiente extracell e di mantenere ferma la topologia delle proteine di membrana nel corso dell’attività contrattile.
Proteine regolatorie
Si classificano come
- proteine associate alla miosina
- proteine associate all’actina
distinte da quelle addette ai contatti della miosina e dell’actina rispettivamente con la linea M e la linea Z.
Tra le prime abbiamo la proteina C, la creatina chinasi, la proteina F.
Tra le seconde la γ-actinina (che inibisce la polimerizzazione della G-actina) e la β-actinina, a struttura dimerica, che avvolge l’estremità libera dei filamenti di actina; infine la proteina I e la paratropomiosina che inibiscono le interazioni actina-miosina.
Meccanismo della contrazione del muscolo scheletrico
La contrazione muscolare è riconducibile ad un transitorio e reversibile accorciamento dei sarcomeri determinato dalla successione degli eventi qui di seguito riportati.
Segnale neurochimico
L’impulso nervoso, che scorre lungo il nervo motore, fino alla placca neuromuscolare, è trasmesso al sarcolemma, depolarizzandolo, e vi si propaga.
Il sarcolemma è a contatto con il reticolo sarcoplasmatico a livello delle linee Z ed è proprio qui che l’onda di depolarizzazione si trasmette direttamente alla membrana del reticolo provocando l’apertura dei canali del Ca²+.
Pertanto dalle cisterne del reticolo fuoriescono i Ca²+, la cui concentrazione nel citosol sale rapidissimamente e ciò provoca l’immediato accorciamento del sarcomero.
Passata l’onda di eccitamento i canali del Ca²+ si chiudono e questo viene riassorbito nelle cisterne sarcoplasmatiche ad opera delle pompe del Ca²+ e il sarcomero si rilascia, ritornando allo stato di riposo.
Più in dettaglio l’onda di depolarizzazione attiva i canali sarcolemmici del Ca²+ voltaggio dipendenti (VOCC), costituiti da una subunità α1, attorniata da una α2, β, γ e δ. Queste subunità definiscono il poro attraverso cui passa il Ca²+ e il sensore del voltaggio che, quando investito dall’onda, induce una modificazione sterica che mette in collisione il VOCC con il canale del Ca²+ del reticolo endoplasmatico che si apre e lascia fuoriuscire il Ca²+.
Il rientro nelle cisterne è operato dalla Ca²+-ATPasi-Mg²+-dipendente, che serve come pompa del Ca²+ sostenuta dall’energia fornita dall’ATP.
Tale pompa trasferisce 2 Ca²+ ioni per ogni molecola di ATP usata; in effetti il fosfato terminale dell’ATP fosforila l’enzima a livello del gruppo carbonilico di un residuo di acido aspartico.
L’autofosforilazione modifica la conformazione della pompa con drastico cambiamento dell’affinità dei siti Ca²+-leganti presenti sulla stessa.
A seguito della fosforilazione tali siti quindi diminuiscono l’affinità per il Ca²+ che viene quindi rilasciato e captato, all’interno della porzione intramembrana della pompa, dai siti per il Ca²+ diventati + affini e collocati verso la faccia luminare della membrana reticolare.
In questo modo il Ca²+ passa dal citosol a lume del reticolo.
Modificazioni conformazionali dei miofilamenti dipendenti dalla presenza di Ca²+
Nella condizione di riposo la tropomiosina, adagiata lungo la scanalatura delle due catene di actina-F, copre (e maschera) i siti dei monomeri di actina-G capaci di interagire con le teste di miosina.
Inoltre la Tn-I e la Tn-T, associandosi alla tropomiosina, contribuiscono a tenere distante l’actina-G dalle teste di miosina.
L’aumento della concentrazione citosolica del Ca²+ porta a saturare i siti di legame per il Ca²+ della Tn-C, rende attiva l’ATPasi contenuta nelle teste della miosina e stimola la miosina chinasi presente nel citosol (questa proteina è un dimero, di cui una subunità è costituita dalla calmodulina ad azione attivatoria, che esercita la sua azione a concentrazione di Ca²+ intorno a 10¯).
Ciò provoca:
- un completo riassetto delle interazioni tra actina, tropomiosina e troponine, con esposizione dei siti di attacco dell’actina per le teste della miosina
- la sostituzione dell’ATP con ADP e Pi sulle catene pesanti delle teste miosiniche a seguito dell’azione ATPasica
- la fosforilazione delle catene leggere delle teste miosiniche che facilita le interazioni tra actina-G e miosina
L’entrata in funzione dell’ATPasi è l’evento centrale di innesco della contrazione (reazione meccanico-chimica).
Nella fase iniziale del processo, l’energia derivata dalla rottura del legame pirofosforico terminale dell’ATP è intrappolata nella forma di “miosina energizzata” in cui sia l’ADP che il Pi sono legati alla miosina.
La miosina energizzata va incontro ad una modificazione conformazionale per cui le teste miosiniche si piegano di circa 90° in corrispondenza dello snodo flessibile sensibile alla papaina e si agganciano al sito legante di una actina-G in corrispondenza della zona di contatto con tropomiosina e troponina.
Il legame che si stabilisce è labile, ma sufficiente a determinare uno “spostamento” del filamento actinico verso la banca H.
Nel complesso formatosi l’actina esercita la sua potente azione attivatoria sulla ATPasi il che provoca una ulteriore modificazione conformazionale e un ripiegamento di altri 45° delle teste miosiniche, in corrispondenza dello snodo flessibile sensibile alla tripsina; le teste miosiniche arpionano la catena actinica spingendola con forza fino a 10nm entro la banda H.
Si arriva così ad avere una parziale sovrapposizione delle catene actiniche ancorate a due linee Z opposte.
In questa fase del processo si ha liberazione del Pi.
Il sarcomero risulta accorciato e dato che tutti i sarcomeri di una fibra muscolare eccitata sono pressoché contemporaneamente stimolati alla contrazione, l’intera fibra muscolare si accorcia.
Esauritasi la stimolazione motoria, gli ioni Ca²+ sono rapidamente pompati entro il reticolo sarcoplasmatico e gli eventi promossi dai Ca²+ interrotti.
La ATPasi cessa di funzionare, la Tn-C ritorna alla configurazione di partenza e l’ATP sostituisce l’ADP sulla miosina.
Anche la miosina-chinasi, esauritosi i Ca²+, diventa inattiva e una miosina-fosfatasi, costantemente presente nel citosol, stacca il fosfato dalle catene leggere delle teste miosiniche.
Il sarcomero ritorna alla configurazione di partenza e la fibra muscolare è rilasciata.
Tipologia delle fibre muscolari scheletriche
I muscoli scheletrici sono costituiti da 2 tipi di fibre:
- le fibre I o fibre lente o rosse, ricche di mioglobina e mitocondri
- le fibre IIA e IIB o fibre rapide o bianche, povere in mitocondri
Le prime hanno grande capacità ossidativa, conferita da un elevato numero in mitocondri; le seconde hanno invece grande capacità gli colitica e scarso numero di mitocondri.
Sebbene prevalente nelle fibre IIA e particolarmente in quelle IIB, la glicolisi anaerobica è operante anche nelle fibre I dove diventa importante in due particolari condizioni:
- nel periodo iniziale dell’esercizio
- quando la richiesta di ATP supera la sua produzione aerobica
Le fibre muscolari bianche, capaci di contrazioni rapide e vigorose, ma di breve durata, sono energizzate dall’ATP di origine glicolitica, essendo estremamente ridotto il loro contenuto in mitocondri. La notevole portata glicolitica è garantita da un’elevatissima attività di tutti gli enzimi glicolitici, esclusa la esochinasi. Esse attingono infatti al glicogeno endogeno, di cui sono ricche, più che al glucosio esogeno.
Le fibre rosse ricavano invece l’ATP dalla fosforilazione ossidativa mitocondriale sostenuta dai processi ossidativi: ossidazione del piruvato, β-ossidazione degli acidi grassi e ciclo di Krebs.
Di norma prevalgono le fibre bianche negli strati superficiali e le rosse in quelli profondi.
L’allenamento anaerobico trasforma le fibre rosse in fibre bianche, mentre l’allenamento aerobico induca la trasformazione opposta!
L’energia fosfato nel muscolo scheletrico
Il substrato energetico immediato della contrazione muscolare è l’ATP.
Il sistema creatina-fosfocreatina
Durante i primi secondi di esercizio muscolare, specie quello aerobico, i processi di fosforilazione a livello della glicolisi e della catena respiratoria non hanno ancora raggiunto una velocità di decorso sufficiente a produrre tutto l’ATP necessario.
D’altra parte la concentrazione di ATP nel muscolo è, in condizioni normali, molto esigua (4-5nm/mg di proteine) e sarebbe in grado di assicurare l’attività contrattile del muscolo per non + di un secondo!
È la fosfocreatina presente nel muscolo in quantità più elevate (20-25nm/mg di proteine) che assicura un ripristino di ATP pressoché immediato nella reazione catalizzata dalla creatina chinasi, enzima Mg²+-dipendente:
ADP + H+ + fosfocreatina ó ATP + creatina
Al diminuire dell’ATP e al corrispondente aumentare dell’ADP, la reazione inizia il suo decorso da sx a dx.
Quando nella fase di recupero, il ritmo di produzione metabolica dell’ATP supera quello della sua utilizzazione nella stessa reazione, decorrente in senso opposto, si forma fosfocreatina.
15 secondi dopo un esercizio muscolare intenso, mentre il contenuto di ATP nel muscolo impegnato è diminuito di poco, il contenuto di fosfocreatina diminuisce di 4-5 volte.
La immediata utilizzazione della fosfocreatina trova la sua spiegazione nella pressoché istantanea attivazione della creatina chinasi al primo formarsi di ADP, come conseguenza dell’attività ATPasica miosinica.
Nel frattempo inizia l’attività della glicolisi che rifornirà l’ATP per l’intera durata dell’esercizio anaerobico.
È molto probabile, se non certo, che l’ATP richiesto da una prestazione fisica rapida e intensa (es. salto in alto) venga ricavato esclusivamente dalla fosfocreatina; non di meno la fosfocreatina è importante anche per le fibre rosse, impegnate nell’esercizio aerobico, in quanto contribuisce a mantenere la concentrazione di ATP abbastanza costante anche in condizioni di improvviso stress e di conseguente subitanea richiesta di energia.
Catabolismo degli adenin-nucleotidi
Nel muscolo scheletrico è molto attiva la adenilato chinasi o miochinasi che catalizza la seguente reazione:
2ADP ó ATP + AMP
Questa reazione, che ha lo scopo di produrre ATP in aggiunta alle fonti usuali, ha anche funzione di regolazione. Infatti la concomitante produzione di AMP, il più efficace effettore positivo della fosfofruttochinasi, mette in moto la glicolisi.
In tal modo la produzione di AMP nel muscolo segnala un’urgente richiesta di energia e stimola la glicolisi a produrla immediatamente.
L’aumento di AMP induce anche un aumento dell’attività della AMP deaminasi, l’enzima che per deaminazione idrolitica trasforma l’AMP in inosina monofosfato (IMP), con liberazione di NH3:
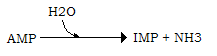
L’IMP può essere riconvertito in AMP, a spese dell’aspartato, che cede il gruppo amminico, in due reazioni catalizzate rispettivamente dalla adenilsuccinato sintetasi (1) e dalla adenilato liasi (2), con formazione di fumarato disponibile per il ciclo di Krebs:

La produzione di NH3 durante la deaminazione dell’AMP è funzionalmente rilevante perché consente di ridurre la concentrazione di protoni conseguente a produzione di lattato!
Ulteriore produzione di NH3 si ha in un’analoga reazione a carico della adenosina, catalizzata dalla adenosina deaminasi:
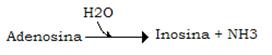
Va infine ricordata l’esistenza nel sarcolemma della 5-nucleotidasi che de fosforila idroliticamente l’AMP in adenosina:

L’adenosina, che così si forma, rilasciata dalle cell negli spazi intracell, si lega a recettori che si trovano sulla superficie esterna delle cell muscolari lisce delle arteriole, provocando vasodilatazione; si ha di conseguenza un aumento del flusso ematico e quindi un maggior apporto di ossigeno e di substrati ossidabili.
L’esercizio anaerobico
A partire dal 3° o 4° secondo dopo l’inizio di un esercizio fisico intenso, la rifosforilazione dell’ADP in ATP, sempre meno sostenuta dalla fosfocreatina, viene sostenuta prevalentemente dalla glicolisi anaerobica che utilizza il glicogeno muscolare e produce lattato.
La max produzione di lattato si verifica prima che il muscolo assuma glucosio dal sangue; ciò implica che, immediatamente dopo la fosfocreatina, è ancora un substrato endogeno, ovvero il glicogeno muscolare, che sostiene l’energia contrattile.
La degradazione richiede ovviamente che la glicogeno fosforilasi venga attivata: ciò è garantito da una parte dalla presenza di adrenalina in circolo nelle condizioni in cui si innesta l’esercizio anaerobico (stress) e dall’altra parte, dall’aumentata concentrazione dell’AMP che attiva la fosforilasi non fosforilata.
Con il prolungarsi dell’esercizio, l’utilizzazione del glucosio ematico diventa sempre più consistente, ed in parallelo si verifica anche una crescente utilizzazione dell’ossigeno che consente una concomitante utilizzazione degli acidi grassi.
La resa energetica della glicolisi anaerobica (glucosio à lattato) è di 17 volte inferiore a quella della glicolisi aerobica (glucosio à CO2); se tuttavia la glicolisi anaerobica è molto meno produttiva, in quanto a resa, di quella aerobica, è dotata di una ben più elevata “capacità” o “portata”. È suscettibile cioè, a differenza del processo aerobico, di un’accelerazione subitanea e molto grande, che consente in pochissimi secondo un aumento di flusso da 1 a 1000.
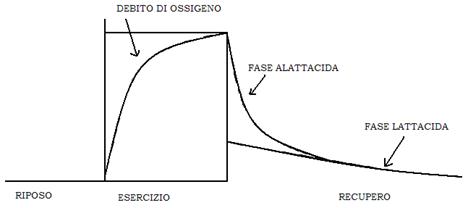
Un esercizio anaerobico implica un DEBITO DI OSSIGENO che viene pagato, ad esercizio concluso, da un extraconsumo di ossigeno, superiore a quello consumato durante l’esercizio fisico.
Questo ossigeno consumato serve per recuperare 4 funzioni:
- resintesi di ATP
- rimozione di acido lattico
- re-saturazione della mioglobina
- resintesi di glicogeno
Il recupero si suddivide in 2 fasi:
- fase alatticida o componente rapida del recupero del debito: re-sintesi ATP e PC (minuti)
- fase latticida: rimozione acido lattico dal circolo e re-sintesi di glicogeno (ore-giorni)
Una parte del lattato prodotto dal muscolo, da parte delle fibre bianche, viene ossidato dal muscolo stesso e precisamente dalle fibre rosse. La rimanente parte viene rilasciata nel sangue e utilizzata dal fegato e dal miocardio. Tuttavia tanto più il muscolo è allenato, tanto meno lattato rilascia al sangue, in quanto è in grado di utilizzarne una maggior quota.
La sensazione di fatica che sopravviene in tempi piuttosto brevi nell’esercizio anaerobico, è da attribuire alla deplezione di fosfocreatina e alla diminuzione del pH derivante, a sua volta, dall’accumulo temporaneo di lattato.
Durante un esercizio intenso il pH del muscolo, che a riposo è 7, può scendere a valori di 6,4-6,3 e quello del sangue da 7,4 a 6,9-6,8.
La diminuzione del pH può rallentare l’interazione actina-miosina e diminuire l’attività ATPasi della miosina; può inoltre diminuire l’attività della fosfofruttochinasi e di altri enzimi dalle glicolisi e quindi ridurre il flusso glicolitico produttore di ATP.
L’esercizio aerobico
L’esercizio fisico intenso e prolungato è sostenuto, a differenza di quello massimale e rapido, dall’energia derivante dall’ossidazione dei glucidi e degli acidi grassi.
Impegnate in questo tipo di esercizio sono le fibre rosse.
Glucosio e glicogeno
Il glucosio utilizzato nell’esercizio prolungato proviene in maggior parte dal sangue, riversatovi dal fegato.
È quindi il glicogeno epatico il principale serbatoio dei glucidi utilizzati dal muscolo scheletrico negli esercizi di lunga durata, non solo come fonte di energia, ma anche per assicurare la concomitante ossidazione completa degli acidi grassi (infatti buona parte dell’energia necessaria viene fornita dalla concomitante ossidazione degli acidi grassi).
Man mano che le scorte glucidiche si assottigliano si accentua, specie nel fegato, la gluconeogenesi.
Più glicogeno muscolare è stato consumato, tanto più lungo è il periodo della sua ricostituzione.
Acidi grassi
I substrati quantitativamente + importanti sono gli acidi grassi a lunga catena. Gli ampi depositi di trigliceridi dell’organismo possono essere considerati un enorme pool di acidi grassi in attesa di utilizzazione da parte del muscolo.
Anche i corpi chetonici, costituiscono per il muscolo scheletrico una significativa fonte di energia.
L’allenamento all’esercizio aerobico induce un aumento percentuale delle fibre rosse ed in esse un aumento del numero di mitocondri. La capacità ossidativa del muscolo ne risulta di molto aumentata e ciò si traduce in un risparmio di glicogeno.
Azione dell’insulina sul muscolo
L’insulina stimola la sintesi proteica ed il passaggio di aminoacidi e glucosio nel muscolo.
Attraverso l'attivazione della glicogeno sintetasi l'insulina stimola la produzione di glicogeno.
In carenza di insulina (nel digiuno) il consumo di glucosio nel muscolo è minimo, mentre aumenta l'immissione di aminoacidi in circolo.
Infatti si riduce la possibilità di utilizzare il glucosio per la sintesi del glicogeno, quindi c'è un impoverimento delle riserve di glicogeno all'interno del muscolo.
Non c'è la possibilità che gli aminoacidi vengano utilizzati perché non penetrano nella cellula muscolare anzi le proteine che sono presenti nel muscolo vengono catabolizzate e trasformate in aminoacidi che escono dal muscolo e vengono usati dal fegato per produrre glucosio.
Quello che succede nel tessuto adiposo in seguito alla carenza di insulina (diabete o digiuno), cioè la liberazione di acidi grassi liberi (FFA), influisce sul tessuto muscolare che utilizza questi FFA a fini energetici quando manca il glucosio.
Ciclo di Cori
Il ciclo di Cori è un ciclo metabolico che, tramite la circolazione sanguigna, lega fegato e muscolo
Quando la richiesta di ATP è superiore al flusso ossidativo, come nei casi di sforzo muscolare, le fibre muscolari ricorrono alla produzione di lattato; questo viene trasportato al di fuori della cellula muscolare per essere immesso nel circolo sanguigno e quindi essere inviato al fegato. Nel fegato il lattato viene riossidato dalla lattato deidrogenasi a piruvato, che, a sua volta, viene convertito, mediante gluconeogenesi, in glucosio.
Il glucosio, prodotto dal fegato, sempre tramite sistema circolatorio torna al muscolo, dove può essere sottoposto ad un ulteriore processo glicolitico oppure può essere conservato nelle riserve di glicogeno.
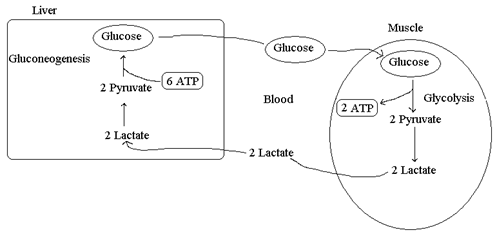
Durante l'esercizio muscolare, oltre al lattato, il muscolo immette in circolo alanina con un ritmo a volte centinaia di volte più elevato che in condizioni di riposo. L'alanina costituisce un mezzo per trasportare l'azoto aminico al fegato in forma non tossica.
I vantaggi sono:
- rigenerazione del NAD+ che fa continuare la glicolisi;
- produzione di ATP in loco, cioè nella cellula muscolare che può essere catalizzata più rapidamente;
- autonomia della fibra muscolare nei confronti della concentrazione di ossigeno nel sangue;
- elevata energia contenuta nei legami C-H del lattato. Per questo, invece di essere espulso dai reni, viene riciclato come glucosio.
Lo svantaggio è dato dal fatto che lo ione lattato è un catabolita tossico per la cellula perché la sua produzione porta all'acidosi lattica nei muscoli. Ciò può diminuire l'efficienza dei sistemi tampone nel sangue e affaticamento fisico poiché l'aumento dell'acidità nei tessuti provoca crampi muscolari.
La risposta immediata è l'iperventilazione che fa diminuire l'acidità dell'organismo provocando però un “debito di ossigeno”. Questo viene soddisfatto quando tutto il lattato viene riconvertito in glucosio tramite la glicogenesi epatica (sintesi del glucosio a partire da molecole che non sono carboidrati); il lattato perciò segue un andamento ciclico noto come ciclo di Cori!
Perché troviamo la mioglobina nel muscolo?
- In condizioni di riposo la saturazione dei siti per l’O2 è completa (per l’emoglobina invece no).
- Piccoli cambiamenti di pO2 e di pH (e nei muscoli ce ne sono continuamente) hanno piccoli effetti sulla percentuale di saturazione.
- Durante un esercizio fisico vigoroso il cuore pompa il sangue velocemente e il ritmo respiratorio aumenta per aumentare l’apporto di O2. Inoltre il pH è abbassato per il metabolismo incrementato (aumenta la produzione di CO2).
- Se il trasporto non soddisfa il fabbisogno è necessario un accumulatore di O2: questo è la mioglobina.
- La mioglobina limita il debito di ossigeno.
Tessuto muscolare cardiaco
Caratteristiche morfologiche
I cardiomiociti, sebbene simili alle fibrocell muscolari scheletriche rosse, se ne differenziano per la minor massa fibrillare e per il maggior numero di mitocondri, che occupano il 35% del volume cellulare e assumono una disposizione regolare a reticolo.
Il t.miocardico dipende energeticamente dal processo della fosforilazione ossidativa mitocondriale e ne spiega la pressoché totale aerobiosi.
Il sarcolemma dei cardiomiociti possiede un glicocalice (glicoproteine e glicolipidi) molto + abbondante di quello dello scheletrico!
I tubuli a T del sarcolemma sono + larghi, mentre le cisterne terminali del reticolo sarcoplasmatico cardiaco sono + limitate e non a diretto contatto dei tubuli a T.
Inoltre le cell cardiache sono unite tra loro da strie o dischi intercalari ricchi di nessi contenenti canali per ioni (Ca²+, H+) e piccole molecole, e desmosomi, aree di contatto tra due cardiomiociti adiacenti, contenenti i filamenti di actina, che facilitano la sincronizzazione dell’attività contrattile!
Il miocardio possiede una vascolarizzazione + diffusa di quello scheletrico e una + abbondante quantità di mioglobina per consentire la maggiore disponibilità di O2 e garantire un adeguato e continuo approvvigionamento energetico.
Struttura delle proteine miofibrillari miocardiche
Nei miocardiociti i filamenti miosinici contengono solo due catene leggere, entrambe fosforilabili, una per ciascuna testa miosinica.
Un’altra differenza concerne la Tn-I che, oltre ad essere + pesante rispetto a quella del muscolo scheletrico, può essere assoggettata a fosforilazione con aumento della velocità di dissociazione del complesso Tn-C/Ca²+ e quindi facilitazione del rilasciamento muscolare durante la diastole.
La fosforilazione della Tn-I è catalizzata dalla proteina chinasi A a seguito della stimolazione del recettore β-adrenergico oppure con il coinvolgimento di altri siti, ad opera della proteina chinasi C sotto stimolazione del recettore α1-adrenergico.
Una differenza riguarda anche la Tn-C il cui dominio globulare a bassa affinità possiede soltanto un sito legante il Ca²+ anziché due.
Meccanismo della contrazione nel miocardio
Segue il meccanismo generale descritto per il muscolo scheletrico con differenze concernenti
- l’innesco del processo contrattile
- la regolazione catecolaminica della contrazione
- l’omeostasi del calcio nella cell miocardica
Innesco del processo contrattile
L’impulso alla contrazione non è fornito dallo stimolo nervoso volontario, come nel muscolo scheletrico, ma da un segnale ritmico, emesso da particolari cardiomiociti pressoché indifferenziati che posseggono la proprietà di generare autonomamente e trasmettere lo stimolo cioè l’onda di depolarizzazione della membrana: si tratta delle cell nodali presenti nel nodo seno-atriale e atrio-ventricolare.
L’onda investe il sarcolemma dei cardiomiociti e provoca l’apertura dei canali del Ca²+ sarcolemmatici VOCC con ingresso nel citosol di quantità discrete di Ca²+ proveniente dall’ambiente extracell.
I VOCC miocardici, a differenza di quelli scheletrici, non contengono la subunità γ e non possiedono l’architettura molecolare che espone un sensore del voltaggio. Essi non vengono in collisione diretta con i canali del reticolo sarcoplasmatico sensibili alla rianodina (RyR).
Questi canali sono invece sensibili alle relativamente basse concentrazioni di Ca²+ (proveniente dall’esterno della cell) e, aprendosi, determinano un massiccio rilascio di Ca²+ dal reticolo endoplasmatico fino a raggiungere concentrazioni citosoliche intorno a 10¯ M.
Si tratta del rilascio del Ca²+ reticolare indotto dal Ca²+ di origine extracell!
Nella fase diastolica il Ca²+ viene rimosso dal citoplasma per effetto innanzitutto della pompa del Ca²+ del reticolo sarcoplasmatico (~70%) nonché dello scambiatore Na+/Ca²+ (25%) della membrana sarcoplasmatica, ed infine della Ca²+-ATPasi della stessa membrana cell e del “carrier” del Ca²+, mitocondriale.
Regolazione catecolaminica della contrazione miocardica
Il miocardio è innervato dal sistema nervoso autonomo simpatico attraverso terminazioni adrenergiche e dal sistema nervoso parasimpatico attraverso terminazioni colinergiche.
I recettori adrenergici sono del tipo β1 e α1, i recettori colinergici del tipo muscarinico.
Gli stimoli nervosi si sovrappongono a quelli dei nodi seno-atriali e atrio-ventricolari esercitando così azione modulatoria sull’attività contrattile.
La stimolazione dei recettori β1 porta all’attivazione dell’adenilato ciclasi con produzione di cAMP, il quale, tramite la proteina chinasi A, attiva per fosforilazione:
- i canali (lenti) del Ca²+ collocati sulla membrana sarcoplasmatica
- la pompa del Ca²+ del reticolo sarcoplasmatico
- il fosfolambano
Il fosfolambano è una proteina di membrana di basso P.M. presente in elevata concentrazione nel reticolo sarcoplasmatico; ha una coda altamente idrofobica e forma degli aggregati di 5 monomeri.
Quando non è fosforilato si unisce alla SERCA ATPasi inibendola.
Inoltre è substrato sia della CaM-PK che della PKA e, quando è fosforilato, si stacca dalla SERCA-ATPasi realizzandosi di fatto un’attivazione della Ca-ATPasi stessa.
Il fosfolambano presenta 2 residui fosforilabili al suo N-terminale.
Esso inibisce reversibilmente la pompa Ca²+- ATPasi posta sul reticolo sarcoplasmatico e rappresenta un regolatore di importanza fondamentale nella fase di rilasciamento del miocardio.
Ne risulta innanzitutto una maggiore sensibilità al Ca²+ dei canali (lenti) posti sul sarcolemma con conseguente maggiore influsso di Ca²+ extracell e potenziamento del loro effetto sulla liberazione del Ca²+ a partire dal reticolo sarcoplasmatico (effetto inotropo positivo – maggiore potenza di contrazione).
Inoltre viene facilitato il riassorbimento del Ca²+ da parte del reticolo e quindi accelerata la fase di rilassamento del muscolo (effetto lusitropo positivo). Infatti la presenza di recettori β1-adrenergici sulle cell dei nodi è responsabile di un doppio effetto:
- uno derivante dal più rapido accumulo del Ca²+ nel citosol e dalla sua più rapida riassunzione nel reticolo
- l’altro legato all’attivazione dei canali dei K+ posti sul sarcolemma
Ne consegue un aumento:
- della frequenza di contrazione (cronotropismo)
- della velocità di conduzione del potenziale d’azione (dromotropismo)
- della eccitabilità del sarcolemma (batmotropismo)
La stimolazione dei recettori α1-adrenergici innesca il sistema di trasduzione imperniato sulla attivazione della fosfolipasi C con formazione di diacilglicerolo e inositolotrifosfato.
Quest’ultimo induce ulteriore liberazione di Ca²+ dal reticolo sarcoplasmatico mentre il diacilglicerolo attiva la proteina chinasi C, la quale fosforilando lo scambiatore Na+/H+ della membrana sarcoplasmatica promuove l’espulsione di H+ dalla cell.
La conseguente alcalinizzazione del citoplasma aumenta l’affinità dei miofilamenti per il Ca²+ e rende più pronta la contrazione.
L’effetto finale è inotropico positivo senza tachicardia.
L’entrata in funzione dei recettori muscarinici, per stimolazione da parte dell’acetilcolina, porta all’inibizione dell’adenilatociclasi, dovuta al coinvolgimento di proteine G con subunità α di tipo inibitorio. Si blocca quindi la formazione di cAMP con marcato effetto di tipo cronotropo negativo (bradicardia) e modesto effetto inotropo negativo.
Va pure ricordato che effetti non trascurabili sull’attività funzionale del miocardio derivano anche da:
- vasodilatazione (stimolazione β1-adrenergica)
- vasocostrizione (stimolazione α1-adrenergica)
del distretto vasale coronarico, con conseguente modificazione dell’apporto di O2 e di nutrienti energetici.
Omeostasi del Ca²+ nella cell miocardica
La regolazione della concentrazione citoplasmatica di Ca²+ è fondata sull’azione dei sistemi adibiti alla estrazione del Ca²+ dal sarcoplasma e dei sistemi addetti alla immissione del Ca²+ nel sarcoplasma.
Sistemi adibiti alla estrazione del Ca²+ dal sarcoplasma: le “pompe” del calcio
Tale estrazione è operata dal sinergismo di diverse pompe del Ca²+:
- la Ca²+-ATPasi della membrana sarcoplasmatica
- la Ca²+-ATPasi del reticolo endoplasmatico
- lo scambiatore Na+/Ca²+ del sarcolemma
- il sistema di trasporto del Ca²+ entro i mitocondri
La Ca²+-ATPasi reticolare è responsabile della maggior parte dell’estrazione di Ca²+ dal citosol, mentre quella sarcolemmatica è + efficace nella estrazione dei Ca²+ in condizioni di risposo, quando cioè la concentrazione dei Ca²+ nel sarcoplasma è bassa.
Lo scambiatore Na+/ Ca²+ del sarcolemma
È un sistema elettrogenico in quanto trasporta nel liquido extracell 1 Ca²+ (contro gradiente) in scambio con 3 Na+ che vengono simultaneamente trasportati nel sarcoplasma (in favore di gradiente).
Sia i Ca²+ che i Na+ hanno infatti concentrazione + elevata fuori dalla cell; è il gradiente favorevole dei Na+ che consente l’estrusione contro gradiente dei Ca²+.
L’energia per lo scambio deriva dall’ATP.
A differenza della pompa ATPasica del sarcolemma, lo scambiatore Na+/Ca²+ possiede una relativamente scarsa affinità per i Ca²+, ma un’elevata capacità di pompaggio, soprattutto per il maggior numero di unità presenti nella membrana.
Lo scambiatore ha quindi parte preminente nel pompaggio dei Ca²+ durante la fase sistolica, quando la concentrazione dei Ca²+ raggiunge nel sarcoplasma i livelli + elevati.
Sistema di trasporto dei Ca²+ nei mitocondri
I mitocondri del cuore sono capaci di accumulare Ca²+ dall’ambiente esterno à uniporto, in quanto i Ca²+ vengono trasportati unidirezionalmente all’interno dei mitocondri con meccanismo elettroforetico mediante un carrier, specificatamente inibito dal rosso di rutenio.
Infatti la respirazione mitocondriale, promuovendo un’espulsione di protoni, crea un potenziale transmembrana negativo all’interno; è questo potenziale che attrae nello spazio matrice i Ca²+ esterni secondo una stechiometria di 1 Ca²+ per sito fosforilativo.
I Ca²+ accumulati possono essere rilasciati per scambio elettroneutro con i Na+. 2 Na+ entrano nello spazio matrice per ogni Ca²+ che viene rilasciato.
A loro volta i Na+ accumulati nei mitocondri vengono rilasciati in scambio con altrettanti protoni.
Sistemi adibiti alla immissione dei Ca²+ nel sarcoplasma: i canali del calcio
A questa funzione sono adibiti la membrana sarcoplasmatica, il reticolo sarcoplasmatico e i mitocondri, sedi di canali o carrier del Ca²+.
Questi canali del calcio sono parte del sistema di canali (canali ionici) attraverso i quali i vari ioni vengono trasportati selettivamente attraverso la membrana, in particolare il sarcolemma e le membrane del reticolo sarcoplasmatico.
I canali ionici presentano un rapporto di selettività per un determinato ione dell’ordine di 100:1 (ciò significa che i canali del Ca²+ possono essere percorsi anche da altri ioni ma con una probabilità di 100:1 a favore del Ca²+).
Tale selettività viene conferita da appositi “filtri” di cui i canali sono dotati.
Caratteristica comune del trasporto ionico attraverso i canali è la passività, in quanto gli ioni attraversano i canali sempre in favore di gradiente.
Il flusso dei Ca²+ attraverso i propri canali è unidirezionale: dall’esterno all’interno della cell o dall’interno del reticolo al citosol.
Questo flusso non è tuttavia costante, ma regolato dall’apertura e chiusura di “cancelli” di cui i canali sono dotati donde la denominazione di “gate pores” (pori con cancello).
I canali si possono trovare in 3 stati:
- aperti
- a riposo
- inattivi
La differenza tra stato di riposo e inattività consiste fondamentalmente nella possibilità o meno di passare allo stato aperto in risposta allo stimolo fisiologico.
La transizione stato di riposo à stato aperto inizia quando, in seguito all’impulso di contrazione, la membrana si depolarizza. Subito dopo i canali passano allo stato inattivo, nel quale diventano refrattari a rispondere allo stimolo di contrazione.
Per tornare allo stato non refrattario di riposo è necessario che il potenziale di membrana ritorni allo stato di ripolarizzazione.
Nel cuore questa condizione è ripristinata dalla fuoriuscita dei K+ dalla cellula, ad opera della pompa Na+/K+.
La superficie interna del canale è rivestita da residui idrofilici polari, le cui cariche elettriche variano con il voltaggio di membrana, determinando l’apertura o la chiusura dei cancelli.
Ogni canale è dotato di due cancelli:
- uno esterno, detto di attivazione, in quanto la sua apertura dà inizio al passaggio dei Ca²+
- l’altro interno, detto di inattivazione, in quanto la sua chiusura dà inizio allo stato di inattivazione del canale.
I canali del calcio posizionati nel sarcolemma sono la sede principale di azione dei farmaci antiaritmici e + specificatamente dei farmaci indicati come “calcio antagonisti” che trovano impiego nel trattamento dell’infarto miocardico e dell’ipertensione.
Tali farmaci bloccano i canali del calcio o occludendone il lume oppure modificandone la conformazione per interazione con i fosfolipidi di membrana che si trovano a + immediato contatto con i canali stessi.
Una ulteriore via di accesso dei Ca²+ alla cell è costituita da canali aspecifici che mettono in comunicazione tra loro le cell cardiache dei distretti sinciziali del miocardio.
Questi canali sono sempre aperti e consentono una costante intercomunicazione di elettroliti tra le cell facilitando quindi la sinergia funzionale del sincizio.
Tuttavia quando la concentrazione dei Ca²+ in una cell, o in un gruppo di cell, si eleva al di sopra dei limiti fisiologici, i canali si chiudono, precludendo un innalzamento patologico dei Ca²+ nelle cell contigue!!
L’energia fosfato nel miocardio
L’attività contrattile del cuore è continua ed è sostenuta al metabolismo aerobico.
Anche nel miocardio la contrazione della fibrocell è sostenuta dall’energia di idrolisi dell’ATP in ADP + Pi e il più immediato rifornimento di ATP è da parte del creatinfosfato, la cui concentrazione è molto superiore a quella dell’ATP (25µmoli/g contro 5µmoli/g di tessuto fresco).
Nel momento in cui l’ATP varca la membrana mitocondriale interna, diventa substrato della creatina chinasi per formare fosfocreatina e ADP.
L’ADP viene immediatamente trasportato nel mitocondrio dalla adenilato traslocasi e la fosfocreatina diffonde nel citoplasma attraverso la membrana mitocondriale esterna e perviene alle miofibrille.
Qui diventa substrato della creatina chinasi miofibrillare e nella reazione a direzione opposta forma ATP e creatina, che ritorna nello spazio intermembrana a disposizione della creatina chinasi mitocondriale.
Un problema rilevante è l’apporto di creatina al miocardio che, pur essendo uno dei tessuti + strettamente dipendenti da creatina, non è in grado, proprio come il muscolo scheletrico, di sintetizzarla.
La deve quindi assumere dal sangue nel quale viene riversata dal fegato e dal pancreas, i 2 organi in grado di sintetizzarla.
Anche nel miocardio sono attive l’adenilato chinasi o miochinasi e l’adenilato deaminasi.
Substrati utilizzati dal miocardio
Il miocardio utilizza:
- acidi grassi
- glucosio
- lattato
- corpi chetonici
- piruvato
- acetato
ricavandoli dal sangue; può tuttavia attingere anche ai depositi endogeni, fondamentalmente glicogeno e trigliceridi.
Glucosio
L’utilizzazione del glucosio da parte del miocardio è relativamente scarsa, mai superando il 30% dell’utilizzazione dei substrati ossidabili.
Ciò riflette il relativamente lento flusso della glicolisi per via dell’attività della fosfofruttochinasi, mantenuta a basso livello dalla elevata concentrazione citoplasmatica di ATP, prodotto con resa elevata nel processo di fosforilazione ossidativa mitocondriale.
Inoltre nel miocardio il piruvato viene ossidato a CO2 nel processo di decarbossilazione ossidativa e non ridotto a lattato; ciò è dovuto alla efficienza della piruvato deidrogenasi e dei sistemi navetta che trasportano gli equivalenti riducenti prodotto nella glicolisi a reagire con l’ossigeno all’interno dei mitocondri.
Acido lattico
Il miocardio preferisce il lattato al glucosio.
Infatti quando il contenuto di lattato nel sangue si innalza al di sopra di un certo valore, si ha una significativa diminuzione del consumo di glucosio da parte del muscolo cardiaco: azione di risparmio del glucosio.
Pertanto il miocardio utilizza in prevalenza acidi grassi e glucosio in condizioni di riposo ma anche acido lattico in condizioni di esercizio muscolare.
Acidi grassi
Gli acidi grassi a lunga catena sono i substrati preferiti dal miocardio, di cui coprono il 70% circa della spesa energetica.
I trigliceridi depositati nel t.adiposo costituiscono un enorme serbatoio di acidi grassi in attesa di utilizzazione (che verranno veicolati dall’albumina).
Penetrati nella fibrocell miocardica gli acidi grassi si legano ad una specifica proteina citoplasmatica (FABP) che ne regola la distribuzione ai vari “pools” cell.
Questa proteina esplica anche un’azione protettiva, in quanto allo stato libero gli acidi grassi e loro metaboliti possono esercitare un’azione deleteria sul tessuto sia per la loro aspecifica azione detergente, sia per l’azione specificamente lesiva sulla permeabilità delle membrane intracell.
La carnitina nel miocardio
L’intenso uso di acidi grassi a scopo energetico prevede un efficiente trasporto degli acili dal comparto citosolico a quello mitocondriale.
Questo trasporto è carnitina dipendente.
Il miocardio umano ha un contenuto di carnitina 2 volte superiore a quello epatico e 30 volte superiore a quello ematico.
Nel sarcolemma miocardico è collocato un traslocatore capace di trasportare la carnitina nelle cell cardiache in scambio con la deossicarnitina (il precursore immediato della carnitina che il miocardio è in grado di sintetizzare).
Una molecola di carnitina viene trasportata nella fibrocell miocardica, solo se simultaneamente una molecola di deossicarnitina ne esce.
Nel fegato, l’organo che sintetizza la carnitina, detto scambio avviene in direzione opposta: il fegato cioè estrae dal sangue deossicarnitina per riversarvi carnitina.
Aminoacidi
Hanno la funzione di sostenere la sintesi proteica, necessaria per compensare la continua degradazione delle proteine.
In aggiunta a questa funzione, gli aminoacidi a catena ramificata ed in particolare la leucina, vengono impiegati dal miocardio, come anche dal muscolo scheletrico, come substrato ossidabile specialmente nelle condizioni di iperlavoro.
Tessuto muscolare liscio
Organizzazione strutturale
Le miocellule lisce non possiedono strutture a bande né birifrangenza.
Mancano pure del sistema tubulare trasverso della membrana plasmatica e del sistema canalicolare del reticolo endoplasmatico.
Più filamenti intermedi decorrono al centro della cell, lungo l’asse longitudinale, coinvolgendo il nucleo. Su questi filamenti sono collocate strutture fibrose, chiamate corpi densi citoplasmatici, tenacemente ancorati ai filamenti stessi.
Analoghi corpi densi sono pure collocati sulla faccia interna della membrana plasmatica (corpi densi sarcolemmatici).
Le miofibrille si agganciano da una parte ai corpi densi sarcolemmatici e, dall’altra, ai corpi densi citoplasmatici disponendosi quindi trasversalmente all’asse longitudinale delle cell con i filamenti di actina agganciati da una parte e quelli di miosina dall’altra.
Mancano le troponine. Le teste di miosina possiedono soltanto 2 catene leggere, fosforilabili.
Le proteine regolatorie caratteristiche del muscolo liscio sono la calponina e il caldesmone.
La prima si lega all’actina e alla tropomiosina e inibisce la ATP-asi miosinica; l’inibizione è rimossa dalla Ca²+-calmodulina e dalla fosforilazione della stessa calponina operata dalla proteina chinasi C e dalla proteina chinasi Ca²+-dipendente.
Il caldesmone è una molecola allungata che si dispone lungo il solco della actina-F, sovrapponendosi a 14 monomeri di actina e affiancandosi alla tropomiosina. Anch’esso esercita un’azione inibitoria nei confronti dell’ATP-miosinica, inibizione pure rimovibile da parte della Ca²+-calmodulina.
Contrazione del muscolo liscio
È innescata da uno stimolo nervoso o ormonale.
Essendo assenti placche motrici, lo stimolo nervoso è mediato da un neurotrasmettitore che è rilasciato direttamente dall’assone nella zona di contatto con il muscolo.
La muscolatura liscia viscerale ha invece la capacità di evocare potenziali di azione spontanei da parte di miociti “pacemaker”: l’onda di depolarizzazione è trasmessa da una cell all’altra.
Nel caso di stimoli nervosi o di spontanea generazione si ha apertura dei canali sarcolemmatici del Ca²+ voltaggio dipendenti.
Nel caso di stimoli ormonali, a seconda del recettore implicato, si può avere apertura dei canali del Ca²+ sarcolemmatici oppure di quelli del reticolo sarcoplasmatico, attraverso l’innesco del sistema trasduzionale recettore/proteina-G/fosfolipasi C/inositolotrifosfato (IP3) e diacilglicerolo (DAG).
Questo sistema è utilizzato dai recettori α1-adrenergici e da quelli della serotonina, angiotensina II ed endotelina 1.
Mentre l’IP3 promuove direttamente l’apertura dei canali del Ca²+ del reticolo, il DAG attiva la PKC che, provocando la fosforilazione di proteine dell’apparato contrattile, le sensibilizza al Ca²+ e ne facilita la permanenza nello stato contratto: il suo ruolo quindi non è di innescare la contrazione ma di protrarre lo stato di contrazione.
Allo stato di riposo l’interazione tra actina e teste della miosina è resa impossibile dall’azione coprente della calponina e del caldesmone.
Con l’avvento di Ca²+ si forma Ca²+-calmodulina che si combina con la miosina-chinasi, presente nel citosol, e la attiva.
L’enzima attivo fosforila la catena leggera della testa miosinica e il caldesmone.
L’attacco di Pi e ADP alla testa miosinica, dovuti all’azione dell’ATP-asi, provoca le modificazioni meccanico-chimiche della miosina, la quale arpiona l’actina facendo scorrere i filamenti di actina e miosina uno sull’altro.
Questo accorciamento provoca a sua volta l’accorciamento della cell muscolare liscia che assuma una conformazione + tondeggiante.
Esauritosi lo stimolo:
- il Ca²+ viene rapidamente rimosso dal citosol per effetto della pompa del Ca²+ ATP-dipendente e dello scambiatore Na+/Ca²+
- le fosfatasi citosoliche de fosforilano le catene leggere della miosina e del caldesmone
- la miosina chinasi, da cui si stacca la calmodulina privata del Ca²+, ritorna allo stato di inattività
L’ATP si ancora alla miosina respingendo la actina-F, interrompendosi così l’effetto attivatorio di quest’ultima sulla ATPasi miosinica.
Il muscolo liscio assume l’assetto rilasciato.
Effetti regolatori sul tono della muscolatura liscia
Adrenalina e noradrenalina (attraverso i recettori α1- e α2-adrenergici), come pure serotonina, angiotensina II ed endotelina 1, stimolano la contrazione, provocando innalzamento della concentrazione citoplasmatica di Ca²+ e la fosforilazione delle catene leggere della miosina e del caldesmone.
La stessa adrenalina (attraverso i recettori β-adrenergici) e la prostaglandina PGI2 hanno effetto contrario, vasodilatatore.
Analogo effetto miorilassante è esercitato da quelle sostanze (fattore natriuretico atriale, NO, bradichinina) che determinano produzione di cGMP e quindi attivazione delle proteine chinasi C.
Fonte: http://www.medwiki.it/sites/default/files/Biochimica%20del%20muscolo.doc
Sito web da visitare: http://www.medwiki.it/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Biochimica del muscolo tipo file : doc
Visita la nostra pagina principale
Biochimica del muscolo
Termini d' uso e privacy