Biochimica del sistema nervoso
Biochimica del sistema nervoso
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Biochimica del sistema nervoso
Nell’uomo adulto il tessuto costituente il sistema nervoso rappresenta il 2,5-3% del peso corporeo e il rapporto in pesi fra sistema nervoso centrale e periferico è di circa 10 a 1.
Il tessuto costituente il sistema nervoso è quello che, per unità di peso, ha:
- il maggior fabbisogno energetico e quindi il maggior consumo di O2 e la maggior richiesta di glucosio, in quanto utilizza pressoché solo questo come combustibile
- il più elevato turnover proteico
- il maggior sviluppo di membrane, e quindi il più elevato contenuto di lipidi complessi
I componenti cell del sistema nervoso: neuroni e glia
I componenti cell principali del sistema nervoso sono:
- le cell nervose, eccitabili
- le cell gliali o glia, non eccitabili
Le cell nervose hanno la peculiare capacità di generare e trasmettere l’impulso nervoso e sono presenti nel SNC e SNP in molti differenti tipi:
- neuroni sensoriali, addetti a recepire segnali
- interneuroni, che elaborano e integrano i segnali
- neuroni motori, che ricevono segnali dai neuroni sensoriali o dagli interneuroni e li trasmettono come stimoli alle cell muscolari o altre cell recettive
Le cell gliari hanno una funzione di protezione e controllo metabolico e si distinguono in:
- macrogliarià astrociti, oligodendrociti (tra cui le cell di Schwann)
- microgliari
Una volta sviluppati e differenziati morfologicamente e funzionalmente, i neuroni cessano di duplicarsi! Il loro nucleo sintetizza infatti RNA ma non DNA; solo se il soma rimane intatto l’assone danneggiato o reciso può essere riformato.
I neuroni sono costituiti da:
- soma, che contiene gli organuli e provvede alla biosintesi delle proteine e degli altri componenti cell macromolecolari, alla produzione di energia, alla elaborazione dei neurotrasmettitori o di loro precursori e infine alla predisposizione di tutte le molecole e microstrutture che vengono trasportate nel flusso assonale anterogrado
- dendriti, che sono folte ed estese ramificazioni
- assone, generalmente rivestito per tutta la sua lunghezza dalla guaina mielinica che ha proprietà isolanti e consente un più rapido movimento di ioni lungo l’assone stesso.
L’assone contiene una serie di microfilamenti e microtubuli regolarmente giustapposti, lungo i quali possono scorrere in direzione distale organelli subcell, proteine, fosfolipidi e altre sostante prodotte nel soma e destinate ad essere usate perifericamente, specie a livello delle presinapsi.
È questo il flusso o trasporto assonale anterogrado di tipo rapido (50-500 mm al giorno) o lento (1-3 mm al giorno).
È possibile anche un flusso assonale di molecole, di solito cataboliti, ma anche sostanze assunte dallo spazio intersinaptico retrogrado (150-200 mm al giorno) che dalle terminazioni nervose porta al soma.
Le cell della glia circondano i neuroni, rispetto ai quali sono nel rapporto di 10 a 1; ai neuroni offrono supporto (e isolamento) meccanico e assistenza metabolica.
Le cell di Schwann costituiscono la guaina mielinica.
Gli astrociti, provvisti di un’abbondante arborizzazione di prolungamenti filamentosi, circondano i neuroni e stabiliscono diretti contatti con i capillari attraverso i prolungamenti che, espandendosi in pedicelli vascolari, tappezzano come un involucro la superficie esterna dell’endotelio vasale; il contatto con gli astrociti funge da stimolo per le cell endoteliali.
L’insieme delle cell endoteliali dei capillari e dell’involucro gliare costituisce la barriera ematoencefalica che agisce da filtro selettivo fra il sangue e le cell neuronali.
La glia produce inoltre composti necessari allo sviluppo, alla sopravvivenza e al recupero funzionale dopo lesione dei neuroni e interviene criticamente nella regolazione della composizione del liquido extracell nel quale i neuroni sono immersi.
Le cell microgliari, con un’arborizzazione periferica meno sviluppata rispetto agli astrociti, hanno prevalentemente funzione protettiva; in presenza di stimoli di natura infiammatoria o di insulti locali (traumi, ischemia..) si attivano, proliferano, sviluppano una rete di prolungamenti, migrano verso le zone lese ed esercitano un’efficace azione di fagocitosi.
A differenza dei neuroni tutte le cell gliari conservano la capacità di proliferare!!
Nel SNC (soprattutto cervello e cervelletto) i corpi neuronali e la gran parte delle cell gliari sono accentrati nella sostanza grigia, mentre le fibre assoniche nella sostanza bianca.
L’encefalo è anche caratterizzato dalla presenza di un sistema cavernoso (i ventricoli) connesso con la barriera ematoencefalica, contenente il liquido
cefalorachidiano (o liquor) che fa da intermediario tra il sangue e il liquido dell’interstizio tessutale.
I componenti chimici fondamentali del sistema nervoso
Caratteristiche morfologico-funzionali proprie del SN:
- L’enorme sviluppo dei prolungamenti dendritici e assonali dei neuroni e delle arborizzazioni delle cell gliari da cui l’ingente ampiezza delle membrane plasmatiche rispetto alla massa citoplasmatica e quindi l’abbondanza dei lipidi di membrana.
- Il metabolismo aminoacilico e proteico incentrato sulla eccitabilità e la stramissione dello stimolo nervoso.
Inoltre si deve tener conto del notevolissimo contenuto di acqua nella sostanza grigia (è il comparto tissutale più ricco di acqua dell’organismo, secondo solo al sangue) e quello molto elevato dei lipidi nella sostanza bianca (solo il t.adiposo ha un contenuto percentuale di lipidi superiore, per quanto nella sostanza bianca si tratti di lipidi strutturali mentre nel t.adiposo di trigliceridi).
Inoltre vi è una grande abbondanza di alcuni aminoacidi liberi nel cervello, quali acido glutammico, glutamina, acido aspartico, serina, treonina, glicina e la presenza esclusiva nel cervello, in notevole quantità, di acido N-acetilaspartico.
Trasmissione dell’impulso nervoso
Potenziale di riposo e potenziale d’azione
In condizioni di riposo sulle 2 facce della membrana neuronale si ha un potenziale di -70mV (stato di polarizzazione); questa differenza di potenziale (potenziale di riposo) che polarizza l’assone con cariche negative all’interno e positive all’esterno è il risultato della permeabilità selettiva della membrana agli ioni (analoga a quella di tutte le membrane cell):
- Na+ più concentrati all’esterno
- K+ più concentrati all’interno
- Cl ¯ più concentrato all’esterno
Quando il neurone viene eccitato, si origina un potenziale d’azione che si propaga distalmente lungo l’assone come un’onda, alla velocità anche di oltre 100 m al secondo e senza diminuire di intensità durante la propagazione.
Ciò avviene perché il potenziale elettrochimico di membrana si modifica da -70 a +50mV per ritornare a -80mV e quindi aggiustarsi lentamente al valore di riposo.
Questo processo di depolarizzazione e ripolarizzazione avviene per una profonda modificazione della permeabilità della membrana rispetto ai Na+ ed ai K+. Durante la fase di depolarizzazione la permeabilità ai Na+ aumenta più rapidamente ed intensamente di quella relativa ai K+, sicché entrano nell’assone più Na+ di quanti K+ ne escano; ne consegue una temporanea inversione della polarità della membrana (positiva all’interno, negativa all’esterno).
Non appena la permeabilità relativa ai Na+ è ritornata a valori basali, quella relativa ai K+ è ancora più elevata della norma, donde la iperpolarizzazione.
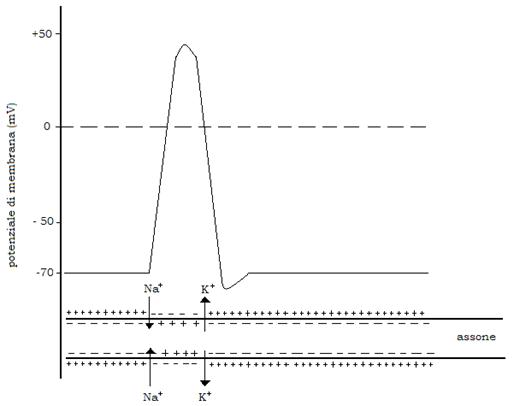
Il passaggio degli ioni Na+ e K+ attraverso la membrana assonale avviene lungo canali formati da proteine intrinseche.
La pervietà di questi canali è dipendente dal potenziale d’azione che si propaga lungo l’assone.
Il canale per gli Na+ proprio del cervello di mammifero è un eterodimero formato da una subunità α, una subunità β1 e una subunità β2, tutte transmembrana e protrudenti sulla superficie della membrana con esposizione di segmenti altamente glicosilati.
La subunità α è legata alla β2 attraverso un ponte disolfuro e possiede nella sua porzione citoplasmatica alcuni siti suscettibili di fosforilazione.
Nella subunità α sono presenti 4 domini polipeptidici ravvicinati tra di loro e contenenti ciascuno 6 segmenti α-elicizzati transmembrana contigui:
- i secondi segmenti α-elicizzati dei 4 domini costituirebbero la parete del canale dei Na+
- i quarti segmenti dei 4 domini i sensori del potenziale di membrana
Altri siti sempre della subunità α sono sensibili all’azione della tetrodotossina e della saxitossina, tossine tra le più velenose conosciute che bloccano il passaggio degli ioni Na+ attraverso il canale.
I canali per i Na+ sono uniformemente distribuiti sulla membrana assonale negli assoni non mielinizzati mentre sono raccolti a “cluster” (cioè a gruppo, grappolo) ed eccezionalmente abbondanti nei nodi di Ranvier delle fibre mielinizzate.
Le caratteristiche strutturali del canale per i K+ - voltaggio sensibili sono meno chiare di quelle del Na+. Esso è costituito da 2 subunità, una α e una β e può essere attivato per fosforilazione, a livello della sub α, per opera di proteine chinasi tra cui quella cAMP dipendente.
La sub α del canale per i K+ è simile ma più semplice di quella del canale per i Na+: contiene infatti un unico dominio polipeptidico transmembrana costituito da 4 segmenti α-elicizzati contigui.
I canali per i Na+ possono essere bloccati nella forma sia aperta che chiusa: la tetrodotossina blocca nella prima forma, la batracotossina nelle seconda.
Sono noti anche bloccanti dei canali per i K+, quali la 4-amino-piridina e il tetra-metil-ammonio.
Il ripristino del gradiente ionico normale e quindi del potenziale di riposo è assicurato dalla pompa “Na+, K+” che, a spese dell’energia rilasciata dal legame fosforico dell’ATP, espelle contro gradiente Na+ e fa entrare K+; questa pompa, che è inibita dalla ouabaina, trasporta fuori 3 Na+ e simultaneamente fa entrare 2 K+ per ogni mole di ATP idrolizzato in ADP.
Per un breve periodo di tempo successivo alla ripolarizzazione l’assone non è suscettibile di depolarizzazione (periodo refrattario); ciò limita la frequenza degli impulsi nervosi.
La sinapsi e i neurotrasmettitori
La trasmissione sinaptica può essere di 2 tipi:
- elettrica, nella quale, essenzialmente interneuronale e presente in alcune strutture della corteccia cerebrale e dell’ippocampo, la membrana avvolgente l’estremità distale del neurone afferente è pressoché a contatto con quella del neurone efferente: si tratta di un processo rigido e non modulabile;
- chimica, a struttura più complessa: di forma ovoidale, comprende la terminazione assonica (presinapsi) nel neurone a monte ed una porzione dendritica o somale (postsinapsi) del neurone a valle; in mezzo si trova la fessura sinaptica (20 nm circa) a livello della quale vengono liberati i neurotrasmettitori.
I neurotrasmettitori sono sintetizzati completamente o in parte nel RE del soma e vengono trasferiti lungo i microtubuli assonali nella presinapsi dove vengono assunti e depositati in vescicole fino al momento della loro utilizzazione.
Il completamento della sintesi del neurotrasmettitore può, in taluni casi, avvenire entro le vescicole sinaptiche.
L’assunzione del neurotrasmettitore entro la vescicola è un processo attivo, mediato da un trasportatore che interna lizza il neurotrasm. con espulsione di protoni.
La vescicola sinaptica “matura” nella terminazione nervosa a partire da una pre-vescicola, confezionata nel soma neuronale e trasferita in periferia per flusso assonale anterogrado.
Il rilascio dei neurotrasm. dalle presinapsi avviene nella fessura sinaptica per secrezione da parte delle vescicole che li contengono, attraverso un processo di esocitosi, previa fusione delle vescicole con la membrana sinaptica.
Il nesso meccanicistico tra stimolo nervoso e rilascio dei neurotrasm. è rappresentato da un brusco aumento della concentrazione di Ca²+ indotto dalla depolarizzazione; sulla membrana presinaptica infatti sono presenti canali per i Ca²+ sensibili al voltaggio che, quando investiti dal potenziale d’azione, si aprono, consentendo il rapido flusso di Ca²+ dall’esterno all’interno della presinapsi.
I Ca²+ da una parte si legano alla superficie delle vescicole sinaptiche e, dall’altra, combinandosi con la calmodulina, attiva la proteina chinasi II, che fosforila una sinapsinaI, ecto-proteina della membrana vescicolare.
La combinazione dei due eventi fa sì che le vescicole si stacchino dall’ancoraggio all’actina del citoscheletro, si avvicinino e quindi si fondino con la membrana sinaptica, svuotando il contenuto di neurotrasm. nella fessura intersinaptica.
Il processo è “quantale” perché la minima quantità di neurotrasm. che viene rilasciato è quella contenuta in una singola vescicola sinaptica.
La fusione della vescicola sinaptica con la membrana presinaptica, innescata dall’innalzamento della concentrazione di Ca²+ nella presinapsi, è una forma di esocitosi ed è centrata sull’ancoraggio delle superficie della vescicola alla faccia citosolica della membrana presinaptica in siti specifici.
L’ancoraggio consiste nella formazione di un complesso SNARE, costituito da
- componenti della membrana vescicolare à V-vesicular-SNARE comprendente la sinaptobrevina, la sinaptotagmina e la proteina Rab3, una GTP-asi
- componenti della membrana presinaptica à t-target-SNARE comprendente la sintassina e lo SNAP-25
Il complesso si forma se la proteina citosolubile n-Sec1 (che blocca la sintassina) non interagisce con il t-SNARE.
L’allontanamento della n-Sec1 dal t-SNARE è cmq effettuata dalla Rab3 con concomitante trasformazione del GTP in GDP.
Formatosi il complesso 2 proteine citosolubili vi si legano:
- l’NSF, una ATP-asi
- la α-SNAP
L’NSF diventata così attiva, idrolizza l’ATP e il complesso SNARE si dissocia: le due membrane si fondono con conseguente efflusso del neurotrasm.
-immagine-
Attraverso la fessura sinaptica il neurotrasm. raggiunge la postsinapsi dove si combina transitoriamente con una specifica proteina di membrana detta neuro recettore; tale legame induce modificazioni conformazionali della membrana postsinaptica che comportano l’apertura transitoria dei canali ionici per i Na+ con conseguente depolarizzazione della membrana e generazione dell’impulso nervoso.
Esistono 2 tipi di neurorecettori:
- ionotropici
- metabolotropici
I neurorecettori ionotropici sono essi stessi canali ionici, ad es dei Na+, che si aprono a contatto con il neurotrasm.
I neurorecettori metabolotropici, in presenza del rispettivo neurotrasm. si attivano e danno inizio ad una cascata di reazioni, coinvolgenti proteine G che porta alla produzione di un messaggero secondario, quale cAMP, cGMP, inositolo 1,4,5-trifosfat, Ca²+, diacilglicerolo..ect..
Il secondo messaggero attiva una proteina chinasi che promuove la fosforilazione di proteine, tra le quali i canali ionici che si aprono. Tra le proteine fosforilate sono incluse anche quelle capaci di modulare l’espressione genica.
Lo stesso neurotrasm. può utilizzare più di un tipo di neurorecettore!
Dopo aver stimolato il neurone postsinaptico, il neurotrasm. viene rapidamente rimosso dalla fessura sinaptica o per distruzione o per riassorbimento nella presinapsi o per diffusione e definitiva rimozione da parte del flusso ematico (tutti questi eventi avvengono in un tempo molto breve, compatibile con la rapidità dell’impulso nervoso).
I neurotrasm. si distinguono in:
- eccitatori
- inibitori
I neurotrasm. eccitatori hanno come effetto finale una depolarizzazione della membrana sinaptica con formazione del potenziale d’azione e quindi trasmissione dell’impulso nervoso. L’apertura del canale dei Na+ è la base molecolare del loro effetto.
I neurotrasm. inibitori causano iperpolarizzazione della membrana sinaptica e quindi impedimento alla formazione del potenziale d’azione e conseguente blocco della neurotrasmissione. L’apertura del canale dei Cl¯ è la base della loro azione.
È stata accertata la possibilità di co-trasmissione, e cioè del contemporaneo rilascio di più di un neurotrasm., di solito da parte di vescicole sinaptiche differenti. Nella co-trasmissione di norma un mediatore chimico funge da vero neurotrasm. e l’altro o gli altri (spesso di natura peptidica) agiscono da neuro-modulatori.
I principali neurotrasmettitori
Oggi sono noti più 50 neurotrasmettitori; i più comuni sono l’acetilcolina e la noradrenalina.
Le fibre nervose che usano come neurotrasm. la acetilcolina sono dette colinergiche, quelle che usano la noradrenalina, adrenergiche.
Tutte le fibre nervose che innervano i muscoli volontari (neuroni motori) sono colinergiche; quelle del sistema nervoso autonomo (involontario) sono in parte colinergiche ed in parte adrenergiche.
Acetilcolina
Viene sintetizzata da colina e acetil-CoA ad opera della colina acetil trasferasi presente anche nella presinapsi colinergica, a livello citosolubile:
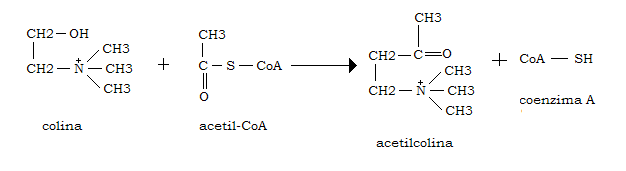
La colina si forma dalla fosfatidilcolina per azione idrolitica promossa da una fosfolipasi D, o da una fosfolipasi C, con produzione di fosfocolina seguita da una fosfatasi che scinde la fosfocolina in colina.
L’acetil-CoA è ottenuto dal piruvato per decarbossilazione ossidativa o dal citrato per opera della citrato liasi.
L’acetil-colina neo formata è trasportata all’interno della vescicola sinaptica per azione della proteina trasportatrice dell’acetilcolina, collocata nella membrana vescicolare, con concomitante espulsione di protoni dalla vescicola.
Questo sistema di antiporto è sostenuto da una pompa protonica (ATP-asi di tipo V) che immette protoni nella vescicola e determina un gradiente di concentrazione protonico.
Dopo essere stata rilasciata nella fessura sinaptica, l’acetilcolina si lega ai recettori colinergici che sono di due tipi:
- nicotinico (in quanto bloccato dalla nicotina) ionotropico
- muscarinico (stimolato dalla muscarina) metabolotropico
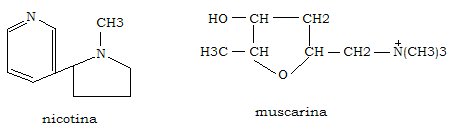
Il recettore nicotinico à è una glicoproteina transmembrana formata da 2 subunità α, una β, una γ ed una δ con struttura complessiva di forma cilindrica. Ciascuna subunità contiene 5 segmenti probabilmente a struttura ad α-elica che passano attraverso la membrana. Le sub α contengono ciascuna un sito di legame per l’acetilcolina, il ligando che induce l’apertura del canale dei Na+, espressione funzionale del recettore. I quarti segmenti α-elicizzati delle cinque sub costituenti il recettore, ricchi di cariche, costituiscono insieme, la parete del canale dei Na+.
Il recettore muscarinico à è una glicoproteina appartenente alla famiglia dei recettori a sette segmenti transmembrana. A seguito dell’interazione con l’acetilcolina il recettore, attraverso la mediazione di proteine G, provoca inibizione dell’adenilato ciclasi, attivazione della fosfolipasi C e aperture dei canali dei K+, ottenendosi, tra gli effetti, la depolarizzazione della membrana postsinaptica.
La idrolisi dell’acetilcolina in colina ed acetato è catalizzata dalla acetilcolina esterasi o semplicemente colinesterasi, ectoenzima presente sulle membrana sinaptiche e prospiciente nella fessura sinaptica.
La colina rientra nella presinapsi in un processo elettroforetico Na+ dipendente, mentre l’acetato viene perduto per diffusione.
La colina riassorbita viene utilizzata per la sintesi di nuova acetilcolina. L’acetilcolina esterasi è fortemente inibita dal diisopropilfluorofosfato che viene impiegato negli insetticidi o nei gas nervini.
Somministrata per via endovenosa l’acetilcolina esplica una peculiare azione farmacologica che implica il rallentamento del ritmo cardiaco, costrizione bronchiale e dilatazione delle arteriole. Una deficienza di acetilcolina a livello delle terminazioni nervose che innervano i muscoli volontari è stata riscontrata nella miastenia gravis.
Catecolamine
I neurotrasmettitori di natura catecolaminica sono la noradrenalina, l’adrenalina e la dopamina, fra di loro metabolicamente correlate.
Noradrenalina e adrenalina
La noradrenalina agisce come neurotrasm. a livello del sistema nervoso simpatico e in alcune zone del SNC.
Nella presinapsi è depositata in vescicole, racchiudenti anche la dopamina-β-idrossilasi, l’enzima che catalizza la idrossilazione della dopamina in noradrenalina.
Nelle stesse vescicole è anche contenuto ATP e particolari proteine dette cromogranine.
L’ingresso delle catecolamine dentro le vescicole sinaptiche è affidato ad un trasportatore (antiporto) che scambia le amine con protoni; questi vengono pompati nelle vescicole da una ATP-asi H+ dipendente. L’antiporto catecolamine/protoni è inibito dalla reserpina.
La noradrenalina rilasciata per esocitosi dalle vescicole che la contengono, si lega ai recettori adrenergici di tipo β (recettori metabolotropici); questo legame induce stimolazione della adenilato ciclasi e scatena gli eventi a cascata indotti dal cAMP, includenti l’apertura di un canale di Na+, sensibile ai ligandi.
Ad azione espletata la noradrenalina viene ripompata nella presinapsi in un processo elettroforetico Na+-dipendente.
A differenza dell’acetilcolina, la noradrenalina non viene inattivata ma solo riciclata!!!
L’adrenalina interagisce con recettori adrenergici di tipo α e β; la sua azione viene interrotta attraverso un processo di inattivazione metabolica.
Dopamina o idrossitiramina
È il precursore della noradrenalina ma essa stessa agisce come trasmettitore nei neuroni che fanno capo al sistema reticolato del corpo striato, una regione dell’encefalo adibita al controllo centrale dei movimenti.
La dopamina interagisce con recettori adrenergici del tipo D, analoghi strutturalmente e funzionalmente a quelli di tipo β; pertanto la dopamina, come la noradrenalina, agisce stimolando la adenilato ciclasi e provocando formazione di cAMP.
La trasmissione dopaminica è fortemente inibita nella malattia di Parkinson per un difetto di sintesi della dopamina.
Sostanze agoniste della dopamina sono la mescalina e l’anfetamina.
Antagonisti della dopamina, di cui impediscono il legame con il recettore, sono invece le clorpromazine impiegate nella cura di schizofrenie.
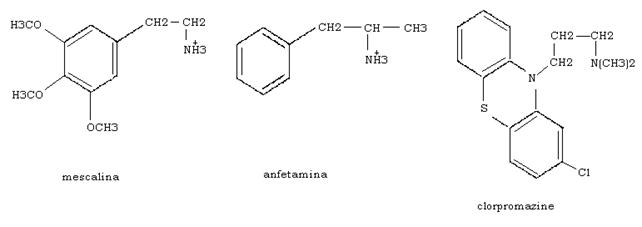
I tranquillanti agiscono inibendo l’attivazione dopaminica della adenilato ciclasi.
Tutti i recettori dei neurotrasm. catecolaminici fanno parte della famiglia dei recettori a 7 segmenti idrofobici transmembrana. Ciascun tipo di recettore adrenergico (α,β,D) presenta sottotipi peraltro altamente omologhi fra di loro, ma suscettibili di diverse azioni modulatorie.
La concentrazione dei relativi cataboliti nel liquido cerebrospinale, nel sangue e nelle urine sono di importanza clinica in quando indicano il turnover delle catecolamine originarie.
Serotonina o 5-idrossitriptamina
Metabolita del triptofano, la serotonina è il mediatore chimico dei neuroni ipotalamici adibiti al meccanismo del sonno e della percezione sensoriale.
Suoi antagonisti sono la dietilammide dell’acido lisergico (LSD) e da altri agenti allucinogeni.
Anche la serotonina, come la noradrenalina e la dopamina, viene conservata in vescicole al riparo dalla monoamina ossidasi che, presente nella membrana esterna dei mitocondri, la ossida nella corrispondente aldeide.
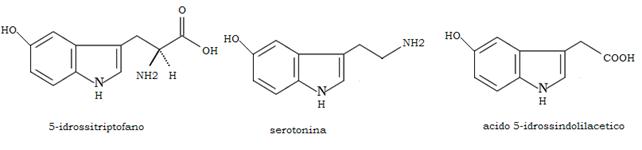
Il triptofano che penetra nella sinapsi dal circolo, viene idrossilato a idrossitriptofano ad opera della triptofano idrossilasi e successivamente decarbossilato a 5-idrossitriptamina (serotonina) da una decarbossilasi non specifica.
Gran parte delle serotonina neoformata penetra nelle apposite vescicole, dalle quali viene rilasciata al sopraggiungere dell’impulso di depolarizzazione.
La serotonina rilasciata reagisce con i recettori postsinaptici, distinguibili in 4 classi: 5-HT1, 5-HT2, 5-HT3, 5-HT4, di cui i 5-HT1 in 4 sottotipi A, B, C e D.
Tutti i recettori sono metabolotropici ed associati al sistema delle proteine G.
Essi fondano la loro azione sull’attivazione o inibizione della adenilato ciclasi o sull’attivazione della fosfolipasi C.
Il segnale termina allorché la serotonina viene allontanata dalla fessura per riassunzione nella presinapsi.
Parte della serotonina viene deaminata ossidativamente dalla monoamina ossidasi ad acido 5-idrossi-indolilacetico, che viene irreversibilmente eliminato dal neurone.
La fluoxetina blocca l’assunzione di serotonina a livello dei recettori presinaptici, aumentandone quindi la disponibilità dei recettori postsinaptici.
Neurotrasmettitori inibitori
GABA (acido γ–aminobutirrico)
È il principale neurotrasm. inibitorio del SNC, pur operando anche nel SNP.
La principale via di formazione del GABA è la decarbossilazione dell’acido glutammico, catalizzata dalla glutammico decarbossilasi, enzima piridossal-5-P-dipendente, presente esclusivamente nel citosol delle presinapsi GABA-ergiche.
Nel SNP il GABA può anche formarsi dall’ornitina (e quindi dall’arginina) attraverso 2 vie:
- nella 1° si ha decarbossilazione a putrescina, seguita da deaminazione ossidativa a GABA-aldeide e ossidazione finale a GABA;
- nella 2° si ha formazione di semialdeide glutammica per transaminazione con l’α-chetoglutarato, ossidazione ad acido glutammico e decarbossilazione a GABA.
Il principale e meglio noto recettore del GABA (recettore GABAa) è un canale del Cl¯ sensibile al ligando; un tetramero di una subunità glicoproteica con una grossa porzione ad esposizione extracell. contenente un ponte disolfuro ed una porzione transmembrana costituita da 4 segmenti α-elicizzati, vicini tra di loro. I secondi segmenti α-elicizzati (ricchi di cariche positive) delle subunità dell’oligomero costituirebbero la parete del canale dei Cl¯.
Il recettore GABAa è influenzato dai barbiturici e dalle benzodiazepine (es.diazepam).
Il GABA, versato nella fessura sinaptica, viene in gran parte ricaptato dalla presinapsi e riciclato. In una più modesta quota esso viene inattivato metabolicamente ad opera della GABA-transaminasi, con intervento di α-chetoglutarato, e formazione di semialdeide succinica, che per azione della succino semialdeide deidrogenasi, viene trasformata in acido succinico.
Queste reazioni sono a sede mitocondriale e possono anche essere effettuate da cell gliari!!
L’acido valproico agisce aumentando la quantità di GABA nelle zone specifiche in cui agisce (soprattutto cervelletto) per inibizione degli enzimi che lo catabolizzano. Così si spiega l’azione antiepilettica di questo farmaco.
Glicina
È il principale neurotrasm. inibitorio del SNP ma opera anche in alcune zone del SNC.
Assunta dal sangue, raggiunge le presinapsi glicinergiche e una volta versata nella fessura sinaptica, interagisce con il proprio recettore, una glicoproteina oligomerica contenente una subunità α, una β ed una chiamata gefirina che è probabilmente responsabile dell’aggancio del recettore ai microtubuli.
Le sub α e β, glicosilate, definiscono il canale per i Cl¯, mediante segmenti polipeptidici α-elicizzati che attraversano ripetutamente lo spessore della membrana.
La sub α, provvista di 3 segmenti α-elicizzati transmembrana, possiede nella porzione protrudente dalla superficie esterna della membrana postsinaptica, il sito su cui agisce la stricnina.
La stricnina si lega competitivamente ai recettori della glicina, impedendone l’aggancio.
Il recettore della glicina funzione come canale per i Cl¯.
La glicina viene rimossa dalla fessura sinaptica per ricaptazione da parte della presinapsi e delle cell gliari ancillari.
Acido glutammico
È un neurotrasm. attivatorio ed è coinvolto in molte funzioni neuronali, che includono l’acquisizione della memoria e l’apprendimento; inoltre gioca un ruolo in alcuni evento neurotossici come nell’ischemia cerebrale.
L’acido glutammico è l’aminoacido più abbondante nel SNC.
Origina in gran parte dal sangue, ma può essere prodotto in situ per deaminazione della glutammina promossa dalla glutamminasi o per transaminazione dell’α-chetoglutarato.
Nello stato di riposo le concentrazioni di acido glutammico sono circa:
- 1mM nello spazio extracell
- 10mM nel citosol della presinapsi glutammergica
- 100mM nelle vescicole sinaptiche della stessa
Questi gradienti di concentrazione sono determinati:
- dalla ATP-asi Na+, K+ dipendente che pompa K+ e acido glutammico entro la presinapsi neuronale o le cell gliari estrudendo Na+
- dal trasportatore sito nella membrana delle vescicole sinaptiche
La rimozione del neurotrasm. dalla fessura avviene per il tramite del co-trasporto con il K+ sopracitato: una anomalia in questo processo o un insufficiente rifornimento di ATP alla pompa, causano una persistenza di elevati livelli di acido glutammico nella fessura sinaptica, stato di ipereccitabilità e neurotossicità da eccesso di Ca²+ intraneuronale.
Esistono diversi tipi di recettori dell’acido glutammico, alcuni ionotropici (prevalenti nel SNC), altri metabolotropici (+ diffusi nel SNP).
Tra i recettori ionotropici i meglio noti sono
- il recettore NMDA
- il recettore KA
- il recettore AMPA
tutti sensibili al ligando.
Il recettore NMDA, quando aperto, consente il passaggio di Na+ e Ca²+ dalla fessura sinaptica alla postsinapsi (e flusso inverso dei K+) con formazione del potenziale d’azione e l’innesco della cascata di fosforilazioni proteiche promosso dalla proteina chinasi Ca²+ dipendenti.
Tale ricettore è costituito da 5 subunità uguali, glicosilate, contenenti ciascuna 4 segmenti α–elicizzati transmembrana (TM1, TM2, TM3 e TM4).
Le 5 subunità definiscono al loro interno il canale del Ca²+/Na+ (entrambi in entrata nella postsinapsi) e del K+ (in uscita) e presentano numerosi siti di regolazione:
- i siti per agonisti e attivatori (acido glutammico, poliamine e glicina)
- i siti per inibitori (Mg²+, Zn²+)
- i siti per antagonisti (fenilciclidina-PCP)
- un sito per la fosforilazione (che attiva il recettore)
- un sito redox, rappresentato da un ponte disolfuro riducibile a sulfidrile
Il recettore KA funziona come canale dei Na+ e dei K+.
Il recettore AMPA opera come canale dei Na+.
I recettori metabolotropici, quando attivati dal ligando, provocano attivazione della fosfolipasi C, con formazione di diacilglicerolo e inositolo-1,4,5-trifosfato, IP3 e conseguente attivazione della proteina chinasi C da un lato ed elevazione del contenuto citosolico dei Ca²+ dall’altro.
Il recettore metabolotropico ha caratteristiche dei recettori a 7 segmenti α-elicizzati transmembrana, collegati ad una proteina G eterotrimetrica, la cui subunità α attiva la PKC, con le conseguenze note.
È importante ricordare che i recettori NMDA e metabolotropico interagiscono tra di loro; infatti a PKC attiva può fosforilare il recettore NMDA, potenziandolo, e sinergizzare sulla liberazione di Ca²+ nella postsinapsi, attraverso l’azione dell’IP3 sui depositi intracell di Ca²+.
Queste interazioni fanno parte del programma di potenziamento a lungo termine (LTP) al centro dei processi dell’apprendimento e della memoria.
Ossido nitrico (NO)
È piuttosto diffuso nel sistema nervoso: si trova infatti in particolari popolazioni neuronali del cervello, nell’ippocampo, nelle innervazioni dell’ipofisi posteriore, nelle fibre autonome della retina, nei neuroni e nelle fibre nervose del plesso mesenterico e in cell gliari cerebrali.
È prodotto a partire dall’arginina, ad opera della NO sintetasi (NOS) che agisce in presenza di ossigeno e de cofattori NADPH(H+) e tetraidropteridina.
La NOS presente nelle cell neuronali (nNOS) è la forma costitutiva, Ca²+ dipendente, che produce NO in modo transitorio; una forma di NOS (iNOS), abbondante nelle cell gliari, è invece inducibile, Ca²+ indipendente e produce maggiori quantità di NO per più lunghi periodi di tempo.
L’NO non è un vero e proprio neurotrasm. in quanto non è sequestrato in vescicole, si inattiva spontaneamente e non possiede specifici recettori di membrana, tanto meno collocati sulla membrana postsinaptica.
Al contrario, data la sua facilità a permeare le membrane, passa da un comparto subcell all’altro, e da una cell all’altra, interagendo con la guanilato ciclasi, attivandola.
Si può così considerare una molecola potentemente bioattiva che, formatasi nella postsinapsi, diffonde in modo anterogrado nella presinapsi e in cell neuronali e gliari vicine modificando il metabolismo ed il rilascio di neurotrasmettitori classici quali il glutammato, l’aspartato e la serotonina.
Particolarmente nell’ippocampo, l’NO avrebbe un ruolo importante nel già citato potenziamento a lungo termine.
Nel potenziamento a lungo termine sono coinvolti i neurotrasm eccitatori quali l’acido glutammico, particolarmente attraverso il suo recettore NMDA e l’acido aspartico.
Il processo ha inizio con la stimolazione della presinapsi glutammergica e la liberazione di acido glutammico che, legandosi al recettore postsinaptico NMDA e/o al recettore metabolotropico, provoca elevazione della concentrazione del Ca²+ nella postsinapsi e generazione del potenziale d’azione.
Nel contempo i Ca²+, legati alla calmodulina, attivano proteine chinasi che, a loro volta, mettono in azione la MAP chinasi; questa, tra l’altro, stimolerebbe la nNOS, residente nella postsinapsi, con produzione di NO.
L’NO diffonde spontaneamente e retrogradamente attraverso le membrane e, raggiunta la presinapsi, vi penetra attivando la guanilato ciclasi.
Il cGMP, da questa prodotto, facilita il rilascio dell’acido glutammico, rafforzando, o rievocando, la trasmissione sinaptica da esso inizialmente innescata.
L’NO diffonde anche nelle cell gliari e neuronali, potendo quindi influenzare, attraverso il cGMP, il metabolismo e il rilascio di altri neurotrasmettitori.
Neuropeptidi
Nel sistema nervoso sono presenti 2 classi di oppioidi di natura peptidica:
- i peptidi oppioidi a catena corta (encefaline)
- i peptidi oppioidi a catena lunga (endorfine)
Alcuni di questi peptidi hanno azione molto potente: la β-endorfina e la dimorfina, ad es., hanno un’azione analgesica centinaia di volte superiore a quella della morfina.
I peptidi oppioidi traggono origine dalla degradazione selettiva di proteine di elevato peso molecolare:
- la preproopiomelanocortina (pre-POMC) da cui proviene la β-endorfina
- la preproencefalina A da cui provengono la met-encefalina e la leu-encefalina
- la preproencefalina β che genera le dimorfine, la neo-endorfina e la leu-morfina.
I peptidi oppioidi evocano la loro azione attraverso l’interazione con recettori verso i quali i singoli oppioidi possono esibire maggiore o minore specificità.
I recettori dei peptidi oppioidi (recettori µ, k, δ e σ) sono del tipo a 7 segmenti α-elicizzati transmembrana correlati a proteine G ed esercitano azione inibitoria sull’adenilato ciclasi e azione stimolatoria sulla PKC.
I recettori k evocano una riduzione dell’influsso di Ca²+.
I recettori µ e δ evocano un aumento della conduttanza degli ioni K+.
Dallo spazio intersinaptico i peptidi oppioidi vengono rimossi, in parte per riassorbimento entro la presinapsi, operato da appositi carrier, in parte per idrolisi (seguita di solito da inattivazione) operata da peptidasi.
L’azione dei peptidi oppioidi è spesso antagonistica a quella di neurotrasm amminoacilici o di derivazione aminoacidica.
Trasduzione degli stimoli sensoriali: meccanismo della visione
La trasduzione sensoriale è il processo attraverso il quale stimoli sensoriali sono tradotti in impulsi nervosi.
L’intensità dello stimolo è determinata dal numero e dalla frequenza dei potenziali d’azione prodotti dalle cell sensoriali.
Il sistema sensoriale meglio noto è quello visivo.
Addetti alla raccolta degli stimoli luminosi sono i fotorecettori (della retina) distinti in coni e bastoncelli, cell allungate costituite da 2 porzioni:
- il segmento esterno, il quale si appoggia all’epitelio pigmentato
- il segmento interno, connesso sinapticamente con i neuroni bipolari e le cell orizzontali
Il segmento esterno dei bastoncelli è riempito da circa 2000 strutture vescicolari appiattite (dischi) impilate tra di loro che derivano da introflessioni della membrana plasmatica.
Le membrane dei dischi sono infarcite di rodopsina, la molecola fotosensibile.
I bastoncelli sono tra i più sensibili congegni molecolari conosciuti: l’assorbimento di un fotone da parte di una singola molecola di rodopsina è sufficiente a generare un impulso nervoso da parte del bastoncello.
La rodopsina è una glicoproteina integrale di membrana contenente 7 segmenti α-elicizzati transmembrana, impaccati tra di loro.
L’estremità N-terminale, esposta sulla parte interna del disco, contiene due siti glicosilati e la estremità C-terminale, che si affaccia nel citosol, contiene parecchi siti (serina e treonina) fosforilabili (siti regolatori).
All’interno dei segmenti α-elicizzati transmembrana risiede il gruppo prostetico fotosensibile della rodopsina, disposto parallelamente al piano della membrana, l’11-cis-retinale, il cui gruppo aldeidico forma una base di Schiff col gruppo amminico della lisina296 posizionata nel settimo segmento α-elicizzato della proteina (opsina).
Colpito dal fotone l’11-cis-retinale si isomerizza a 11-tutto trans-retinale, ciò provoca una serie di rapidissimi cambiamenti conformazionali che portano alla formazione della metarodopsina II, in cui la base di Schiff si scinde e l’11-tutto trans-retinale si dissocia dalla opsina.
Allo stato di riposo i bastoncelli mantengono al loro interno una certa concentrazione di Na+ sostenuta dall’equilibrio fra
- l’azione della ATP-asi Na+, K+ situata prevalentemente nel segmento interno
- l’azione di un canale per i Na+, posto prevalentemente nel segmento esterno.
Anche i K+, pompati all’interno dalla ATPasi, tornano in parte all’esterno attraverso un proprio canale.
La pervietà del canale per i Na+ è dipendente da cGMP: è tenuto aperto dal cGMP e si chiude in sua assenza. È su questa dipendenza che si basa il processo di trasduzione.
Sulla membrana del disco la rodopsina è situata in stretta contiguità con la trasducina, una tipica proteina G, che è vicina ad una fosfodiesterasi attiva sul cGMP.
La trasducina è costituita da 3 subunità: α, β e γ, di cui la α possiede il sito di legame per GDP/GTP ed attività GTP-asica.
Anche la fosfodiesterasi del cGMP è un oligomero, costituito da una subunità α, una β (entrambe con attività catalitica) e due γ che hanno funzione enzimo-inibitoria.
Allo stato di riposo la rodopsina è blandamente associata alla trasducina, nella quale la sub α è legata al GDP e forma un complesso compatto con le sub β e γ.
Anche le sub della fosfodiesterasi sono compattate tra di loro ed il complesso è inattivo.
Con la stimolazione luminosa la rodopsina si trasforma in metarodopsina II che interagisce fortemente con la trasducina (in particolare le sub β e γ) provocando l’immediato distacco della sub α che, isolata, acquisisce maggiore affinità per il GTP che per il GDP e si attacca al GTP.
La sub α-GTP della trasducina è un potente attivatore della fosfodiesterasi: si lega infatti alle subunità γ della fosfodiesterasi, rescindendola dal complesso, con liberazione delle sub α e β che costituiscono la fosfodiesterasi attiva.
Questa idrolizza il cGMP in GMP con conseguente immediato blocco del canale per i Na+, rapida diminuzione dei Na+ all’interno dei bastoncelli e aumento della negatività del potenziale elettrico.
Si stabilisce uno stato di iperpolarizzazione della membrana, con generazione di un potenziale d’azione, che provoca rilascio di neurotrasm (acido glutammico) a livello sinaptico e trasmissione dell’impulso nervoso.
Il processo descritto ha i requisiti dell’amplificazione a cascata: un singolo fotone attiva una molecola di rodopsina, questa attiva centinaia di molecole di trasducina e di fosfodiesterasi, la quale a sua volta idrolizza migliaia di molecole di cGMP per secondo. Il processo è pure intermittente!
L’interruzione del processo trasduttivo è resa più rapida da un secondo meccanismo: la conformazione della metarodopsina II espone non solo il sito di legame con la trasducina ma anche i siti fosforilabili sui quali agisce una rodopsina chinasi specifica.
Alla porzione C-terminale della metarodopsina II fosforilata si aggancia l’arrestina, una proteina che provoca il distacco della stessa metarodopsina II dalla trasducina.
Esauritosi lo stimolo luminoso, l’11-tutto trans-retinale viene sostituito dall’11-cis-retinale, i resti fosforici della opsina vengono idrolizzati e la rodopsina torna alla condizione di riposo.
Fattore di crescita delle cell nervose (NGF)
È una proteina a struttura omodimerica, simile all’insulina e, come questa, cristallizzabile in presenza di ioni Zn.
Esso utilizza, come altri fattori di crescita, un recettore a tirosina chinasi di cui provoca la dimerizzazione con conseguente attivazione e fosforilazione.
Esso viene biosintetizzato nella cell efferente la sinapsi, in particolare a livello della post-sinapsi, e secreto nello spazio intersinaptico; si lega quindi al recettore, collocato nella membrana presinaptica, e può essere internalizzato nella presinapsi mediante un processo simil-endocitotico.
Il recettore, attivato dall’NGF, sia se residente sulla membrana presinaptica, sia se inserito nelle vescicole endocitosiche, può innescare diverse vie trasduzionali con conseguente espressione di specifiche proteine che sono strumentali a sostenere la crescita e il differenziamento delle cell, l’allungamento del neurite e a bloccare l’apoptosi.
Una carenza di NGF, che può verificarsi negli stati di malnutrizione in età infantile, spiega l’inadeguato sviluppo mentale che li caratterizza.
Oltre al NGF sono stati isolati una ventina di fattori di crescita nervosi, costituenti la famiglia delle neurotrofine, che assecondano questi complessi processi di differenziamento.
Metabolismo del tessuto nervoso
Pur costituendo solo il 2,5-3% della massa corporea, il sistema nervoso consuma il 20% circa dell’ossigeno e il 25% del glucosio utilizzati dall’interi organismo in condizioni di riposo.
Il tessuto nervoso centrale consuma una quantità di ossigeno assai costante che rimane indipendente dalla “attività mentale” e che neppure si modifica con il sonno.
Circa il 70% dell’energia prodotta dal t.nervoso è impegnata a sostenere il lavoro delle pompe ioniche.
Glucidi
Il substrato per eccellenza del t.nervoso è il glucosio, che viene pressoché interamente trasformato in CO2.
Il t.nervoso è infatti incapace di utilizzare il glucosio anaerobicamente con formazione di acido lattico.
Il consumo di glucosio del cervello umano è di 100-130 g al giorno.
La preminenza del metabolismo glucidico è testimoniata dalla attività della esochinasi, 20 volte più elevata che negli altri tessuti; essa è saldamente legata ai mitocondri a spiegazione forse del processo ossidativo in cui viene utilizzato il glucosio.
Gli enzimi glicolitici non sono solo presenti nel corpo cell del neurone ma anche nell’assone.
I 9/10 del glucosio usato dal cervello vengono ossidati via glicolisi e ciclo di Krebs, 1/10 circa è utilizzato nella via del fosfogluconato.
Nonostante l’importanza primaria dei glucidi nel metabolismo energetico, i depositi di glucosio e di glicogeno nel SN sono estremamente esigui e garantiscono l’alimentazione del tessuto solo per pochi minuti.
Per tali motivi l’attività cerebrale è dipendente dai livelli di glucosio del sangue, sicché quando la glicemia scende al di sotto di un certo limite si può avere coma.
Il metabolismo glucidico del cervello non è direttamente controllato dall’insulina, incapace di attraversare la barriera ematoencefalica!!
Lipidi e corpi chetonici
Il t.nervoso si adatta facilmente ad utilizzare i corpi chetonici che in una certa misura possono sopperire ad una eventuale deficienza di glucosio.
(ad es. durante il digiuno prolungato quando il sangue si impoverisce di glucosio e si arricchisce di corpi chetonici).
La capacità del t.nervoso di utilizzare i corpi chetonici è particolarmente elevata nella prima età e soprattutto alla nascita, quando il neonato, non più alimentato dal glucosio del sangue materno, utilizza i grassi endogeni.
Il t.nervoso è invece incapace di ossidare gli acidi grassi per mancanza di enzimi della β-ossidazione.
I lipidi costituenti il t.nervoso sono:
- fosfolipidi (specie sfingomieline e fosfatidilinositoli)
- glicolipidi
- colesterolo
- solfo lipidi
Scarsissimi sono invece i trigliceridi.
I lipidi sono presenti primariamente nelle guaine mieliniche e la loro perdita a zone è alla base della sclerosi multipla, una frequente malattia neurologica.
Aminoacidi
Il 75% degli aminoacidi liberi nel t.nervoso è costituito dall’acido glutammico e dall’acido aspartico. Inoltre la concentrazione di questi 2 aminoacidi nel cervello è di 2 ordini di grandezza più elevata che nel plasma!
Ciò deriva dalla circostanza che nel t.cerebrale questi aminoacidi si formano abbondantemente dal glucosio e che il loro trasporto dal plasma è unidirezionalmente mediato da sistemi di trasporto dotati di specificità relativa.
Particolarmente intenso nel t.nervoso centrale è il metabolismo dell’acido glutammico. Nella reazione catalizzata dalla glutammina sintetasi, l’acido glutammico fissa l’ammoniaca che, se in eccesso, risulta gravemente lesiva per le funzione cerebrali:
glutammato + NH3 + ATP à glutammina + ADP + Pi
Il 60% circa del glutammato impiegato in questa reazione è di origine ematica, il restante 40% viene sintetizzato dal glucosio, via glicolisi e ciclo di Krebs ed aminazione riduttiva dell’α-chetoglutarato.
Il glutammato cerebrale è anche il precursore del GABA.
Dopo il glutammato è l’aspartato l’aminoacido che il t.nervoso utilizza preferenzialmente; buona parte dell’acido aspartico viene acetilato a spese dell’acetil-CoA per formare N-acetilaspartato, la cui funzione è tuttora ignota:
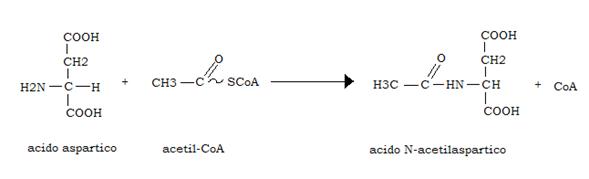
Gli altri aminoacidi vengono assunti dal sangue in misura non proporzionale alla loro concentrazione ematica, in quanto la barriera ematoencefalica costituisce una sorta di filtro differenziale per il loro accesso al cervello.
Barriera ematoencefalica
Non è una barriera strutturale ma funzionale!
Limita l’accesso dei vari composti alle diverse aree cerebrali. Questa selettività di accesso viene attribuita alla membrana basale dell’endotelio dei piccoli vasi e alla glia ad essa contigua.
Può essere considerata un meccanismo di protezione del cervello dalle fluttuazioni di metaboliti che possono aver luogo nel plasma e dalle sostanze tossiche o estranee eventualmente presenti nel sangue.
Alcuni composti però attraversano liberamente la barriera (ossigeno, glucosio, corpi chetonici, alcuni aminoacidi essenziali ed etanolo).
Altri (protoni, glutammato, aspartato, GABA, glicina e la maggior parte degli antibiotici) ne sono respinti.
Tale barriera è molto meno selettiva nel neonato ed è per questo che alcuni composti, che nell’adulto non accedono al t.cerebrale, vi penetrano invece nei primi giorni di vita. È questo il caso della bilirubina che si lega irreversibilmente al t.cerebrale inducendo ritardo mentale e dell’acido fenilpiruvico ancora più deleterio.
Fonte http://www.medwiki.it/sites/default/files/Biochimica%20del%20sistema%20nervoso.doc
Sito web da visitare: http://www.medwiki.it
Autore del testo: non indicato nel documento di origine
Parola chiave google : Biochimica del sistema nervoso tipo file : doc
Visita la nostra pagina principale
Biochimica del sistema nervoso
Termini d' uso e privacy