Biologia appunti parte 3
Biologia appunti parte 3
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Con il termine respirazione solitamente si intende il processo fisiologico macroscopico che consiste nella assunzione di O2 e nel rilascio di CO2 da parte di organismi pluricellulari. In biochimica si usa il termine respirazione in senso microscopico per riferirsi ai processi molecolari che implicano consumo di O2 e formazione di CO2 da parte della cellula. Si tratta di una reazione esoergonica di ossidoriduzione in cui un substrato energetico (tipicamente il glucosio C6H12O6) viene ossidato ad anidride carbonica (CO2) cedendo i suoi elettroni all’ossigeno (O2) che si riduce ad acqua (H2O)
C6H12O6 + 6 O2 → 6 CO2 + 6H2O + Energia
La reazione globale è quindi una ossidazione completa del glucosio come in una normale combustione. Tuttavia solo una parte dell'energia liberata viene trasformata in energia chimica sotto forma di ATP. In totale si ottengono 38 ATP per ogni molecola di glucosio. Si ottengono quindi 38 x 7.3 = 277 Kcal/mol. L’efficienza del processo è di circa il 40%. Infatti la reazione di combustione libera 686 Kcal/mol (277/686 ≈ 0.40)
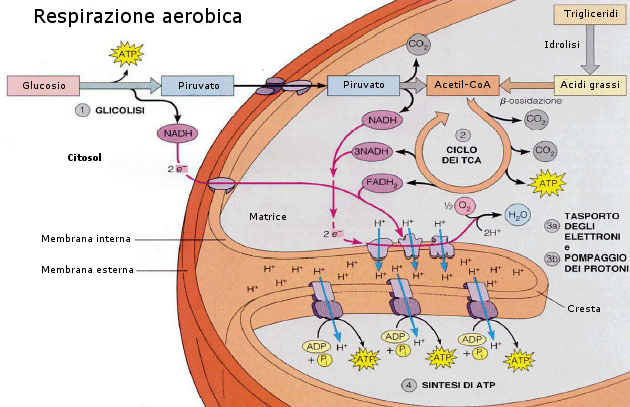
La respirazione cellulare aerobica può essere schematicamente riassunta in tre stadi principali: glicolisi, ciclo di Krebs e fosforilazione ossidativa. Il primo stadio avviene nel citoplasma, gli ultimi due nei mitocondri: Il ciclo di Krebs nella matrice, la fosforilazione ossidativa a livello della membrana interna (creste).
Glicolisi
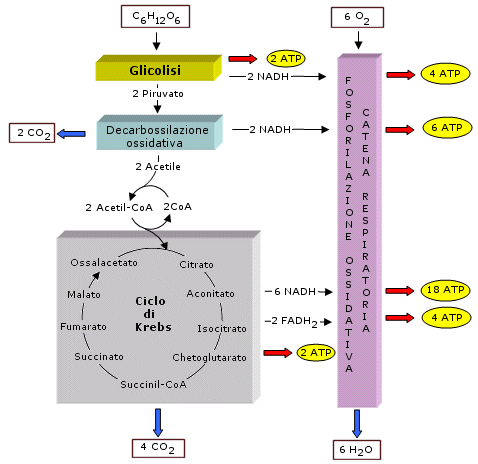
Il temine glicolisi (si pronuncia glicòlisi) deriva da due parole greche che significano “scissione dello zucchero”. La glicolisi è una via metabolica pressoché universale dato che è presente non solo negli animali e nelle piante, ma anche nella maggior parte dei microrganismi. La sua universalità e il fatto di essere anaerobica fanno pensare che sia una via metabolica che si è sviluppata agli inizi della vita sulla Terra in organismi procarioti anaerobi che vivevano quando l'atmosfera era ancora povera di O2. La glicolisi è rimasta poi inalterata durante tutta la storia evolutiva grazie alla sua semplicità ed efficienza. La glicolisi è costituita da una sequenza di 10 reazioni che avvengono nel citoplasma e degradano il glucosio in due molecole di acido piruvico (o piruvato) (CH3-CO-COOH) in assenza di ossigeno producendo 2 ATP e 2 NADH. In realtà la glicolisi carica 4 ATP attraverso un processo noto come fosforilazione a livello del substrato, ma la reazione di glicolisi deve essere inizialmente attivata consumando 2 ATP ed il guadagno netto finale è perciò di 2 ATP.
L’acido piruvico viene successivamente ossidato e decarbossilato (decarbossilazione ossidativa = ossidazione ed eliminazione del gruppo carbossile –COOH sottoforma di una molecola di CO2) con formazione di un gruppo acetile (CH3CO-). L’energia e gli elettroni che si liberano da questo processo vanno a caricare 1 NADH (se teniamo conto che il glucosio si è spezzato in 2 piruvati, la decarbossilazione ossidativa carica 2 NADH).
Il gruppo acetile viene agganciato da un coenzima, noto come coenzima A (CoA), con formazione dell’acetil-CoA. Il compito del CoA è di trasportare il gruppo acetile all’interno del ciclo di Krebs affinché venga completato il processo ossidativo. Si tenga presente che l’acetil-CoA può essere generato anche a partire da altri substrati energetici (tipicamente lipidi).
Ciclo di krebs
Il ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA cycle) o ciclo dell’acido citrico, consiste in una serie di reazioni che avvengono all'interno dei mitocondri, nello spazio della matrice. Queste reazioni sono realizzate attraverso otto tappe enzimatiche e hanno lo scopo di ossidare completamente i due atomi di carbonio del gruppo acetile formando due molecole di CO2. Durante questo processo si libera energia ed elettroni (e ioni H+) che vanno a caricare 3 NADH, 1 FADH2 e 1 ATP. Anche in questo caso l’ATP si forma come conseguenza di un processo di fosforilazione a livello del substrato. Tenendo conto che una molecola di glucosio fornisce al ciclo di Krebs 2 gruppi acetile, il guadagno ottenuto dal ciclo di Krebs per molecola di glucosio sarà di 6 NADH, 2 FADH2 e 2 ATP. Se sommiamo a questo le molecole che si sono caricate in precedenza (2 ATP e 2 NADH per la glicolisi, 2 NADH per la decarbossilazione ossidativa) si ottengono:
10 NADH 2 FADH2 4 ATP
Le ossidoreduttasi (NADH, FADH2) che si sono finora caricate rappresentano degli accettori temporanei di elettroni. Esse devono scaricarsi e cedere elettroni ed energia ad un accettore finale e permanente. Come tutti gli enzimi ed i coenzimi, anche le ossidoreduttasi sono presenti in piccolissime quantità. Se rimanessero bloccate nella loro forma ridotta (alcuni veleni producono questo effetto) le prime due fasi della respirazione cellulare si bloccherebbero completamente, causando la morte dell’organismo.
Fosforilazione ossidativa
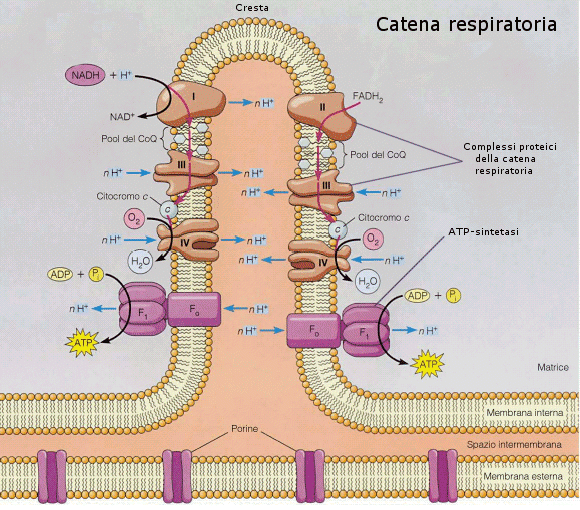
Nel terzo stadio NADH e FADH2 si scaricano, cedendo elettroni (e ioni H+) all’ossigeno che, riducendosi ad acqua, costituisce l’accettore finale e permanente di elettroni. Il trasferimento di elettroni non avviene direttamente, ma attraverso tutta una serie di molecole intermedie (citocromi), attraverso una sorta di catena di trasporto degli elettroni, nota come catena respiratoria. In questo modo l’energia contenuta nelle ossidoreduttasi viene liberata in piccole quantità ad ogni passaggio e può essere utilizzata per caricare ATP.
Ogni NADH che si scarica nella catena respiratoria è in grado di caricare 3 ATP
Ogni FADH2 che si scarica nella catena respiratoria è in grado di caricare 2 ATP
I 10 NADH caricheranno quindi 30 ATP, i 2 FADH2 caricheranno altri 4 ATP, per un totale di 34 ATP che, sommati ai 4 ATP già ottenuti portano il guadagno totale della respirazione aerobica a 38 ATP. In alcune cellule il trasporto all’interno dei mitocondri dei 2 NADH che si erano formati durante la glicolisi richiede un consumo di 2 ATP. In questo caso la resa finale sarà di 36 ATP.
La catena respiratoria è costituita da quattro complessi proteici che contengono gruppi prostetici redox saldamente legati. Gli elettroni vengono trasferiti da un gruppo redox al successivo. Durante il passaggio di elettroni i complessi 1, 3 e 4 sono in grado di generare un flusso di ioni H+ dalla matrice verso lo spazio intermembrana e per questo sono chiamati pompe protoniche.
In questo modo si genera ai due lati della membrana delle creste una differenza di concentrazione in ioni H+ (gradiente elettrochimico). Sotto la spinta di questo gradiente gli ioni H+ rientrano nella matrice utilizzando l’ATP-sintetasi, un enzima transmembranico in grado di convertire il flusso di ioni H+ in energia chimica per la sintesi di ATP (teoria chemiosmotica).
L’intero processo può essere così schematizzato:
Respirazione aerobica - schema
Teoria endosimbiontica
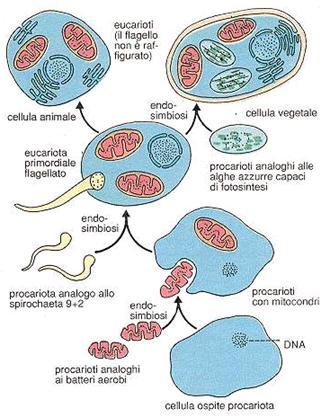
L'evoluzione delle cellule eucarioti ha comportato un notevole salto evolutivo, con il passaggio da cellule procarioti semplici a cellule ben suddivise in parti funzionali, il tutto senza passare per alcuna forma intermedia.
Il rompicapo di questa mancanza di forme è stato spiegato con la teoria dell'endosimbiosi. Sulla base delle forti somiglianze tra i batteri da una parte e i mitocondri e i cloroplasti delle cellule eucarioti dall'altra, sembra probabile che questi organelli si siano originati da procarioti liberi, riparatisi all'interno di cellule eterotrofe più grandi.
I mitocondri si possono ricondurre ad organismi aerobi analoghi ai batteri, mentre i plastidi ad organismi autotrofi simili alle alghe azzurre. Entrambi sarebbero stati assimilati, nel corso dell'evoluzione, in qualità di simbionti da procarioti più grandi. Tali simbionti, perduta la loro autonomia, sono poi divenuti elementi stabili e necessari della cellula eucariote.
Tra le prove a favore di questa teoria ci sono, tra le altre:
- il fatto che i mitocondri ed i plastidi si formino solamente per divisione autonoma da organuli uguali.
- Il fatto che, come i procarioti, contengano DNA anulare.
- Il fatto che la loro membrana esterna sia di tipo eucariotico (membrana di fagocitosi), mentre quella interna di tipo procariotico (membrana originale dell’endosimbionte fagocitato).
Sempre per la stessa teoria, si fanno derivare da batteri analoghi alle spirochete anche le ciglia e i flagelli degli eucarioti con struttura 9+2 (la tipica struttura con 2 microtubuli centrali (singoletto) circondati radialmente da 9 coppie (doppietti) di microtubuli formanti un anello periferico)
Tutti gli eucarioti autotrofi contengono cloroplasti, e tutti gli eucarioti contengono mitocondri: entrambe gli organelli sembra siano stati acquisiti attraverso eventi simbiotici differenti (come si può vedere dall'immagine).
Vie metaboliche anaerobiche
Nella respirazione cellulare aerobica l’accettore finale di elettroni è l’ossigeno. Si definiscono anaerobiche le vie metaboliche di demolizione dei substrati energetici in cui l’accettore finale di elettroni non è l’ossigeno. Si tratta di processi di gran lunga meno efficienti, dal punto di vista energetico della respirazione aerobica, ma sufficienti a garantire la sopravvivenza di molti microrganismi. Ci occuperemo di due esempi importanti di respirazione anaerobica: la fermentazione lattica e la fermentazione alcolica.
Si tratta di due vie metaboliche che utilizzano la glicolisi come tappa iniziale.
Fermentazione lattica
Nella fermentazione lattica i due NADH che si formano dal processo glicolitico si scaricano sul piruvato, riducendolo ad acido lattico (CH3-CHOH-COOH). Alla fine del processo il guadagno energetico si riduce quindi ai 2 ATP che si erano formati durante la glicolisi. La fermentazione lattica è alla base della trasformazione del latte in yogurt grazie all’attività di particolari batteri.
La fermentazione lattica può avvenire anche nei nostri muscoli, quando il lavoro muscolare è particolarmente intenso e l’apporto di ossigeno non è sufficiente a soddisfare le richieste energetiche. In queste condizioni la glicolisi può essere accelerata (non richiede ossigeno), ma l’eccesso di piruvato che si forma e che non può essere assorbito dal ciclo di Krebs, viene convertito in acido lattico. La diminuzione di pH (lattacidosi) che si genera nelle cellule muscolari è responsabile dell’indolenzimento muscolare e può provocare crampi.
Fermentazione alcolica
Anche nella fermentazione alcolica i due NADH che si formano dal processo glicolitico si scaricano sul piruvato. In questo caso il piruvato viene però anche decarbossilato, con liberazione di una molecola di anidride carbonica (CO2) e formazione di etanolo o alcol etilico (CH3-CH2OH). Alla fine del processo il guadagno energetico è sempre di 2 ATP come nella fermentazione lattica. La fermentazione alcolica è alla base della produzione di bevande alcoliche fermentate come il vino, la birra, il sidro il sakè etc ad opera di microrganismi unicellulari fungini, noti come lieviti. La liberazione di CO2 durante questo processo permette di ottenere fermentati gasati (birra, spumante). La fermentazione alcolica viene utilizzata anche nei processi di lievitazione. Durante la lievitazione del pane, ad esempio, i carboidrati contenuti nella farina vengono trasformati in etanolo e anidride carbonica. La CO2 che si libera nell’impasto lo gonfia rendendolo spugnoso, La successiva cottura fa evaporare sia l’etanolo che il gas.
Nucleo
La struttura di maggiori dimensioni all'interno della maggior parte delle cellule vegetali e animali è il nucleo. Il nucleo cellulare contiene il DNA ed ha quindi una funzione essenziale nella trasmissione dei caratteri ereditari (duplicazione DNA) e nel controllo del metabolismo cellulare (trascrizione dei geni e controllo della sintesi proteica). I geni contenuti nel DNA vengono, infatti, copiati all'interno del nucleo in una molecola di acido ribonucleico (trascrizione), chiamata RNA messaggero (mRNA), che passa nel citoplasma e, interagendo con i ribosomi, dirige la formazione di molecole proteiche a partire da singoli amminoacidi veicolati da molecole di RNA di trasporto.
 La forma del nucleo cambia notevolmente, generalmente seguendo la geometria della cellula, dunque cellule cilindriche avranno nuclei oblunghi, mentre cellule cubiche avranno nuclei sferici. L'involucro nucleare è composto da due membrane concentriche, ciascuna di spessore di 8 nm circa, che delimitano il lume della cisterna perinucleare di 15-40 nm.
La forma del nucleo cambia notevolmente, generalmente seguendo la geometria della cellula, dunque cellule cilindriche avranno nuclei oblunghi, mentre cellule cubiche avranno nuclei sferici. L'involucro nucleare è composto da due membrane concentriche, ciascuna di spessore di 8 nm circa, che delimitano il lume della cisterna perinucleare di 15-40 nm.
La membrana nucleare esterna è in continuità con le membrane del reticolo endoplasmatico ruvido e, analogamente, la sua superficie esterna è cosparsa di ribosomi. Lo spazio perinucleare è in continuità con il lume del reticolo endoplasmatico. Le membrane nucleari esterna e interna sono interrotte a livello dei pori dove le due membrane si fondono.
I pori nucleari sono circondati da una struttura ad anello, detta complesso del poro nucleare, formata da otto granuli di origine proteica. Attraverso i pori nucleari avviene il trasporto selettivo di grosse molecole o particelle. Per esempio, tutte le molecole di RNA e i ribosomi della cellula sono sintetizzati nel nucleo e quindi trasferiti nel citosol, mentre tutte le proteine che svolgono le loro funzioni all’interno del nucleo sono sintetizzate nel citosol (unica sede della sintesi proteica) e devono venire introdotte nel nucleo.
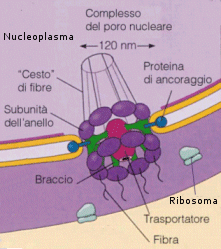
All'interno del nucleo si trova il carioplasma (o nucleoplasma), in cui si distingue una parte fluida, detta cariolinfa (o succo nucleare) ed un materiale basofilo in essa disperso che, proprio per la forte affinità con i coloranti (basici) è stato chiamato cromatina. Nel carioplasma sono inoltre presenti corpi sferoidali fortemente basofili (solitamente più scuri del resto del nucleo) a causa dell’abbondanza di RNA, ma affini anche a molti coloranti acidi (al contrario del resto del nucleo) a causa della presenza di proteine basiche, detti nucleoli. La grandezza di un nucleolo va da 1 a 3 μm. Il numero di nucleoli osservabili in un nucleo è compreso tra uno e sei.
Il nucleolo è una regione deputata alla trascrizione dell’RNA ribosomiale e al successivo assemblaggio delle subunità ribosomiali. Queste, una volta sintetizzate, migrano nel citoplasma e costituiscono la sede della sintesi proteica
Cromatina e cromosomi
La cromatina è costituita da DNA e proteine nucleari classificate come istoniche (istoni) e non-istoniche (non-istoni).
La cromatina può manifestarsi in una forma più o meno condensata, come conseguenza del diverso grado di compattazione del DNA attorno agli istoni.
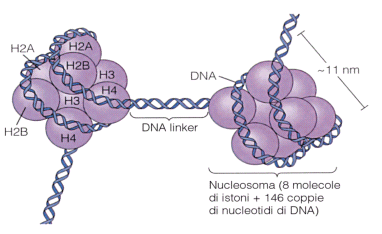
Gli istoni sono proteine relativamente piccole, a forte carica positiva (per la presenza di lisina e arginina). La funzione delle proteine istoniche è quella di organizzare il DNA compattandolo in modo tale da consentire alle cellule di conservarlo in un volume ristretto come quello del nucleo. La famiglia degli istoni comprende le proteine H1, H2A, H2B, H3 e H4.
Nel primo livello di compattazione il DNA si avvolge per un giro e tre quarti attorno ad un ‘rocchetto’ proteico, costituito da 8 istoni (ottamero) a due a due uguali (H2A, H2B, H3 e H4). Questa struttura è nota come nucleosoma. I nucleosomi hanno un diametro di circa 11 nm ed il DNA vi si avvolge intorno per un totale di 146 coppie di nucleotidi. Tra un nucleosoma e l'altro, è presente un filamento di DNA detto linker, che può variare in lunghezza tra poche basi fino a circa 150.
Questo dà alla cromatina l’aspetto di una “collana di perle”, osservabile al microscopio elettronico

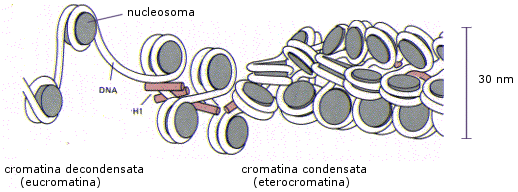
 In questo stato la cromatina viene detta decondensata o despiralizzata ed è nota con il nome di eucromatina. L’eucromatina è trascrizionalmente attiva. In altre parole il DNA in questo stato è accessibile agli enzimi che trascrivono l’informazione genetica e sintetizzano RNA.
In questo stato la cromatina viene detta decondensata o despiralizzata ed è nota con il nome di eucromatina. L’eucromatina è trascrizionalmente attiva. In altre parole il DNA in questo stato è accessibile agli enzimi che trascrivono l’informazione genetica e sintetizzano RNA.
Ogni nucleosoma è associato all’istone H1, il quale sembra abbia la funzione di compattare ulteriormente i nucleosomi.
Nel secondo livello di condensazione i nucleosomi, compattati dall’istone H1, formano una fibra da 30 nm di diametro. I livelli di condensazione superiori all’eucromatina sono invece trascrizionalmente inattivi (il DNA non può essere trascritto) e sono noti con il termine eterocromatina.
Le fibre da 30 nm possono ripiegarsi su se stesse in anse, le quali possono infine raggiungere il grado finale di compattazione condensandosi in cromosomi (corpuscoli di cromatina). Le anse sono stabilizzate da una impalcatura (scaffold) di proteine non-istoniche
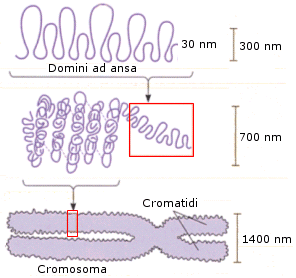
I cromosomi compaiono nel nucleo cellulare solo al momento della divisione cellulare (mitosi e meiosi), quando la cellula-madre si divide in due cellule-figlie. Durante la divisione cellulare infatti la cellula-madre deve fornire alle cellule-figlie una copia del suo DNA e la completa condensazione della cromatina in cromosomi rende ovviamente più agevole l’ordinata ripartizione del materiale genetico.
Il cromosoma presenta una forma bastoncellare costituita da due filamenti identici di DNA, detti cromatidi fratelli, uniti insieme a livello di una strozzatura detta centromero che dà loro una forma ad X. A ciascun centromero è associata una placca proteica, detta cinetocore, che serve come punto di attacco per le fibre del fuso mitotico.

Le estremità di un cromosoma sono dette telomeri.
Il telomero è una struttura “specializzata” presente alle due estremità di ogni cromosoma. Le funzioni fondamentali del telomero sono quelle di mantenere l’integrità delle estremità cromosomiche e di opporsi ad una eccessiva proliferazione cellulare.
Il telomero impedisce infatti la deleteria fusione tra cromosomi, che avviene ad esempio facilmente per unione di due estremità cromosomiche spezzate.
Inoltre il telomero svolge, in condizioni normali, l’importante funzione di marcatempo, cioè conteggia ( e impone) il numero di volte in cui una cellula può riprodursi. Da studi su colture di cellule umane è stato possibile stabilire che le replicazioni cessano dopo 50-70 divisioni cellulari.
Il telomero situato, come già detto, alle due estremità del cromosoma, strutturalmente è un insieme di brevi sequenze identiche (sequenze ripetitive) di basi azotate ripetute migliaia di volte (DNA in tandem o DNA satellite).
Queste sequenze ripetute (dette anche terminali per la loro posizione nel cromosoma) sono prive di geni e non hanno pertanto proprietà codificanti (non producono proteine).
In tutti i mammiferi, compresa la specie umana, la “firma” molecolare del telomero, più volte reiterata in successione, consiste di sei lettere riferite alla sequenza delle basi azotate costituenti il modulo fondamentale: TTAGGG.
La sequenza ripetuta in tandem può essere espressa come: (TTAGGG)n, dove n è il numero delle ripetizioni (il valore medio nella specie umana è circa n = 2000).
Il telomero subisce un accorciamento ogni volta che i cromosomi vengono duplicati nella fase S (S: sintesi) della divisione cellulare (mitosi). L’enzima telomerasi, qualora presente, provvede ad integrare la porzione delle sequenze ripetute che sono state consumate nell’evento replicativo, ripristinando le dimensioni originarie del telomero.
Tuttavia, in condizioni normali la telomerasi è presente e attiva soltanto nelle cellule germinali (spermatozoi, cellule uovo e loro cellule progenitrici) e nelle cellule staminali.
Nel corso della vita la telomerasi scompare in quasi tutte le cellule somatiche (rimane nelle staminali) e pertanto viene a determinarsi un accorciamento progressivo dei telomeri in rapporto al numero delle replicazioni cellulari nel frattempo intervenute (orologio mitotico). La regressione telomerica va a coincidere nell’ultima fase con il fenomeno dell’invecchiamento cellulare (senescenza replicativa). Pertanto, dopo un numero calcolabile di duplicazioni (50-70 nelle cellule umane), al di sotto di una certa soglia critica di riduzione della lunghezza telomerica, la crescita cellulare si blocca, per passare da una fase di senescenza ad una fase di crisi, nella quale la letalità cellulare prevale a seguito della fusione e della frammentazione dei cromosomi (caos genetico) e la cellula entra in apoptosi (morte cellulare programmata).
 Dal punto di vista genetico, un cromosoma può essere definito come una sequenza lineare di geni. Al microscopio ottico, i cromosomi sono distinguibili tra loro per le dimensioni, per la "forma" e per la posizione del centromero. Ulteriori distinzioni si possono effettuare con opportuni trattamenti chimici, che evidenziano un bandeggio (alternanza di bande trasversali con diversa pigmentazione) che identificano precise regioni. I cromosomi sono numerati progressivamente in base alle loro dimensioni: il cromosoma 1 è il più grande di tutti mentre il cromosoma 22 è il più piccolo. In ogni cromosoma si distinguono un braccio corto, indicato come “p”, un braccio lungo, indicato come “q”. Ogni braccio è suddiviso in regioni e bande, classificate con numeri progressivi a partire dal centromeroverso l'estremità del braccio corto e del braccio lungo. Ogni regione è suddivisa in bande ed in sottobande, classificate anch'esse con numerazione standardizzata a partire dal centromero. Ad esempio il gene della fibrosi cistica (CFTR - cystic fibrosis transmembrane regulator) è localizzato nella regione 3 (banda 1, sottobanda 2) del braccio lungo (q) del cromosoma 7 ed è quindi individuato come 7q31.2
Dal punto di vista genetico, un cromosoma può essere definito come una sequenza lineare di geni. Al microscopio ottico, i cromosomi sono distinguibili tra loro per le dimensioni, per la "forma" e per la posizione del centromero. Ulteriori distinzioni si possono effettuare con opportuni trattamenti chimici, che evidenziano un bandeggio (alternanza di bande trasversali con diversa pigmentazione) che identificano precise regioni. I cromosomi sono numerati progressivamente in base alle loro dimensioni: il cromosoma 1 è il più grande di tutti mentre il cromosoma 22 è il più piccolo. In ogni cromosoma si distinguono un braccio corto, indicato come “p”, un braccio lungo, indicato come “q”. Ogni braccio è suddiviso in regioni e bande, classificate con numeri progressivi a partire dal centromeroverso l'estremità del braccio corto e del braccio lungo. Ogni regione è suddivisa in bande ed in sottobande, classificate anch'esse con numerazione standardizzata a partire dal centromero. Ad esempio il gene della fibrosi cistica (CFTR - cystic fibrosis transmembrane regulator) è localizzato nella regione 3 (banda 1, sottobanda 2) del braccio lungo (q) del cromosoma 7 ed è quindi individuato come 7q31.2
Le dimensioni dei cromosomi (e del DNA in generale) possono essere espresse in unità ‘bp’ Una unità bp (base pair) si riferisce ad una singola coppia di basi complementari (A-T o C-G) che si succedono nel filamento di DNA. Si usano ovviamente i multipli di tale unità come:
1 kbp = chilobase = mille basi
1 Mbp = megabase = un milione di basi
1 Gbp = gigabase = un miliardo di basi
Le dimensioni dei cromosomi sono comprese in un intervallo di 50-280 Mbp. Poiché il genoma umano contiene circa 3200 Mpb (3,2 Gbp), la dimensione media dei 23 cromosomi è di circa 140 Mbp (3200/23).

il genoma umano
Il numero di geni contenuto nel DNA umano è ancora oggetto di discussione. Attualmente si ritiene che esso sia intorno a 20.000-30.000 geni. Un gene ha una dimensione media di 27 kbp (27.000 basi), di cui solo 1-1,5 kbp (1000 - 1500 basi) sono codificanti per la proteina (esoni), mentre la frazione residua (introni) non viene tradotta ed ha probabilmente funzioni di regolazione dell’espressione genica.
Questo significa che solo il 25% del genoma è costituito da DNA genico, per circa 800 Mbp (30.000 geni x 27 kbp/gene) e solo l’1,5% del genoma va a formare il DNA codificante per circa 45 Mbp (30.000 geni x 1,5 kbp/gene). Il rimanente 75% del genoma costituisce il DNA extragenico (o intergenico)
Dunque circa il 98.5% del genoma umano è composto di sequenze non codificanti. Si definisce DNA non codificante ogni sequenza di DNA in un genoma non soggetta a trascrizione in RNA o rimossa dall'RNA messaggero prima della traduzione (introni) e che viene perciò considerata, allo stato attuale delle conoscenze apparentemente priva di funzione, nonostante diverse ipotesi in merito siano state formulate. Tali regioni di DNA erano indicate con i termini di junk DNA o DNA spazzatura.
Un tipo particolare di DNA non codificante è costituito dalle cosiddette sequenze ripetitive che costituiscono una frazione elevata del genoma (35-50%). Il DNA ripetitivo è costituito da sequenze di DNA che si ripetono uguali molte volte nel genoma. Il DNA ripetitivo viene classificato in DNA in tandem e DNA intersperso,
Il DNA in tandem è noto anche come DNA satellite, poiché, in seguito a centrifugazione del DNA, si concentra in sottili bande satellite distinte dalla banda principale del DNA. Il DNA in tandem costituisce circa il 5% del genoma ed è formato da sequenze molto brevi di basi (10-100 bp) i cui compaiono soprattutto Adenina e Timina, che si ripetono uguali una dopo l’altra (in tandem) per tratti lunghi fino a qualche centinaio di kbp. Si trova localizzato nelle regioni centromeriche e telomeriche del cromosoma
Il DNA intersperso è costituito da sequenze che si ripetono in punti diversi del DNA, disperse in tutto il genoma. Il DNA intersperso è frutto dell’attività dei trasposoni. I trasposoni sono elementi mobili che si trovano nel genoma di tutti gli organismi. Sono in grado, con meccanismi diversi, di saltare da un punto all’altro del genoma. Esistono due tipi di trasposoni: - i trasposoni a DNA che, tramite l’enzima trasposasi, si staccano dal filamento principale sotto forma di un breve filamento anulare di DNA e si inseriscono in un altro punto del filamento principale (trasposizione conservativa)
- i retrotrasposoni che utilizzano un processo di trascrizione inversa (retrotrascrizione), tramite il quale un filamento di RNA sintetizza numerose segmenti identici di DNA che si inseriscono in punti diversi del filamento principale di DNA (trasposizione replicativa). Sono retrotrasposoni le sequenze ripetitive intersperse note come SINE (Short INterspersed Elements = elementi interspersi corti), lunghe 100-300 bp e LINE (Long INterspersed Elements = elementi interspersi lunghi), lunghe 6-8 Kbp. Nell'uomo predominano tra le SINE, la famiglia Alu, e tra le LINE, la famiglia L1.
Spesso le unità di misura delle dimensioni del DNA (kbp, Mbp, Gbp) vengono abbreviate in kb, Mb e Gb, generando non poca confusione con le corrispondenti unità di misura dell’informazione.
Kb è infatti il chilobyte, Mb il megabyte e Gb il gigabyte.
La confusione nasce dal fatto che le sequenze di DNA contengono dell’informazione (genetica) che può dunque essere misurata in bit, byte e suoi multipli (kb, Mb, Gb). Vediamo come.
Il bit (contrazione di binary digit = cifra binaria) è l’unità di misura dell’informazione. Il bit è uno dei due simboli del sistema numerico binario, classicamente chiamati zero (0) ed uno (1) che utilizziamo per individuare univocamente due alternative.
Per individuare in modo univoco le 4 basi (Adenina, Timina, Guanina e Citosina) sono necessari 2 bit (due cifre binarie).
Ad esempio:
Adenina = 00 Timina = 01 Guanina = 10 Citosina = 11
Così se volessimo registrare l’intera informazione contenuta nel genoma umano (3,2 Gbp) sarebbero necessari 6,4 miliardi di bit (6,4 Gbit = 6.400 Mbit).
Tenendo poi presente che, per definizione, 1 byte = 8 bit, il genoma umano contiene informazioni per 6.400 Mbit/8 = 800 megabyte (Mb).
In pratica, per trasformare le dimensioni del DNA, espresse in bp, in quantità di informazione in esso contenuta, espresse in byte, è sufficiente dividere per 4 (si moltiplica per 2 per ottenere i bit e si divide per 8 per ottenere i byte).
Il risultato è certamente sorprendente se si pensa che attualmente (settembre 2006) Windows XP richiede circa 1500 Mb di spazio su disco rigido per gestire un computer, quando con ‘soli’ 800 Mb il DNA gestisce l’intero nostro organismo.
Numero e struttura dei cromosomi costituiscono il cariotipo, ben evidenziabile (e fotografabile) durante la divisione cellulare.

In molte cellule i cromosomi non sono tuttavia uno diverso dall’altro, ma si presentano in coppie morfologicamente simili. I cromosomi di una medesima coppia si dicono omologhi.
Le cellule che hanno coppie di cromosomi omologhi sono dette diploidi (2n), mentre sono definite aploidi (n) le cellule che presentano un’unica serie di cromosomi uno diverso dall’altro.
n è il numero di cromosomi di una singola serie.
Le cellule diploidi sono tipiche degli organismi che si riproducono sessualmente e le due serie di omologhi sono una di provenienza materna e l’altra di provenienza paterna.
Ogni specie presenta un corredo cromosomico caratteristico per forma e numero. Le cellule diploidi umane presentano 23 coppie di omologhi (46 cromosomi) e quindi n = 23.
Nella specie umana la 23ma è la coppia dei cromosomi sessuali, che definisce il sesso genetico dell’individuo. Nella femmina è costituita da due cromosomi omologhi, detti X. Nel maschio invece è costituita da un cromosoma X (come quelli presenti nella femmina e da un cromosoma più piccolo detto Y.
Le proteine nucleari (istoni e non-istoni) non hanno solo funzioni strutturali (compattazione del DNA), ma svolgono un ruolo importante nella regolazione dell’espressione genica, stabilendo quali regioni del DNA debbano essere accessibili all’apparato trascrizionale (il DNA in forma condensata non può infatti essere ne’ trascritto ne’ duplicato). Nel nucleo avvengono in definitiva vari fenomeni di regolazione e attivazione dei geni, mediati da proteine, in modo che una proteina, codificata da un tratto del DNA (gene), venga prodotta esclusivamente nei tempi e nelle quantità richiesti dalla fisiologia della cellula.
Le proteine non istoniche sono proteine a carica negativa e sono classificate in:
- proteine che regolano la trascrizione genica;
- enzimi attivi nella trascrizione, replicazione e riparazione del DNA;
- proteine che partecipano al mantenimento della struttura della cromatina dallo stato decondensato a quello compatto.
La regolazione dell’espressione genica
Tutte le cellule di un organismo pluricellulare possiedono lo stesso genoma. Tuttavia ogni cellula si specializza nell’eseguire determinate funzioni ed utilizza solo una parte delle informazioni contenute nel suo DNA (esprime solo certe proteine). Per ogni tipo cellulare inoltre, il tipo e la quantità di proteine prodotte dipendono anche dalle necessità che la cellula presenta in un determinato istante. Le cellule devono dunque possedere dei meccanismi che permettano loro di esprimere certi geni e silenziarne altri.
Si distinguono geni costitutivi che sono costantemente attivi (es. geni che codificano per gli enzimi della glicolisi) e geni regolati la cui espressione è regolata in relazione al fabbisogno cellulare (es. sintesi adattativa di enzimi).
I meccanismi di regolazione genica più semplici e meglio compresi sono quelli utilizzati dai procarioti (batteri). I batteri utilizzano sistemi di regolazione genica noti come “operoni”.
L’operone è una unità funzionale del DNA costituita da un gruppo di geni contigui strettamente correlati, responsabili della sintesi coordinata di una proteina e della regolazione della sintesi stessa.
Un operone contiene:
- uno o più geni strutturali destinati ad essere trascritti (sintesi mRNA) e ad esprimere la proteina
- un promotore che precede i geni strutturali, costituito da una particolare sequenza di DNA che indica dove debba iniziare la trascrizione. Un promotore occupa una posizione adiacente al gene o al gruppo di geni di cui controlla la trascrizione e la sua funzione è quella di rappresentare una zona di riconoscimento e di attacco per una molecola di RNA polimerasi , l’enzima deputato alla sintesi di RNA messaggero (mRNA) a partire da uno stampo di DNA
- un gene operatore che controlla l’espressione genica dei geni strutturali.
L’azione dell’operatore è a sua volta sotto controllo di un gene regolatore che non fa parte dell’operone. Il gene regolatore è in gradi di bloccare o sbloccare il gene operatore in funzione della presenza o meno nella cellula di un particolare metabolita.
L'operone lattosio o operone lac in Escherichia coli è stato il primo operone studiato.
L'operone lattosio produce gli enzimi necessari per l'utilizzazione del lattosio da parte del batterio. Gli enzimi sono codificati da tre geni strutturali adiacenti Z, Y ed A. Questi geni vengono trascritti in un solo mRNA che viene poi tradotto nelle tre proteine. In particolare il gene lacZ codifica per la β-galattosidasi, enzima in grado di idrolizzare il lattosio (un disaccaride) in glucosio e galattosio
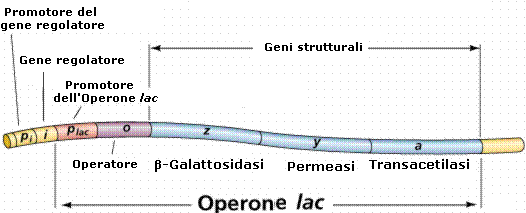
DNA |
Funzione |
Promotore del regolatore (PI) |
Controllo della trascrizione del Regolatore |
Regolatore (I) |
Codifica il repressore |
Promotore (Plac) |
Controllo della trascrizione dei geni a valle |
Operatore (O) |
Bersaglio del repressore |
lacZ |
Codifica beta-galattosidasi |
lacY |
Codifica lattosio-permeasi |
lacA |
Codifica transacetilasi |
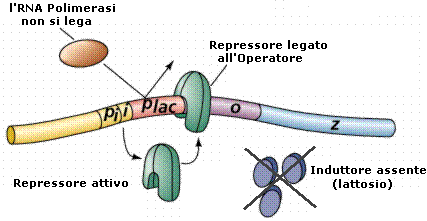
- In assenza di lattosio il repressore, sintetizzato dal gene regolatore, si lega al gene operatore e ricopre in parte il promotore, impedendo all’RNA polimerasi di legarsi al DNA e di iniziare di conseguenza la trascrizione.
- In presenza di lattosio, il lattosio funge da induttore, si lega al repressore rimuovendolo dall’operatore. Quando la proteina repressore si lega al lattosio o ai suoi derivati, va incontro a cambiamenti conformazionali che ne abbassano l’affinità verso le sequenze dell’Operatore, di fatto staccandosi da esso. La trascrizione può avvenire.
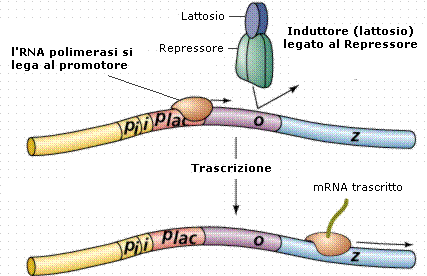
L’operone lac è un esempio di operone inducibile, tramite induzione da substrato (il lattosio).
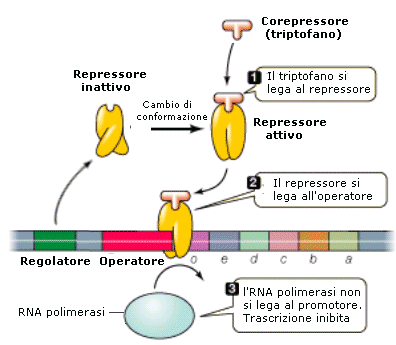
L’operone triptofano o operone trp è invece un esempio di operone reprimibile, tramite repressione da prodotto finale.
In questo caso infatti, la presenza dell’aminoacido triptofano all’interno della cellula determina il blocco della sintesi degli enzimi che lavorano in modo coordinato per la biosintesi del triptofano stesso.
Il repressore del triptofano si lega all’operatore solamente nel caso in cui sia legato al triptofano. Il triptofano presente agisce da corepressore (repressione da prodotto finale), quindi il grado di espressione dei geni per la sintesi del triptofano è inversamente correlato alla presenza di questo aminoacido nel mezzo di coltura.
Negli eucarioti il controllo dell’espressione genica è più complesso e le nostre conoscenze a riguardo sono ancora molto incerte. Si ritiene che negli eucarioti l’espressione genica avvenga su più livelli e non solo a livello trascrizionale, come avviene nei procarioti. Si ritiene, ad esempio che le proteine nucleari (istoni e non istoni) possano giocare a questo proposito un ruolo importante.
Cellula eucariote vegetale
Come abbiamo già visto la cellula eucariote vegetale non presenta alcune strutture tipiche della cellula eucariote animale, come i MTOC (centrioli e corpi basali) e le ciglia ed i flagelli. La cellula vegetale possiede alcune strutture tipiche, non presenti nella cellula animale: la parete, il vacuolo ed i plastidi.
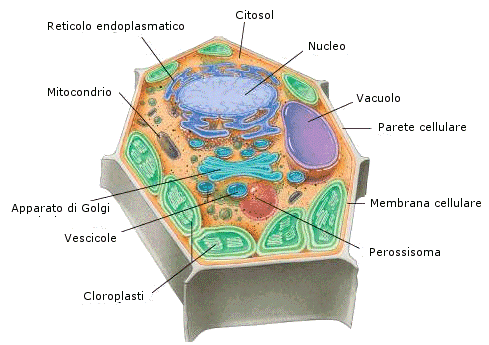
Parete cellulare
La parete costituisce uno strato rigido e robusto, posto all'esterno della membrana cellulare. È composta da sottili filamenti di cellulosa che, unendosi tra loro, formano filamenti più spessi. Le molecole si dispongono parallelamente una all'altra, su piani sovrapposti, in ognuno dei quali esse assumono una particolare direzione. Un altro costituente della parete è la lignina, che le conferisce rigidità; inoltre, vi sono sostanze grasse, quali la cutina (nelle pareti delle cellule dell'epidermide fogliare), la suberina (nelle pareti delle cellule del sughero) e le cere, che riducono le perdite d'acqua per disidratazione.
Vacuolo
Il vacuolo centrale è una cavità piena di un liquido detto succo vacuolare. Occupa gran parte del volume cellulare ed è delimitato da una membrana chiamato tonoplasto Costituisce per la cellula vegetale una sorta di idroscheletro. Esso, infatti, esercita una pressione contro la superficie della cellula che è racchiusa dalla parete rigida ed in tal modo produce un'azione di sostegno per la cellula stessa (turgore cellulare). All'interno del vacuolo possono essere immagazzinate sostanze di riserva, prodotti intermedi di alcuni processi metabolici e scorie metaboliche. Può anche diventare deposito per sostanze nocive o repellenti come difesa nei confronti degli animali.. Regolando il suo contenuto di acqua determina l’aspetto più o meno gonfio delle cellule vegetali. Regolando il contenuto idrico della cellula riesce a difendere il citoplasma dal congelamento durante la stagione fredda. Assorbendo acqua dal citoplasma lo rende più concentrato abbassando la temperatura di solidificazione della soluzione.
Plastidi
I plastidi sono costituiti come i mitocondri da un involucro costituito da due membrane. All’interno si trova un fluido contenente vari metaboliti ed intermedi di reazione detto stroma. Sulle membrane sono inseriti numerosi enzimi che partecipano a vari processi metabolici.
I plastidi hanno ribosomi e DNA propri rispetto a quelli della cellula e perciò possono svolgere sintesi proteica autonoma. Come per i mitocondri, anche per i plastidi è stata avanzata un’origine endosimbiontica. Nelle cellule non ancora differenziate si trovano i proplastidi, piccoli e con sistema interno di membrane poco sviluppato.
Dai proplastidi si differenziano i plastidi che si dividono a seconda della loro funzione, del loro colore, dello sviluppo delle membrane interne e del contenuto dello stroma, in tre diversi tipi: leucoplasti, cromoplasti e cloroplasti.
I leucoplasti sono plastidi incolori nei quali vengono sintetizzate e confinati l'amido (amiloplasti) o altre sostanze (oli e proteine).
I cromoplasti sono plastidi nei quali si accumulano pigmenti. Sono responsabili del colore dei fiori e dei frutti.
I cloroplasti sono plastidi di colore verde per la presenza prevalente di clorofilla. Rappresentano la sede della fotosintesi clorofilliana.
Cloroplasto e fotosintesi clorofilliana
Il cloroplasto è un organulo dalla forma ovoidale, la cui membrana interna presenta dei ripiegamenti a forma di minuscoli sacculi appiattiti detti tilacoidi che si sviluppano nello stroma. In alcune regioni i tilacoidi si sovrappongono andando a costituire una sorta di “pila di monete” detta grano (granum).
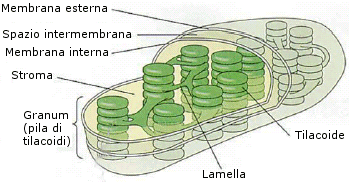
i tilacoidi presentano uno spazio interno detto lume.
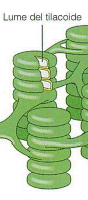
I tilacoidi sono di colore verde perché le loro membrane ospitano i pigmenti fotosintetici ed in particolare la clorofilla.
La fotosintesi è un processo di ossidoriduzione nel corso del quale l'energia elettromagnetica luminosa (luce visibile) viene trasformata in energia chimica e l'anidride carbonica viene trasformata in glucosio. La reazione globale è esattamente opposta alla reazione di respirazione aerobica.
6 CO2 + 6H2O + Energia → C6H12O6 + O2
Il Carbonio viene ridotto da anidride carbonica a glucosio, con un processo di organicazione (passaggio da una forma inorganica, CO2, ad una forma organica, C6H12O6). Gli elettroni per la riduzione del carbonio vengono forniti dall’acqua che si ossida ad ossigeno, mentre l’energia proviene direttamente dalla radiazione luminosa ed è catturata dai pigmenti fotosintetici
La fotosintesi fornisce agli organismi vegetali zuccheri semplici che possono essere immediatamente utilizzati, mediante la respirazione cellulare, come fonte di energia per il metabolismo, oppure immagazzinati per essere utilizzati successivamente. Nelle piante le riserve sono rappresentate da amido, che viene accumulato nel parenchima di organi come le radici o i tuberi. Poiché, dunque, gli organismi fotosintetici non devono introdurre con l'alimentazione (come invece gli animali) le molecole organiche da cui trarre energia, ma sono in grado di sintetizzarle da soli, essi sono considerati autotrofi. Gli animali sono eterotrofi e quindi non sono autonomi dal punto di vista alimentare: la loro esistenza dipende dalle piante.
L'importanza della fotosintesi risiede nel fatto che essa converte l'energia solare in una forma di energia utilizzabile da tutti i viventi. Gli organismi fotosintetici formano il primo anello della catena alimentare e poiché producono sostanza organica sono detti organismi produttori. Gli animali erbivori che se ne nutrono formano il secondo anello, i carnivori che si cibano degli erbivori formano il terzo anello e così via. L'energia solare, convertita in energia chimica con la fotosintesi, fluisce dunque dal primo anello ai successivi e alimenta lo svolgimento di tutti i processi vitali. Inoltre, la fotosintesi fornisce come sottoprodotto l'ossigeno che viene utilizzato da tutti i viventi, compresi gli stessi organismi fotosintetici, per i processi di respirazione cellulare (ciò non riguarda gli organismi anaerobi, che vivono in ambienti privi di ossigeno).
La comparsa dei primi organismi fotosintetici, all'inizio dell'evoluzione della vita sulla Terra, determinò la modificazione dell'atmosfera primordiale, arricchendola di ossigeno. Sembra che i primi organismi capaci di fotosintesi siano stati i cianobatteri (o alghe azzurre) che contribuirono in modo particolare alla produzione dell'ossigeno atmosferico permettendo la nascita di specie aerobie, capaci di utilizzarlo mediante processi di respirazione.
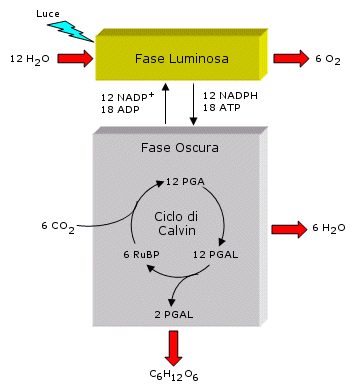
Nello schema generale della fotosintesi si possono distinguere due fasi collegate tra loro: una fase luminosa, fotochimica, ed una fase oscura, chimica.
La fase luminosa avviene solo in presenza di luce ed è localizzata nelle membrane dei tilacoidi
La fase oscura è indipendente dalla luce ed è localizzata nello stroma.
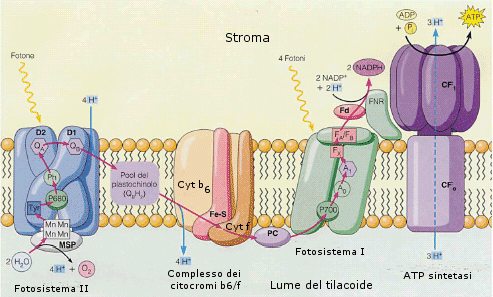
La fase luminosa consiste nella cattura da parte dei pigmenti fotosintetici situati nei tilacoidi della radiazione luminosa e nella sua trasformazione in legami ad alta energia tramite la sintesi di ATP e la riduzione di NADP+ a NADPH. In questa fase l’acqua viene ossidata ad ossigeno al fine di fornire gli elettroni necessari alla riduzione del NADPH+. Durante la fase luminosa viene quindi liberato ossigeno gassoso O2.
Nella fase oscura, l’ATP e il NADPH forniscono l'energia e il potere riducente necessari per la riduzione della CO2 a glucosio (organicazione del carbonio, attraverso un ciclo biochimico noto come ciclo di Calvin.
Fase luminosa e fotosistemi
Sulle membrane si trovano molecole di pigmenti che formano due strutture molecolari dette fotosistema I e fotosistema II. Oltre alla clorofilla, vi sono anche pigmenti accessori, per lo più ficobiline e carotenoidi. Ogni tipo di pigmento è in grado di assorbire una particolare lunghezza d'onda della luce.
Ciò dipende dal fatto che ogni lunghezza d’onda, che corrisponde ad un diverso colore, trasporta una quantità ben precisa e caratteristica di energia. Secondo la teoria quantistica infatti la radiazione elettromagnetica può essere descritta come un flusso di pacchetti di energia, detti quanti di radiazione o fotoni. L’energia di ciascun fotone è inversamente proporzionale alla lunghezza d’onda della radiazione.
Come abbiamo già visto, gli elettroni degli atomi si muovono anch’essi in livelli energetici definiti (quantizzati) e per passare da un livello energetico inferiore (più vicino al nucleo) ad un livello energetico superiore (più distante dal nucleo) possono assorbire solo una quantità di energia ben definita, pari alla differenza di energia tra il livello energetico di arrivo e quello di partenza.
Ogni molecola presenta tuttavia livelli energetici diversi e caratteristici e quindi, affinché un elettrone passi da un livello ad un altro, la molecola può assorbire solo ben precise quantità di energia e quindi solo certe radiazioni luminose.
Quando un elettrone, illuminato da una radiazione opportuna, assorbe energia sotto forma di un fotone e passa ad un livello energetico superiore, si dice che effettua un salto quantico (o transizione elettronica) e la molecola passa ad uno stato eccitato. In questo modo ogni pigmento fotosintetico si comporta come un’antenna chimica in grado di assorbire solo certe radiazioni luminose.

Ad esempio la struttura elettronica della clorofilla è tale per cui, colpita da luce bianca (che contiene tutti i colori), assorbe le lunghezze d'onda corrispondenti al blu ed al rosso, mentre riflette il verde (ed è per questo che ci appare di questo colore).
Le molecole che hanno assorbito energia, e si trovano in uno stato eccitato, sono in una situazione di instabilità che le porterà a riemettere tale energia. I fotosistemi sono sistemi di pigmenti organizzati in modo tale da assorbire la radiazione luminosa e da trasferirla, tramite assorbimenti e riemissioni, ad una molecola di clorofilla a, detta centro di reazione del fotosistema. L’energia in questo modo si concentra (una sorta di imbuto energetico) ed è sufficiente a strappare un elettrone al centro di reazione provocando in questo modo una reazione chimica, l’ossidazione del centro di reazione che cede elettroni ad una molecola, detta accettore primario del fotosistema.

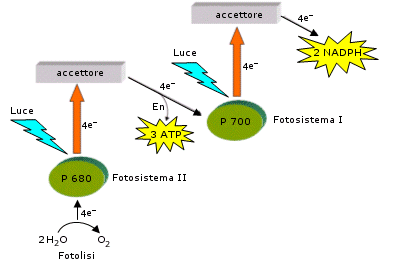
Il fotosistema I ha il massimo di assorbimento a lunghezza d'onda 700 nm, perciò viene chiamato P 700. Il fotosistema II, per ragioni analoghe, P 680.
I due fotosistemi lavorano in modo integrato, generando un flusso di elettroni, alimentato dall’energia luminosa, che li percorre partendo dall’acqua fino a raggiungere il NADPH.
Il fotosistema II lavora ad un livello energetico leggermente inferiore rispetto al fotosistema I.
1) Gli elettroni del centro di reazione del fotosistema II, spinti dai fotoni assorbiti ad un livello di energia superiore, vengono captati dall’accettore primario del fotosistema (plastochinone).
2) Gli elettroni vengono successivamente ceduti dall’accettore primario del fotosistema II attraverso una catena di trasporto degli elettroni, al centro di reazione del fotosistema I che si trova ad un livello energetico inferiore. Durante questa discesa si libera energia che viene utilizzata per sintetizzare ATP (fotofosforilazione) L’ATP è il primo prodotto della fase luminosa, che verrà utilizzato nella fase oscura.
3) Gli elettroni giunti al centro di razione del fotosistema I, spinti dai fotoni assorbiti ad un livello di energia superiore, vengono captati dall’accettore primario del fotosistema I e da qui vengono ceduti al NADP+ che si riduce a NADPH che è il secondo prodotto della fase luminosa, che verrà utilizzato, per il suo potere riducente, nella fase oscura.
4) Il centro di reazione del fotosistema II viene continuamente rifornito di elettroni dalla reazione di fotolisi (si legge fotòlisi) dell'acqua in cui l’acqua, in presenza di luce, viene ossidata ad ossigeno molecolare
L’intera fase luminosa può essere rappresentata attraverso il cosiddetto schema a Z, riportato di seguito
Le reazioni della fase luminosa possono essere così riassunte:
12 H2O + 12 NADP+ → 12 NADPH + 12H+ + 6O2 + 18 ATP
La sintesi di ATP è legata al flusso di elettroni, che può essere ciclico o non ciclico. Ai due tipi di flusso corrispondono la fotofosforilazione ciclica e la fotofosforilazione non ciclica.
La maggior parte delle piante utilizzano il flusso non ciclico, che abbiamo appena visto e che risulta più efficiente, portando alla sintesi anche del NADPH. Nel flusso non ciclico il movimento degli elettroni avviene lungo l'intera via Z poiché gli elettroni iniziano e terminano il loro spostamento a livello di sostanze diverse.
Nel flusso ciclico degli elettroni fotosintetici il movimento avviene lungo un percorso che si chiude ad anello con il P700 del fotosistema I. Gli elettroni passano dall'accettore primario del fotosistema I ad un trasportatore che non fa parte della via Z, il citocromo b6 e vengono restituiti al centro di reazione del Fotosistema I. Questo processo, poco efficiente, è probabilmente molto antico dal punto di vista evolutivo ed appare come un residuo delle prime vie metaboliche messe a punto dai primi microrganismi procarioti fotosintetici
Il meccanismo che accoppia la sintesi di ATP con il trasporto degli elettroni nei cloroplasti viene spiegato dall'ipotesi chemioosmotica di Mitchell (già vista nel processo di respirazione aerobica). La produzione di ATP è accoppiata alla formazione di un gradiente di protoni (ioni H+) durante la fotosintesi. Alcune molecole (complesso citocromo-b6/citocromo-f) che partecipano al trasferimento degli elettroni da un fotosistema all’altro sono infatti in grado di pompare ioni H+ nel lume dei tilacoidi (pompe protoniche) il quale diventa più acido rispetto allo stroma del cloroplasto (formazione di un gradiente elettrochimico). Anche la fotolisi dell’acqua libera ioni H+ nel lume dei tilacoidi. La sintesi di ATP avviene come conseguenza del ritorno dei protoni nello stroma, in risposta al gradiente generato, attraverso le ATP-sintetasi situate nelle membrane dei tilacoidi.
Fase oscura e ciclo di Calvin-Benson
La fase oscura si svolge nello stroma dei cloroplasti, dove l'energia immagazzinata in ATP e NADPH viene impiegata per ridurre l'anidride carbonica in carbonio organico. Ciò avviene tramite una serie di reazioni, conosciute come ciclo di Calvin-Benson (detto anche ciclo C3 poiché la maggior parte delle molecole che lo costituiscono possiedono 3 atomi da carbonio). Ad ogni ciclo una molecola di anidride carbonica si combina con uno zucchero a 5 atomi di carbonio, chiamato ribulosio-1,5-difosfato (RuDP), per formare due molecole di un composto a 3 atomi di carbonio, chiamato 3-fosfoglicerato (PGA). Il PGA viene ridotto dal NADPH e fosforilato dall’ATP trasformandosi in un composto a 3 atomi di carbonio, la gliceraldeide-3-fosfato o fosfogliceraldeide (PGAL) Dopo sei cicli, ciascuno dei quali consuma una molecola di anidride carbonica, due di NADPH e tre di ATP, vengono prodotte 12 molecole di PGAL, due delle quali si combinano a formare una molecola a 6 atomi di carbonio, il glucosio, mentre le rimanenti rigenerano il RuDP. Le reazioni della fase oscura possono essere così riassunte:
6 CO2 + 12 NADPH + 12H+ + 18 ATP → 12 NADP+ + C6H12O6 + 6 H2O
L’intero processo può essere così schematizzato:
Piante C4
Ad elevate temperature e con ridotta disponibilità di acqua le piante tendono a chiudere gli stomi delle foglie per ridurre la perdita d’acqua per evaporazione. In queste condizioni tuttavia l’anidride carbonica non può entrare nella foglia, mentre l’ossigeno prodotto dalla fotosintesi si accumula all’interno. In presenza di un rapporto O2/CO2 elevato all’interno della foglia si innesca un processo di fotorespirazione. Sebbene l’enzima ribulosio bisfosfato carbossilasi (rubisco) aggiunga di preferenza CO2 al RuBP, a basse concentrazione di CO2, può utilizzare anche O2. Il RuBP reagisce con l’ossigeno per dare solo una molecola di PGA ed una di acido fosfoglicolico.
Una minor quantità di PGA rallenta il ciclo di Calvin e lo sviluppo della pianta ne risente.
Piante come la canna da zucchero, il mais e altre piante dette piante C4 sono tuttavia in grado di sintetizzare carboidrati anche quando il rapporto O2/CO2 è sfavorevole.
In queste piante l'anidride carbonica non partecipa direttamente al ciclo di Calvin, ma viene "temporaneamente" trasformata, a livello delle cellule del mesofillo della foglia, in un composto detto PEP (fosfoenolpiruvato) con successiva formazione di ossalacetato, un composto a 4 atomi di carbonio (da cui il nome C4). Questo viene a sua volta trasformato in un altro composto a 4 atomi di carbonio, il malato (o l'aspartato, a seconda della specie vegetale), che migra dal mesofillo alle cellule che circondano i fasci conduttori (cellule della guaina del fascio). Qui il malato (o l'aspartato) viene riconvertito in anidride carbonica, CO2, che viene infine coinvolta nelle reazioni del ciclo di Krebs. Questo tipo di fotosintesi si riscontra principalmente in piante che vivono nelle regioni tropicali. Nelle piante C4 la fotosintesi si svolge infatti in modo ottimale a temperature più alte di quelle richieste dalle piante C3. Inoltre, le C4 riescono a fiorire a temperature alle quali le C3 non sopravvivono. La resa della fotosintesi con ciclo C4 (ossia la quantità di zuccheri prodotti rispetto all'anidride carbonica utilizzata) è superiore a quella della fotosintesi C3. In altre parole, le piante C4 riescono ad effettuare la fotosintesi alla stessa velocità delle C3, ma aprendo in misura inferiore gli stomi, limitando in tal modo anche la perdita di acqua.
Piante CAM
La fotosintesi CAM (acronimo di Crassulacean Acid Metabolism, ossia metabolismo acido delle crassulacee) avviene in modo analogo alla fotosintesi con ciclo C4: anch'essa, infatti, prevede una fase iniziale in cui l'anidride carbonica viene trasformata in composti a 4 atomi di carbonio e una fase successiva in cui questi vengono riconvertiti in anidride carbonica, che viene coinvolta nella reazione del ciclo di Krebs. Le due fasi avvengono in due momenti separati. La prima avviene di notte, quando i composti a 4 atomi di carbonio (soprattutto acido malico) appena sintetizzati vengono accumulati in speciali vacuoli. La seconda fase avviene di giorno. Questo tipo di fotosintesi è tipico, come indica il suo stesso nome, di molte piante succulente, come le crassulacee e le cactacee, e rappresenta un adattamento ai climi caldi e aridi in cui tali piante vivono. Infatti, la fase che richiede l'apertura degli stomi, per permettere l'ingresso della CO2, avviene di notte, quando l'ambiente risulta più fresco e umido; la seconda fase può invece avvenire di giorno, perché non richiede l'apertura degli stomi. In tal modo, le succulente evitano pericolose perdite di acqua. Anche alcune specie non succulente come l’ananas effettuano la fotosintesi CAM.
Divisione cellulare: mitosi e meiosi
Una delle funzioni fondamentali e caratteristiche della cellula è quella di dividersi in due cellule figlie. Esistono due tipi di divisione cellulare: la mitosi e la meiosi.
La mitosi è una divisione cellulare in cui le cellule figlie presentano il medesimo corredo cromosomico della cellula madre. Durante un processo mitotico una cellula diploide (2n) genera due cellule diploidi geneticamente identiche ad essa (clonazione). Gli organismi unicellulari utilizzano la mitosi per riprodursi (un batterio si scinde in due batteri tramite mitosi). Gli organismi pluricellulari utilizzano la mitosi per aumentare il numero delle loro cellule (sviluppo ed accrescimento) e successivamente per sostituire le cellule morte ed invecchiate. Il corpo degli organismi pluricellulari è composto da molti miliardi di cellule, unite fra loro a formare tessuti e organi deputati a svolgere funzioni specifiche. Tutte le cellule di un organismo pluricellulare derivano infatti da un'unica cellula, lo zigote che si forma dall’unione di un gamete femminile (uovo) con un gamete maschile (spermatozoo) tramite il processo della fecondazione. Una volta formatosi, lo zigote genera tutte le cellule somatiche attraverso una serie di mitosi. Nella specie umana lo zigote completa l’accrescimento dopo una cinquantina di mitosi, formando quindi circa 250 ≈ 1015 cellule.
La meiosi è una divisione cellulare in cui le cellule figlie presentano un corredo cromosomico dimezzato rispetto alla cellula madre. Durante un processo meiotico una cellula madre diploide genera cellule figlie aploidi tra loro geneticamente diverse. La meiosi viene utilizzata dagli organismi pluricellulari per creare le loro cellule riproduttive o germinali, i gameti. La meiosi ha dunque una funzione riproduttiva negli organismi pluricellulari, generando le cellule aploidi che dovranno poi fondersi durante la fecondazione per rigenerare il corredo diploide dello zigote. La meiosi, come vedremo, ha il compito di creare “variabilità genetica”, producendo cellule aploidi geneticamente una diversa dall’altra in modo tale che i nuovi individui che si generano per unione di due gameti siano geneticamente dissimili.
La mitosi ed il ciclo cellulare
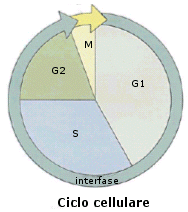 L’intervallo di tempo tra una mitosi e l’altra è definito interfase la quale di solito occupa la maggior parte del ciclo vitale della cellula. Il succedersi di interfase e fase mitotica definisce il cosiddetto ciclo cellulare. L’interfase si suddivide a sua volta nelle fasi G1, S e G2.
L’intervallo di tempo tra una mitosi e l’altra è definito interfase la quale di solito occupa la maggior parte del ciclo vitale della cellula. Il succedersi di interfase e fase mitotica definisce il cosiddetto ciclo cellulare. L’interfase si suddivide a sua volta nelle fasi G1, S e G2.
La prima tappa o fase G1 (G = growth = crescita) è di solito molto più lunga delle altre fasi del ciclo cellulare. In questo periodo, la cellula cresce ed adempie alle sue funzioni specifiche nell’ambito del tessuto di cui fa parte, aumentando le sue dimensioni ed il numero dei suoi organuli.
Durante la fase S (S = sintesi) si ha la replicazione (o duplicazione) del DNA.
La fase G2 copre l’intervallo tra la fine della fase S e l’inizio della fase M. è relativamente corta e rappresenta il periodo in cui la cellula si prepara alla divisione mitotica.
Alcuni tipi cellulari procedono continuamente attraverso il ciclo cellulare, come nel caso di tessuti in crescita o ad alto ricambio cellulare, mentre le cellule differenziate e specializzate interrompono il ciclo cellulare dopo la fase M, entrando in uno stato funzionale designato come fase G0 (G zero). Le cellule in grado di dividersi facoltativamente entrano nella fase G0, ma mantengono la capacità di entrare in ciclo se opportunamente stimolate.
In generale, le fasi S, G2, M hanno una durata relativamente costante, di parecchie ore, mentre la fase G1 è molto variabile, potendo durare anche parecchi giorni. La fase G0 può durare per l’intera vita dell’organismo.
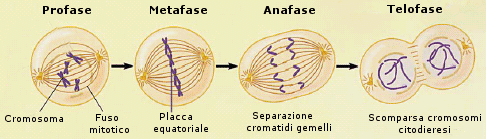
La mitosi è un processo continuo che viene tradizionalmente suddiviso in quattro fasi: profase, metafase, anafase e telofase
Ogni fase è facilmente riconoscibile al microscopio ottico. La divisione cellulare richiede la presenza di una struttura chiamata apparato mitotico che comprende un fuso di microtubuli disposti longitudinalmente tra due strutture chiamate centrioli ai due poli della cellula. L’apparato mitotico è visibile nel citoplasma solo durante la fase M del ciclo, poiché si disaggrega rapidamente al termine della mitosi.
Profase (formazione cromosomi e fuso mitotico, scomparsa membrana nucleare)
la cromatina si condensa fino a formare i cromosomi, ciascuno costituito da due cromatidi (i cromosomi si sono già duplicati nel corso della precedente fase S), che diventano visibili all’interno del nucleo. I nucleoli e la membrana nucleare scompaiono. I centrioli migrano ai poli opposti della cellula mentre fra essi si forma un fascio di microtubuli (microtubuli interpolari). Quando i centrioli si separano, i microtubuli si allungano progressivamente per l’aggiunta di subunità di tubulina: si forma il fuso mitotico
Metafase (formazione piastra equatoriale)
I cromosomi duplicati si agganciano alle fibre del fuso mediante il cinetocore. Il cinetocore è un’area appiattita presente in ciascun cromosoma duplicato in corrispondenza del centromero, la struttura che mantiene legati insieme i due cromatidi. I cromosomi si dispongono quindi nella parte mediana del fuso formando una struttura, nota come piastra equatoriale o piastra della metafase.
Anafase (separazione e migrazione cromatidi)
Separazione del centromero che lega i cromatidi di ogni cromosoma duplicato. I cromatidi di ogni cromosoma duplicato sono tirati dai tubuli connessi a livello del cinetocore, verso le estremità opposte del fuso. Ciò permette un’esatta divisione del materiale genetico duplicato. Al termine dell’anafase, due gruppi di cromosomi identici (i precedenti cromatidi) sono ammassati ai poli opposti della cellula.
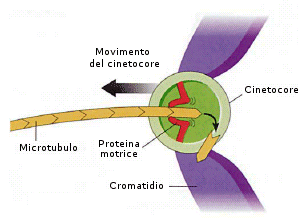
Telofase (scomparsa cromosomi e fuso mitotico, formazione membrana nucleare e citodieresi)
I cromosomi si despiralizzano e si dissolvono in cromatina. Intorno ai due nuovi complessi cromosomici ricompaiono le membrane nucleari. La telofase si conclude con la citodieresi (o citocinesi) con cui la cellula si divide nelle due cellule figlie. All’inizio della fase G1, il fuso mitotico si disassembla ed in molti tipi cellulari, i centrioli cominciano a duplicarsi in previsione della successiva divisione mitotica.
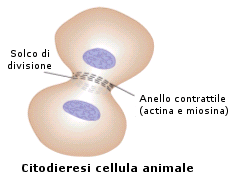
La citodieresi avviene con modalità diverse nelle cellule animali e vegetali.
Nella cellula animale La membrana plasmatica si introflette a livello della zona equatoriale in modo tale da formare un solco intorno alla cellula. Questo circonda progressivamente la cellula, strozzandola finché questa non si divide in due cellule figlie. Un anello di microfilamenti (actina) è presente appena sotto il solco di divisione e si ritiene che la citodieresi avvenga per la contrazione di questo anello.
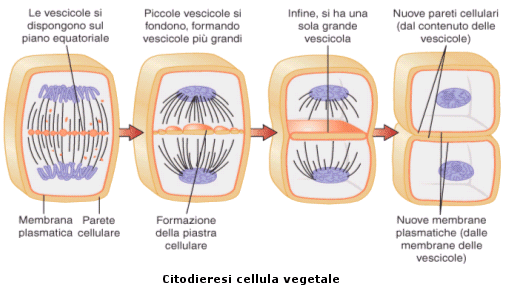
Nella cellula vegetale l’apparato di Golgi produce una serie di vescicole (fragmosomi) contenenti polisaccaridi. Queste si vanno a depositare sulla linea mediana, si fondono insieme e formano una parete chiamata piastra cellulare. Quando questa lamella è completata ogni cellula costruisce la sua membrana cellulare utilizzando le membrane delle vescicole che si sono fuse.
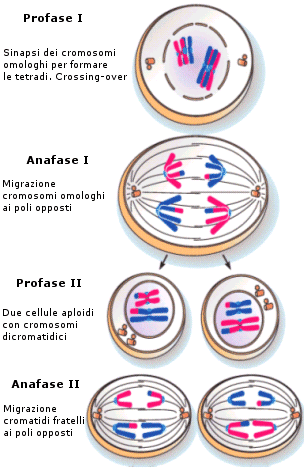
Meiosi
La meiosi è il processo di divisione mediante il quale una cellula diploide dà origine a quattro cellule aploidi. La meiosi avviene solo nelle cellule germinali delle gonadi (testicoli ed ovaie) e porta alla formazione dei gameti (spermatozoi ed ovuli). La divisione meiotica è perciò parte della gametogenesi. La meiosi comprende due processi di divisione cellulare (meiosi I e meiosi II), dei quali, solo il primo è preceduto da duplicazione del DNA. Ciascuno dei due processi si divide in profase, metafase, anafase e telofase

Prima divisione meiotica
La prima divisione meiotica determina la formazione di due cellule figlie aploidi. Questo processo si differenzia dalla mitosi per due aspetti importanti che si realizzano rispettivamente in profase ed anafase:
Durante la profase I i cromosomi omologhi si appaiono e si uniscono longitudinalmente grazie ad una struttura proteica detta complesso sinaptonemale. Questa fase di appaiamento è detta sinapsi.
Successivamente i cromatidi iniziano a separarsi (desinapsi) rimanendo però incrociati in punti detti chiasmi, formando strutture a 4 cromatidi note come tetradi (o bivalenti). In questo modo gli omologhi si scambiano tratti di DNA attraverso un processo noto come crossing-over. Quando i due omologhi si separeranno alcuni geni del cromosoma paterno si saranno spostati su quello materno e viceversa, con una ricombinazione del patrimonio genetico. Il crossing-over è il primo meccanismo con cui si crea variabilità genetica durante la meiosi e che consente ai gameti aploidi che si formeranno di essere geneticamente diversi uno dall’altro.
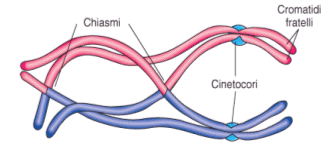 Durante l’anafase I, dopo che le tetradi si sono andate a disporre sulla piastra equatoriale, gli omologhi si separano e migrano verso i poli opposti del fuso. Si noti la differenza con la mitosi in cui vi era una separazione dei cromatidi di ciascun omologo. In questo caso i cromatidi rimangono uniti, mentre si separano gli omologhi. Ogni coppia di omologhi è formata da un cromosoma di provenienza materna ed uno di provenienza paterna. La separazione dei cromosomi materni e paterni avviene in modo casuale. Ciascuna coppia si separa in modo indipendente da quello che fanno le altre. Questo processo è noto come assortimento indipendente degli omologhi ed è il secondo meccanismo con cui si crea variabilità genetica durante la meiosi. In questo modo infatti le cellule aploidi che si creano alla fine della prima divisione meiotica possono presentare 223 diverse combinazioni di cromosomi materni e paterni. Se ad esempio consideriamo un corredo cromosomico costituito da 3 coppie di omologhi che indichiamo con M1P1, M2P2 ed M3P3. l’assortimento indipendente degli omologhi potrebbe generare 23 gameti differenti per la combinazione di cromosomi materni/paterni:
Durante l’anafase I, dopo che le tetradi si sono andate a disporre sulla piastra equatoriale, gli omologhi si separano e migrano verso i poli opposti del fuso. Si noti la differenza con la mitosi in cui vi era una separazione dei cromatidi di ciascun omologo. In questo caso i cromatidi rimangono uniti, mentre si separano gli omologhi. Ogni coppia di omologhi è formata da un cromosoma di provenienza materna ed uno di provenienza paterna. La separazione dei cromosomi materni e paterni avviene in modo casuale. Ciascuna coppia si separa in modo indipendente da quello che fanno le altre. Questo processo è noto come assortimento indipendente degli omologhi ed è il secondo meccanismo con cui si crea variabilità genetica durante la meiosi. In questo modo infatti le cellule aploidi che si creano alla fine della prima divisione meiotica possono presentare 223 diverse combinazioni di cromosomi materni e paterni. Se ad esempio consideriamo un corredo cromosomico costituito da 3 coppie di omologhi che indichiamo con M1P1, M2P2 ed M3P3. l’assortimento indipendente degli omologhi potrebbe generare 23 gameti differenti per la combinazione di cromosomi materni/paterni:
M1M2M3 P1M2M3 M1P2M3 M1M2P3 P1P2M3 P1M2P3 M1P2P3 P1P2P3
Seconda divisione meiotica
Durante la seconda divisione meiotica ciascuna cellula aploide generatasi dalla meiosi I si divide formando due cellule aploidi, per un totale di 4 cellule aploidi. Questo processo è molto simile ad una mitosi, in quanto durante l’anafase II ciascun cromosoma si separa nei due cromatidi che ancora lo costituiscono, i quali migrano poi ai poli opposti della cellula.
Le differenze tra MEIOSI II e MITOSI sono :
- la meiosi II non è preceduta dal processo di duplicazione del DNA
- la meiosi II genera cellule aploidi a partire da cellule aploidi, mentre la mitosi genera cellule diploidi a partire da cellule diploidi.
Genetica
La genetica nasce verso la metà dell’Ottocento con gli esperimenti di Gregor Mendel, un abate austriaco che per primo individuò le leggi dell’ereditarietà che regolano la trasmissione dei caratteri da una generazione all’altra. La genetica mendeliana è oggi nota come genetica classica o genetica formale.
Gli studi sull'eredità compiuti da Mendel furono pubblicati nel 1865 ma rimasero quasi totalmente ignorati fino all'inizio del `900, quando furono riscoperti da tre botanici che stavano lavorando sull'incrocio di alcune varietà vegetali (Hugo de Vries, Karl Correns e Erich Tschermak von Seysenegg).
A partire dagli anni ’30 e '40 del Novecento alla genetica classica si sono aggiunte la genetica di popolazione e successivamente la genetica molecolare.
La genetica di popolazione nasce dalla fusione dei principi della genetica mendeliana con la teoria dell’evoluzione (teoria sintetica dell’evoluzione). Negli anni ’30 vennero messi a punto modelli matematici e statistici in grado di simulare l’effetto dell’eredità mendeliana sulla dinamica evolutiva delle popolazioni. La genetica di popolazione studia la struttura genetica delle popolazioni (distribuzione dei caratteri all’interno di un gruppo di individui) ed i processi evolutivi ai quali essa è sottoposta. (dinamica delle variazioni di frequenza dei caratteri e cause che le provocano).
La genetica molecolare nasce in seguito alla scoperta che la base chimica e molecolare dell'eredità è costituita dagli acidi nucleici, principalmente il DNA. La genetica molecolare studia la struttura biochimica del gene e la relazione esistente tra geni e caratteri osservabili. A partire dagli anni `70, con l'impiego delle tecniche della biologia molecolare, si è aperta la strada alla manipolazione del materiale genetico e quindi allo sviluppo dell'ingegneria genetica.
Genetica classica
Alla base della genetica formale c'è il concetto di gene, fattore ereditario legato ad una particolare caratteristica morfologica o fisiologica dell’individuo, detta carattere. Da un punto di vista molecolare il gene è il tratto di DNA che controlla la manifestazione di un carattere, in genere codificando per una particolare proteina. I geni sono contenuti nei cromosomi. Un cromosoma può essere visto come un’ordinata successione di geni. A causa di mutazioni avvenute durante il processo evolutivo di una specie, un gene può presentarsi con delle forme varianti, dette forme alleliche o alleli (dal greco allelos = l’uno o l’altro. alternativo). Ad esempio il gene che controlla la comparsa sui globuli rossi umani del marcatore per il sistema AB0 esiste in tre varianti alleliche (IA, IB, i). IA che codifica per il marcatore A, IB che codifica per il marcatore B, i che non codifica per alcun marcatore (0, zero).
Negli organismi diploidi, le cui cellule contengono due serie di cromosomi omologhi (2n), ciascun gene è portato sia dall’omologo materno che dall’omologo paterno. In altre parole, anche se in natura un carattere presenta più di due forme alleliche (come accade per i 3 alleli del sistema AB0) in un particolare individuo diploide il carattere si presenta sempre con due alleli che occupano la medesima posizione (locus) nei due cromosomi omologhi.
Ovviamente i due alleli che controllano un particolare carattere in un individuo potranno essere uguali o diversi. Ad esempio per il carattere AB0 un individuo potrà presentare le seguenti combinazioni alleliche IAIA, IBIB, ii, IAIB, IAi, IBi.
Un individuo i cui due alleli per la determinazione di un carattere sono uguali si dice omozigote per quel carattere.
Un individuo i cui due alleli per la determinazione di un carattere sono diversi si dice eterozigote per quel carattere.
La particolare combinazione di alleli che controlla un carattere si definisce genotipo.
Ogni genotipo genera una manifestazione osservabile di un carattere che si definisce fenotipo.
Nella genetica formale l'espressione di un gene è il modo in cui il genotipo si traduce nel fenotipo, determinando un carattere.
Nel caso di omozigosi (due alleli uguali) il fenotipo non può che riflettere l’unica informazione esistente nel genotipo.
Nel caso di eterozigosi invece il genotipo può manifestarsi con fenotipi differenti a seconda del tipo di interazione che si produce tra i due alleli diversi. In particolare si possono presentare tre tipi di relazione: dominanza completa, dominanza incompleta e codominanza.
- Si ha dominanza completa (o semplicemente dominanza) quando uno dei due alleli prevale sull’altro ed è l’unico a manifestarsi, determinando il fenotipo. L’allele che si manifesta è detto dominante. L’allele che rimane latente è detto recessivo. Per convenzione l’allele dominante viene indicato con una lettera maiuscola (ad esempio A) e l’allele recessivo con la corrispondente minuscola (ad esempio a). Dal punto di vista molecolare l'allele recessivo non viene utilizzato o non codifica un prodotto funzionale. L'unico prodotto che viene a formarsi è quello codificato dall'allele dominante. L'allele dominante si esprime sempre. Ciò comporta che gli eterozigoti (genotipo = Aa) siano indistinguibili dagli omozigoti dominanti (genotipo = AA), avendo lo stesso fenotipo, detto fenotipo completamente dominante. La comparsa del fenotipo recessivo, invece, identifica senza ambiguità un omozigote recessivo (genotipo = aa). Gli eterozigoti (Aa) e gli omozigoti dominanti (AA) per un determinato gene mostrano l'effetto dell'allele dominante, mentre gli omozigoti recessivi (aa) mostrano l'effetto dell'allele recessivo. Così se il gene che determina il colore di un fiore presenta un allele dominante rosso (R) ed un allele recessivo bianco (r), in natura avremo che gli individui con genotipo omozigote dominante (RR) e gli individui con genotipo eterozigote (Rr) si presenteranno entrambi con i fiori rossi (presentano il medesimo fenotipo). Mentre gli individui con genotipo omozigote recessivo (rr) si presenteranno con i fiori bianchi.
- Si parla invece di dominanza incompleta (detta anche intermedia) quando il fenotipo dell'eterozigote è una mescolanza tra il fenotipo dell'omozigote dominante e quello dell'omozigote recessivo. In questo caso dal fenotipo si può sempre risalire al genotipo.
Ad esempio il colore del fiore della bocca di leone può essere rosso (omozigote dominante RR), rosa (eterozigote Rr) o bianco (omozigote recessivo rr). La spiegazione in termini molecolari è che in un eterozigote è presente il prodotto funzionale solo di un allele. Vi è quindi una sola dose del prodotto genico e ne deriva un fenotipo intermedio rispetto all’omozigote dominante in cui sono presenti due dosi del prodotto genico e all’omozigote recessivo in cui il prodotto genico non viene espresso (nessuna dose di prodotto genico). Nel caso della dominanza completa, metà della quantità di proteina prodotta è invece sufficiente per consentire un fenotipo normale. Si dice che l’allele presenta aplosufficienza, ossia il prodotto genico è sufficiente a garantire un fenotipo normale, anche se presente in singola dose.
- Nella codominanza, in un individuo eterozigote si osserva l’espressione fenotipica di entrambi gli alleli, non mescolati, ma separati. In altri termini, l’eterozigote manifesta i fenotipi di entrambi gli omozigoti. Esempi di codominanza sono il colore pezzato del mantello di molti mammiferi ed i sistemi di gruppo sanguigno AB0. Gli individui eterozigoti (genotipo = IA IB) sono di gruppo sanguigno AB, perché vengono espressi sia l’antigene A (prodotto dall’allele IA) che l’antigene B (prodotto dall’allele IB) e sulla membrana dei loro globuli rossi sono presenti entrambi i marcatori. La natura di "dominante" o "codominante" non dipende dal singolo allele, ma dalla coppia di alleli considerata. Perciò tra differenti alleli di un gene vi possono essere entrambe le relazioni. Ad esempio, nel carattere "gruppo sanguigno del sistema AB0" gli alleli IA e IB, che determinano la comparsa dei rispettivi marcatori, sono tra loro codominanti, mentre dominano (completamente) sull'allele i, che non produce alcun antigene (0, zero).
Genotipo |
Fenotipo |
IA IA (omozigote dominante) |
A |
IB IB (omozigote dominante) |
B |
i i (omozigote recessivo) |
0 |
IA IB (eterozigote) |
AB |
IA i (eterozigote) |
A |
IB i (eterozigote) |
B |
Le leggi della genetica classica traggono origine dai risultati di incroci. In genere gli incroci non si interrompono alla prima generazione, ma gli individui ottenuti vengono incrociati per più generazioni.
Gli individui iniziali, i genitori, costituiscono la generazione parentale o generazione P.
I figli vanno a formare la prima generazione filiale o generazione F1.
I nipoti vanno a formare la seconda generazione filiale o generazione F2 e così via.
Mendel: le leggi dell’ereditarietà
I primi esperimenti sul meccanismo dell'eredità furono compiuti verso il 1860 da Gregor Mendel (1882-1884), in un monastero nell'attuale Brno, eseguendo incroci su piante di pisello (Pisum sativum). I risultati ottenuti da Mendel vengono tradizionalmente riassunti in alcune leggi (le leggi di Mendel). Se si confrontano i diversi manuali di genetica si noterà che la formulazione delle leggi varia sia per quanto riguarda il numero (due o tre leggi) che per ciò che riguarda l’ordine di enunciazione e la loro denominazione. In effetti Mendel non formulò alcuna legge, ma i suoi risultati sono più agevolmente esprimibili e riassumibili sotto forma di enunciati.
Inoltre, nell’enunciare queste due o tre leggi, la maggior parte dei trattati di genetica è costretta a far uso dei concetti di gene, allele, omozigote ed eterozigote. Si tenga comunque presente che tali concetti erano totalmente estranei a Mendel. Infatti i termini allelomorfo, omozigote ed eterozigote furono introdotti solo nel 1902 da Bateson, mentre il termine gene fu coniato da Johannsen nel 1909.
Mendel si occupò di caratteri che si presentavano nel fenotipo secondo modalità ben distinte che non ammettevano forme intermedie. I risultati ottenuti da Mendel si applicano dunque solo a questo tipo di caratteri, noti come caratteri mendeliani o caratteri discreti o caratteri a variabilità discontinua. Si tenga presente che tali caratteri non sono molto diffusi in natura. La maggior parte dei caratteri sono infatti caratteri a variabilità continua, come l’altezza di un individuo, il colore della pelle etc.
La pianta di pisello (Pisum sativum), su cui lavorò Mendel, risultò particolarmente adatta per questo tipo di esperimenti. È infatti di facile coltivazione, può dare più di una generazione all’anno, presenta parecchi caratteri a variabilità discontinua, ma soprattutto si riproduce per autofecondazione. Il fiore infatti non si schiude finché i gameti maschili (polline) non abbiano fecondato gli ovuli femminili dello stesso fiore (ricordiamo che anche la pianta di pisello, come la maggior parte dei vegetali, è ermafrodita, presenta cioè sia l’apparato riproduttore maschile che quello femminile riuniti in una medesimo individuo).
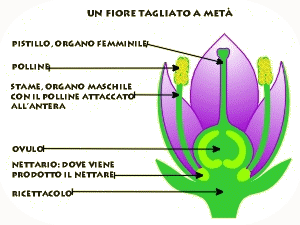
Non potendo dunque ricevere polline da altre piante (fecondazione incrociata), la pianta di pisello non riceverà neppure caratteri diversi da quelli propri. In queste condizioni si osserva che i discendenti di un certo individuo presenteranno sempre i medesimi caratteri, identici a quelli dei genitori. Gli individui di questo tipo costituiscono una linea pura. Per Mendel fu dunque relativamente semplice isolare linee pure che differivano per un carattere ed incrociarle, praticando su di esse la fecondazione artificiale. L’operazione richiede che il fiore venga aperto e ne vengano recisi gli stami contenenti il polline per evitare l’autofecondazione. Successivamente l’organo femminile viene fecondato con il polline proveniente da un’altra pianta. Se si incrociano due linee pure che differiscono per un carattere gli individui che si ottengono non appartengono ovviamente più ad una linea pura e vengono definiti ibridi (monoibridi).
Le ricerche sui piselli impegnarono MENDEL dal 1854 al 1864. In questo periodo egli coltivò e analizzò almeno 28.000 piante della specie Pisum Sativum, prendendo in considerazione sette coppie di caratteri del seme e della pianta quali l’ altezza, la posizione dei fiori, la forma e il colore dei semi.
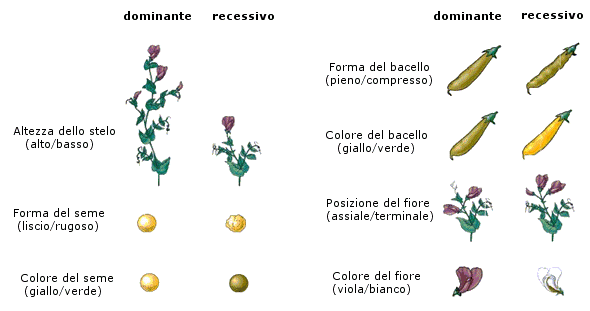
Mendel incrociò fra loro a due a due linee pure che differivano per un carattere (pianta alta x pianta bassa, pianta con semi verdi x pianta con semi gialli, etc.), classificando e contando gli esemplari ottenuti in ciascuna generazione e cercando di individuare l’ esistenza di precisi rapporti matematici tra i diversi individui presenti ad ogni generazione.
I risultati di questi incroci portarono Mendel a conclusioni in netto contrasto con il modello generalmente accettato allora dell’ eredità per rimescolamento, secondo il quale “essenze” di ciascuno dei due genitori, trasmesse attraverso liquidi simili al sangue, contribuivano “mescolandosi” alla formazione dei figli. Mendel avanzò invece l’ipotesi che l’ eredità fosse “particolata”, cioè che i diversi caratteri ereditari fossero portati da strutture biologiche discrete e distinte, unità di eredità (o fattori unitari), anche se a quel tempo non vi erano prove dirette per dimostrarne l’ esistenza, e che noi oggi chiamiamo geni ed alleli.
Egli aveva infatti notato che, incrociando piante di piselli che si differenziavano per singoli caratteri facilmente individuabili, non si ottenevano ibridi con caratteri mescolati, ma la generazione F1 era formata da individui che presentavano sempre il carattere di uno solo dei due genitori. In termini moderni diremo che il carattere che si manifesta è dominante, quello che rimane nascosto è recessivo.
Legge della dominanza
In uno dei suoi esperimenti, Mendel incrociò piante di pisello che da molte generazioni producevano solo fiori violetti con piante che da molte generazioni producevano solo fiori bianchi. Egli usò il polline prodotto da piante a fiori violetti per fecondare piante a fiori bianchi. Fece anche l'operazione inversa, cioè fecondò con polline proveniente da piante a fiori bianchi piante a fiori violetti. Il risultato era sempre il medesimo: in F1 gli ibridi presentavano sempre fiori violetti.
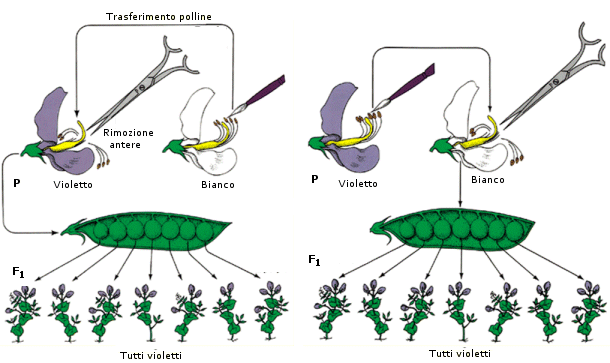
I risultati di questi incroci possono essere riassunti in termini moderni nella legge della dominanza o legge dell’uniformità degli ibridi F1: l’incrocio tra un omozigote dominante (linea pura dominante) ed un omozigote recessivo (linea pura recessiva) genera una generazione F1 di eterozigoti (ibridi) fenotipicamente uguali al genitore dominante.
P Linea pura dominante x Linea pura recessiva
F1 Ibrido dominante
Si tenga presente che una linea pura, presentando un solo tipo di carattere, corrisponde ad un omozigote, mentre un ibrido, in cui si sono uniti i caratteri provenienti da due linee pure, corrisponde ad un eterozigote.
Legge della segregazione
In una successiva serie di esperimenti, Mendel incrociò tra loro gli ibridi F1. In realtà l’incrocio tra gli ibridi F1 non richiede una fecondazione artificiale. Infatti, lasciando che gli ibridi si autofecondino si ottiene un incrocio tra ibridi.
La progenie, seconda generazione filiale (F2) risultò composta per il 75% di individui fenotipicamente dominanti e per il 25% di individui fenotipicamente recessivi (rapporto 3:1). Ricompare il carattere recessivo presente nell’incrocio parentale e scomparso in F1.
Per spiegare i risultati ottenuti Mendel avanzò alcune ipotesi, poi rivelatesi corrette:
- il carattere recessivo, che non si manifesta in F1 in realtà non è scomparso, ma è solo latente (nascosto) negli ibridi F1 (visto che ricompare in F2)
- ogni carattere ereditario è quindi presente in un individuo con due particelle materiali, due fattori (unità di eredità che oggi noi chiamiamo alleli) trasmessi dai genitori ai figli con la riproduzione;
- per giustificare il rapporto 3:1 manifestatosi in F2 è necessario ipotizzare che le due copie di un fattore si separano (disgiunzione o segregazione) durante la riproduzione per poi ricongiungersi casualmente
Oggi noi sappiamo che il concetto di ‘segregazione’ dei due fattori genetici e successiva ricongiunzione casuale ipotizzato da Mendel coincide con i processi meiotici di gametogenesi (in cui si separano gli omologhi e quindi gli alleli da essi portati) e di fecondazione (in cui i gameti si combinano casualmente a formare lo zigote).
La riproduzione sessuale avviene infatti grazie alla formazione di gameti (ovuli e spermatozoi), cellule aploidi che si formano tramite meiosi, un processo in cui i cromosomi omologhi, che ospitano i due alleli di un carattere, si separano. Successivamente, durante la fecondazione, l’unione casuale dei gameti produce la ricongiunzione degli alleli.
Incroci: frequenza e probabilità (il quadrato di Punnett)
Quando si osservano i risultati di un incrocio, si misurano le frequenze con cui compaiono determinati caratteri. Se, ripetendo più volte il medesimo incrocio, le frequenze con cui compaiono certi caratteri si attestano sempre intorno a determinati valori, allora possiamo utilizzare questi valori come una stima della probabilità che quel determinato risultato si verifichi come conseguenza dell’incrocio in questione.
Un esempio servirà a chiarire.
Se lancio 100 volte una moneta in aria potrò ottenere 55 volte ‘testa’ e 45 volte ‘croce’. ‘Testa’ compare con una frequenza del 55%. ‘Croce’ compare con una frequenza del 45%.
Se rifaccio più volte i 100 lanci mi accorgerò che le frequenze con cui compaiono ‘testa’ e ‘croce’ oscillano sempre intorno al 50%, anche se difficilmente saranno esattamente pari al 50%. Posso anche facilmente verificare che le frequenze con cui compaiono i due eventi (Testa e Croce) si avvicineranno tanto più al 50% quanto più alto sarà il numero di lanci.
In effetti la frequenza è una grandezza che si misura ed è il rapporto tra il numero di volte che un determinato evento effettivamente si verifica ed il numero totale di prove effettuate (Frequenza = rapporto tra gli eventi favorevoli osservati e gli eventi totali)
La probabilità è invece una grandezza che si calcola ed è il rapporto tra il numero di eventi favorevoli ed il numero di eventi possibili.
La probabilità che quando lancio una moneta esca ‘testa’ è del 50% (0,5) poiché vi è solo un caso favorevole (solo 1 lato della moneta presenta ‘testa’) mentre 2 sono i casi possibili (due sono le facce della moneta). Ma anche se la probabilità che esca testa è pari allo 0,5 (50%), la frequenza con cui uscirà ‘testa’ se lancio effettivamente la moneta difficilmente sarà sempre del 50%.
Sperimentalmente si osserva tuttavia che la frequenza di un evento si avvicina tanto più al valore calcolato della sua probabilità quanto più elevato è il numero di eventi osservati (è più probabile che la frequenza con cui esce ‘testa’ si avvicini al 50% se effettuo 1000 lanci piuttosto che se ne effettuo 10).
Da questa ultima osservazione scaturisce un’altra definizione di probabilità: la probabilità di un evento è il valore al quale tende la frequenza quando il numero degli eventi osservati tende ad infinito.
Questo in definitiva è anche il motivo per il quale, per stimare la probabilità che da un incrocio si generi un particolare carattere piuttosto che un altro, dobbiamo incrociare un numero molto elevato di individui.
È allora ovvio che quando Mendel lasciò che i monoibridi F1 si incrociassero non ottenne mai esattamente il 75% di individui dominanti ed il 25% di individui recessivi, ma misurò frequenze che oscillavano intorno a questi valori e ne desunse che le probabilità dovevano essere del 75% e del 25%.
È tuttavia possibile, dato un certo incrocio, calcolare le probabilità dei genotipi risultanti senza dover materialmente effettuare l’incrocio.
Per farlo dobbiamo conoscere i genotipi degli individui che si incrociano e simulare gli eventi che portano alla formazione dei nuovi individui: gametogenesi e fecondazione.
Si calcolano quindi le probabilità che durante la gametogenesi gli alleli del carattere in questione si trovino su di un determinato gamete e successivamente si calcolano le probabilità, attraverso un quadrato di Punnett, che i gameti femminili si ‘incontrino’ con i gameti maschili.
Il quadrato di Punnett è una tabella a doppia entrata che serve a simulare tutte le possibili combinazioni dei gameti maschili con quelli femminili (fecondazione) e a calcolare la probabilità dei genotipi che si generano come conseguenza dell’unione dei gameti. I gameti maschili (con le loro probabilità) vengono posti ad un lato del quadrato ed i gameti femminili (con le loro probabilità) vengono posti su di un lato adiacente al precedente. All’interno del quadrato vengono poi effettuate (come nel gioco della battaglia navale) tutte le combinazioni tra le righe e le colonne. Le probabilità dei genotipi che si realizzano non sono altro che la probabilità di un evento composto, cioè la probabilità che due eventi semplici (il gamete maschile e quello femminile) si verifichino contemporaneamente.
La probabilità di un evento composto si calcola come il prodotto delle probabilità degli eventi semplici che concorrono alla sua uscita. Così le probabilità dei genotipi che si formano all’interno del quadrato di Punnett si calcola come prodotto delle probabilità dei singoli gameti che devono combinarsi per dare quel determinato genotipo.
Ad esempio la probabilità che lanciando contemporaneamente un dado ed una moneta esca il numero 5 sul dado e ‘testa’ sulla moneta è pari a 1/6 x 1/2 = 1/12. La probabilità che esca il 6 è infatti 1/6, la probabilità che esca ‘testa’ è 1/2, la probabilità che escano contemporaneamente (evento composto) è 1/12.
Proviamo allora a simulare l’incrocio tra due ibridi F1 a fiori violetti. Si tratta di due eterozigoti con genotipo Pp, (con P = purple, violetto = allele dominante e p = bianco = allele recessivo)
Per prima cosa dobbiamo simulare la gametogenesi (meiosi). Tenendo presente che l’allele dominante P si trova su di un cromosoma e l’allele recessivo p sul suo omologo e che durante la meiosi gli omologhi si separano ordinatamente a metà, avremo metà gameti che contengono l’allele dominanti e metà l’allele recessivo. In termini di probabilità potremo dire che ogni individuo eterozigote che partecipa all’incrocio ha una probabilità del 50% (0,5) di produrre gameti con l’allele dominante e del 50% (0,5) di produrre gameti con l’allele recessivo (si ricordi che la probabilità è teorica. Le frequenze con cui si generano realmente i gameti possono essere diverse, ad esempio per problemi di sopravvivenza degli stessi).
Una volta creati i gameti, li sistemiamo ai due lati del quadrato di Punnett con le loro probabilità. Da un lato i gameti maschili (♂) e dall’altro i gameti femminili (♀).
Ora costruiamo all’interno del quadrato tutte le 4 possibili combinazioni di gameti maschili e femminili. Questi sono i 4 genotipi che possono prodursi dall’incrocio. Ognuno di essi avrà una probabilità di formarsi del 25% (0,5 x 0,5 = 0,25)
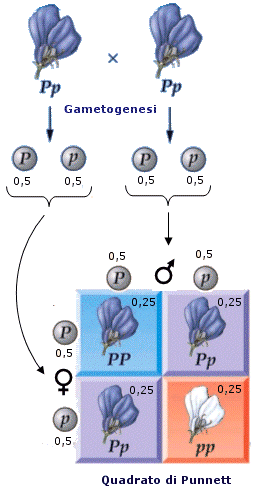
Dall’incrocio di due ibridi si possono formare dunque un 25% di omozigoti dominanti (PP), un 50% di eterozigoti (Pp) ed un 25 % di omozigoti recessivi (pp). Si noti come, essendo gli omozigoti dominanti e gli eterozigoti fenotipicamente uguali, l’incrocio produce un 75% di individui fenotipicamente dominanti ed un 25% di individui recessivi. Lo stesso risultato ottenuto sperimentalmente da Mendel.
I risultati di questa seconda serie di incroci possono dunque essere riassunti in termini moderni nella legge della segregazione o legge della disgiunzione: l’incrocio tra due eterozigoti (ibridi) genera una generazione F2 costituita da un 25% di omozigoti recessivi, da un 50% di eterozigoti e da un 25% di omozigoti dominanti. Il rapporto fenotipico dominanti/recessivi è 3:1
F1 Ibrido x Ibrido
F2 75% dominanti 25% recessivi
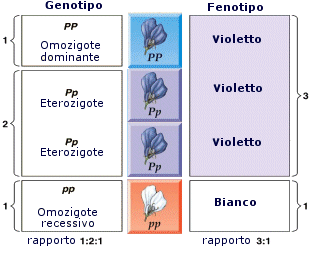
Come abbiamo già anticipato, le leggi di Mendel non sono generali, ma presentano delle eccezioni (dominanza incompleta e codominanza) Non sempre esistono infatti un allele dominante ed uno recessivo per un dato carattere.
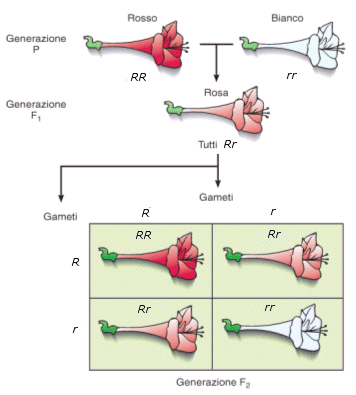 La pianta della bella di notte (Mirabilis jalapa) può avere fiori rossi, bianchi o rosa. Le piante con fiori rossi hanno due copie dell’allele R per il colore rosso dei fiori e sono, quindi, omozigoti dominanti RR. Le piante con fiori bianchi hanno due copie dell’allele r per il colore bianco dei fiori e sono, quindi, omozigoti recessive rr. Le piante con una copia di ciascun allele, cioè gli eterozigoti Rr, hanno fenotipo rosa, intermedio tra i colori prodotti dai due alleli. Questo è un esempio del fenomeno di dominanza incompleta.
La pianta della bella di notte (Mirabilis jalapa) può avere fiori rossi, bianchi o rosa. Le piante con fiori rossi hanno due copie dell’allele R per il colore rosso dei fiori e sono, quindi, omozigoti dominanti RR. Le piante con fiori bianchi hanno due copie dell’allele r per il colore bianco dei fiori e sono, quindi, omozigoti recessive rr. Le piante con una copia di ciascun allele, cioè gli eterozigoti Rr, hanno fenotipo rosa, intermedio tra i colori prodotti dai due alleli. Questo è un esempio del fenomeno di dominanza incompleta.
Reincrociando tra loro gli individui F1, la F2 presenterà tre classi fenotipiche in rapporto 1:2:1 (1/4 a fiore rosso, 2/4 a fiore rosa e 1/4 a fiore bianco) anziché di 3:1.
Reincrocio o Test-cross
Il reincrocio è una pratica della genetica sperimentale usata per determinare il genotipo incognito di una popolazione fenotipicamente dominante, la quale potrebbe essere composta sia da omozigoti dominanti che da eterozigoti.
La popolazione dominante viene incrociata con individui omozigoti recessivi (fenotipo recessivo). Si può dimostrare che la percentuale di eterozigoti presenti nella popolazione da testare è sempre il doppio della percentuale di recessivi che si ottengono dal test-cross.
In particolare la percentuale di recessivi che si ottengono dal reincrocio può andare dallo 0% (nessun eterozigote: la popolazione da testare è tutta omozigote dominante) al 50% (la popolazione da testare è tutta eterozigote: il doppio di 50%).
Si prenda ad esempio una popolazione di cavie a pelo nero formata da una frazione X di omozigoti dominanti per il colore del pelo (BB dove B = Black, nero) ed una frazione Y di eterozigoti (Bb) (ovviamente X+Y = 1). Si incrocino ora gli individui con una popolazione di cavie recessiva a pelo marrone formata da omozigoti recessivi (bb)
Simuliamo ora la gametogenesi e calcoliamo le probabilità di formazione dei diversi gameti.
Gli omozigoti dominanti produrranno solo gameti contenenti l’allele B e quindi formeranno una quantità X di gameti B
Gli eterozigoti produrranno metà gameti B e metà gameti b e quindi formeranno una quantità Y/2 di gameti B ed Y/2 di gameti b
Gli omozigoti recessivi produrranno un 100% (e quindi una frazione pari ad 1) di gameti b.
Inserendo ora questi dati nel quadrato di Punnett si osserva che si genera una frazione Y/2 di omozigoti recessivi (bb), esattamente la metà degli Y eterozigoti presenti nella popolazione da testare
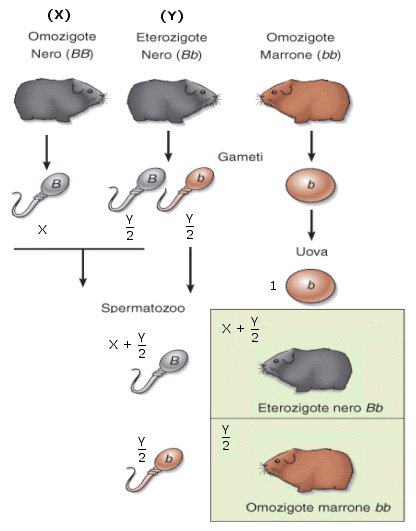
Il reincrocio fu utilizzato da Mendel per determinare la percentuale di omozigoti dominanti e di eterozigoti che costituivano il 75% di individui fenotipicamente dominanti che si presentavano in F2 dall’incrocio di due ibridi.
Se, ad esempio, effettuiamo un reincrocio del 75% di individui dominanti a fiori violetti (una popolazione che sappiamo formata per 2/3 (il 50% di 75%) da eterozigoti Pp ed 1/3 (il 25% di 75%) da omozigoti dominanti PP) con una popolazione recessiva a fiori bianchi, otteniamo tipicamente 1/3 di individui a fiori bianchi (la metà degli eterozigoti presenti nella popolazione da testare).
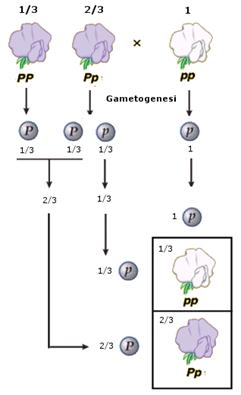
Segregazione ed assortimento indipendente (legge dell’indipendenza)
Quando ebbe chiarito come avveniva la trasmissione di un singolo carattere, Mendel studiò la trasmissione di due caratteri alla volta, sempre effettuando incroci controllati e registrando tutti i risultati ottenuti.
Mendel eseguì un incrocio tra piante di linee pure che differivano contemporaneamente per due caratteri, per esempio forma e colore del seme (una linea pura a seme giallo e liscio ed una linea pura a seme verde e rugoso).
Si trattava di capire se i due caratteri venivano sempre ereditati insieme o se potevano essere trasmessi indipendentemente uno dall’altro. In altre parole, una pianta che presenta i semi gialli dovrà necessariamente ereditare anche il carattere ‘seme liscio’ o potrà presentare anche il carattere ‘seme rugoso’?
La generazione F1 risultò costituita esclusivamente da individui ibridi (diibridi) sia per la forma che per il colore del seme, con semi gialli e lisci. Questo risultato permetteva solo di affermare che la forma liscia è dominante sulla forma rugosa così come il colore giallo è dominante sul colore verde.
Effettuata l'autofecondazione di questi ibridi Mendel ottenne una generazione F2 in cui erano presenti quattro tipi di semi nel rapporto di 9:3:3:1 e precisamente: semi gialli e lisci (9), semi verdi e lisci (3), semi gialli e rugosi (3), semi verdi e rugosi (1).
La comparsa di combinazioni fenotipiche nuove (ricombinanti), non presenti nella generazione parentale (verdi-lisci e gialli-rugosi), con caratteri scambiati, permise a Mendel di affermare che le coppie di caratteri sono indipendenti e la trasmissione ad un discendente di uno o l'altro degli alleli di un carattere non influenza la probabilità di trasmettergli uno o l'altro degli alleli per l'altro carattere.
I risultati di questi incroci vengono solitamente sintetizzati nella legge dell’indipendenza dei caratteri o legge dell’assortimento indipendente: L’incrocio tra due linee pure che differiscono per due caratteri produce una generazione F1 di ibridi per entrambi i caratteri che, incrociati danno una generazione F2 in cui sono presenti tutte le combinazioni fenotipiche nella proporzione 9 D/D : 3 D/R : 3 R/D : 1 R/R (D = fenotipo dominante; R = fenotipo recessivo).
In realtà Mendel aveva studiato un caso particolare. Le coppie di caratteri analizzate da Mendel si trovavano infatti su diverse coppie di omologhi e questo permettavo loro, durante la meiosi di segregare l’una indipendentemente dall’altra (assortimento indipendente).
Se una coppia di caratteri è portata dalla medesima coppia di omologhi, i due alleli appartenenti a caratteri diversi, che si trovano sul medesimo omologo tendono ovviamente ad essere trasmessi insieme. In questo caso i caratteri si dicono associati o linked e, come vedremo, non forniscono in F2 la medesima distribuzione di frequenza (9:3:3:1) travata da Mendel.
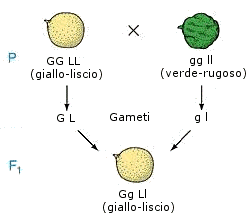 L’incrocio parentale produrrebbe ibridi eterozigoti per entrambi i caratteri sia nel caso di caratteri indipendenti (portati da coppie diverse di omologhi) che per caratteri associati (portati dalla medesima coppia di omologhi) è infatti evidente che l’individuo GG LL (omozigote dominante per entrambi i caratteri) non può produrre che gameti G L, mentre l’individuo gg ll (omozigote recessivo per entrambi i caratteri) non può produrre che gameti g l. Dall’unione di questi due gameti si produrranno necessariamente un 100% di eterozigoti per entrambi i caratteri Gg Ll.
L’incrocio parentale produrrebbe ibridi eterozigoti per entrambi i caratteri sia nel caso di caratteri indipendenti (portati da coppie diverse di omologhi) che per caratteri associati (portati dalla medesima coppia di omologhi) è infatti evidente che l’individuo GG LL (omozigote dominante per entrambi i caratteri) non può produrre che gameti G L, mentre l’individuo gg ll (omozigote recessivo per entrambi i caratteri) non può produrre che gameti g l. Dall’unione di questi due gameti si produrranno necessariamente un 100% di eterozigoti per entrambi i caratteri Gg Ll.
L’incrocio dei diibridi F1 tramite autofecondazione è invece più complesso. Infatti, trattandosi di caratteri indipendenti, il carattere colore del seme è portato da una coppia di omologhi, mentre il carattere forma del seme è portato da un’altra coppia di omologhi. Durante la gametogenesi Il cromosoma che contiene l’allele G ha il 50% di probabilità di segregare in un gamete con il cromosoma che contiene l’allele L e il 50% di probabilità di segregare con il cromosoma che contiene l’allele l. Ovviamente questo vale anche per l’altro omologo, che contiene l’allele g. In questo modo, l’assortimento indipendente degli omologhi genera 4 tipi di gameti: GL, Gl, gL, gl, ciascuno con una probabilità del 25% (1/4).
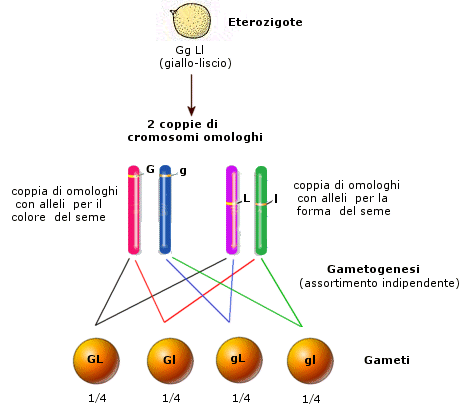
Se ora sistemiamo questi 4 tipi di gameti in un quadrato di Punnett, possiamo ottenere tutti i genotipi possibili.
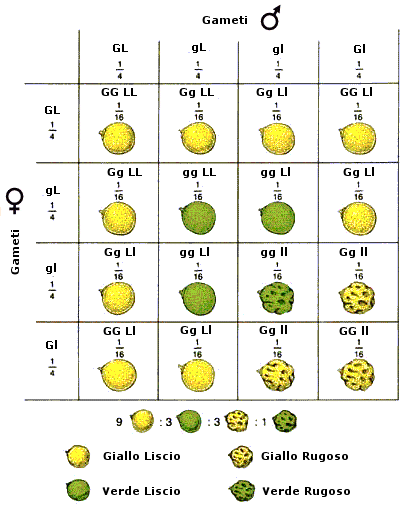
In effetti i due caratteri vengono trasmessi come fossero due cararatteri singoli e obbediscono pertanto alla seconda legge di Mendel (legge della segregazione). Per ognuno di essi ritroviamo infatti una distribuzione 3:1 (75% di dominanti e 25% di recessivi) tipica dell’incrocio di un monoibridi. La distribuzione 9:3:3:1 di un di ibrido nasconde due distribuzioni 3:1 di due monoibridi.
Infatti se prendiamo in considerazione il primo carattere (colore del seme), su 16 individui, 12 sono dominanti (gialli) e 4 sono recessivi (verdi), con un rapporto fenotipico di 12:4 = 3:1.
Se invece prendiamo in considerazione il secondo carattere (forma del seme), su 16 individui, 12 sono dominanti (lisci) e 4 sono recessivi (rugosi), con un rapporto fenotipico di 12:4 = 3:1

Vediamo ora cosa ci saremmo dovuti attendere se i due caratteri fossero stati associati, se fossero stati cioè ospitati sulla medesima coppia di omologhi. In questo caso, per un generico diibrido AaBb, si sarebbero potuti formare solo due tipi di gameti (e non 4 come nel caso di caratteri indipendenti). I due caratteri si sarebbero comportati come un unico carattere, generando una distribuizione 3:1, con il 75% di individui dominanti (di cui il 50% di eterozigoti AaBb per entrambi i caratteri ed il 25% di omozigoti dominanti AABB per entrambi i caratteri) ed il 25% recessivi. Non sarebbero ovviamente comparsi i fenotipi con i caratteri scambiati (D/R e R/D) tipici dei caratteri indipendenti.
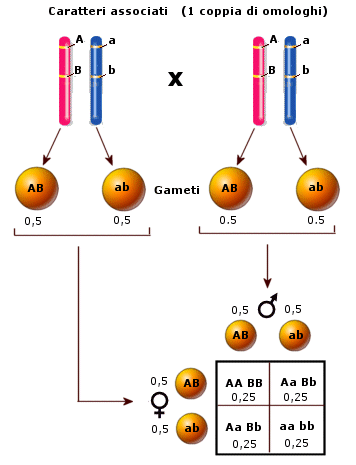
E’ possibile verificare se due caratteri sono indipendenti o associati anche reincrociando i diibridi F1 con individui omozigoti recessivi per entrambi i caratteri.
- se i caratteri sono indipendenti il diibrido genera 4 tipi di gameti con egual probabilità (1/4) e dal reincrocio si ottengono sia le combinazioni fenotipiche parentali (D/D e R/R) che quelle ricombinanti (D/R e R/D) con egual probabilità (25% ciascuna)
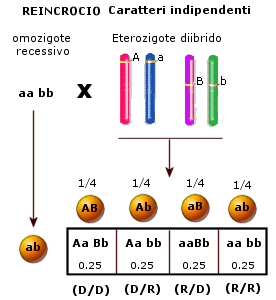
- se i caratteri sono associati il diibrido genera solo 2 tipi di gameti con egual probabilità (1/2) e dal reincrocio si ottengono solo le combinazioni fenotipiche parentali (50% D/D e 50% R/R)
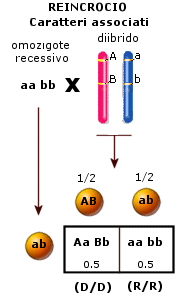
Vedremo tuttavia che questa previsione teorica non sempre viene rispettata poiché anche i caratteri associati possono in qualche misura ricombinarsi come conseguenza del processo di crossing-over che avviene durante la meiosi e possono pertanto produrre piccole percentuali di individui ricombinanti.
Si tenga presente che in molti testi di genetica le prime due leggi di Mendel (Legge della dominanza e legge della segregazione) sono riunite in un unico enunciato e che, in questo caso la terza legge di Mendel (legge dell’assortimento indipendente) diventa la seconda.
Morgan: l’associazione di geni ed il crossing-over
L’importanza dell’analisi mendeliana dell’ereditarietà sta nel fatto che le leggi della segregazione e dell’assortimento indipendente dei fattori genetici (alleli) possono essere formulate anche senza sapere qual è la loro natura fisica e quali sono le strutture cellulari che li ospitano. I primi a rendersi conto che vi era uno stretto parallelismo tra il comportamento dei fattori genetici mendeliani ed i cromosomi furono nel 1902 lo statunitense Walter Sutton ed il tedesco Theodor Boveri. I cromosomi omologhi sono infatti due come i fattori genetici mendeliani, si separano durante la meiosi nei gameti (segregazione dei fattori genetici) ed i gameti si ricombinano casualmente durante la fecondazione. L’ipotesi che le due forme alleliche di un gene fossero portate dai cromosomi omologhi è nota come teoria cromosomica dell’ereditarietà.
La teoria cromosomica dell’ereditarietà venne confermata pochi anni dopo dal lavoro sperimentale dello statunitense T.H.Morgan e dai suoi collaboratori
Tra il 1910 ed il 1920 Thomas H.Morgan (1866 – 1945) condusse un’importante serie di esperimenti sul moscerino della frutta (Drosophila melanogaster). L’insetto si riproduce rapidamente (circa 15 giorni), genera molti discendenti, si alleva facilmente e possiede solo 4 coppie di cromosomi. I ricercatori del gruppo di Morgan sottoposero a diversi agenti mutageni i moscerini al fine di indurre la comparsa di nuovi caratteri ed incrociarono i mutanti con le varietà selvatiche, verificando le leggi dell’ereditarietà mendeliana.
A differenza del pisum sativum usato da Mendel, la Drosophila non è autofecondante e quindi per ottenere linee pure (individui omozigoti per un determinato carattere) è necessario selezionarli. In altre parole è necessario incrociare tra loro individui che presentano il carattere da selezionare, scartando ad ogni generazione gli individui che manifestano caratteri differenti fino a quando si ottengono, per più generazioni, solo individui che presentano il carattere desiderato.
I risultati degli incroci dimostrarono che non sempre gli alleli di due geni differenti segregano in modo indipendente, come aveva evidenziato Mendel. Gli alleli segregano in modo indipendente solo se i geni sono posti su coppie differenti di cromosomi omologhi. Se i due geni si trovano invece sulla stessa coppia di omologhi i loro alleli, in prima approssimazione, non possono segregare in modo indipendente. I geni che tendono a rimanere insieme, perché posti sulla stessa coppia di omologhi, si dicono appartenenti allo stesso gruppo di associazione. Il numero dei gruppi di associazione corrisponde al numero delle coppie di cromosomi omologhi.
Morgan e il suo gruppo scoprirono tuttavia che tale associazione è raramente assoluta. Le combinazioni di caratteri presenti nei genitori possono, infatti, rimescolarsi nella discendenza.
In uno dei suoi esperimenti Morgan incrociò una linea pura selvatica a Corpo grigio ed ali normali con una linea pura mutante a corpo nero ed ali atrofiche (o vestigiali). In F1 ottenne tutti ibridi a corpo grigio ed ali normali. Il colore grigio (allele G) è dominante sul colore nero (allele g) , le ali normali (allele N) sono dominanti sulle ali atrofiche (allele n).
Successivamente Morgan reincrociò i diibridi F1 con individui recessivi a corpo nero ed ali atrofiche. Ricordiamo che in questo caso i due caratteri sono associati se si ottiene una progenie con solo i fenotipi parentali (D/D e R/R) in egual proporzione, mentre i due caratteri sono indipendenti se oltre ai fenotipi parentali si ottengono in egual proporzione anche i fenotipi ricombinanti (D/R e R/D).
In F2 Morgan ottenne invece una situazione intermedia rispetto a quelle attese. Ottenne infatti tutte le combinazioni fenotipiche (D/D, D/R, R/D, R/R), ma non nella proporzione 1:1:1:1 tipica dei caratteri indipendenti. Ottenne infatti l’80% circa di individui con fenotipo parentale (D/D e R/R) ed il 20% circa di individui con fenotipo ricombinante (D/R e R/D).
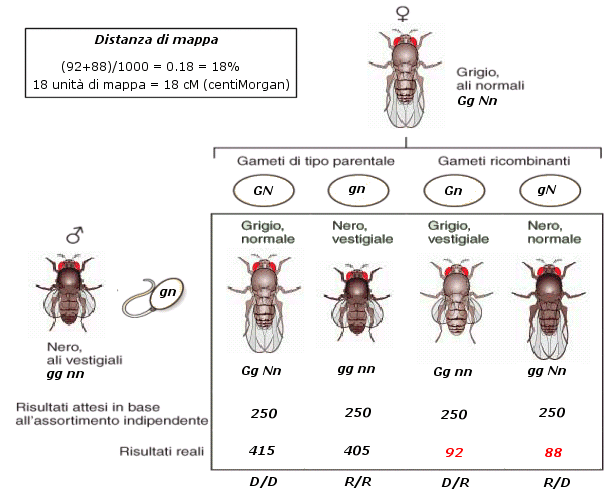
Morgan ipotizzò correttamente che i due caratteri fossero associati, ma che durante la meiosi avvenisse uno scambio fisico di materiale genetico tra le coppie di cromosomi omologhi, chiamato crossing-over (quando avviene, il crossing-over può essere osservato al microscopio, perché i cromosomi omologhi appaiati sono congiunti e assumono una struttura a X con formazione di chiasmi).
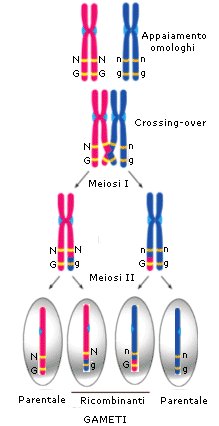
Mappe cromosomiche
Morgan notò infine che prendendo in considerazione diverse coppie di caratteri associati, la percentuale di individui ricombinanti è diversa per ogni coppia di caratteri, ma caratteristica e costante per ciascuna coppia. Egli giustificò il fenomeno ipotizzando che il crossing-over sia un evento casuale che può avvenire con la stessa probabilità in un punto qualsiasi, lungo tutta la lunghezza del cromosoma. Di conseguenza la frequenza della ricombinazione tra due geni dipende dalla loro distanza sul cromosoma. Se i geni sono relativamente lontani vi è una maggior probabilità che il crossing-over interessi il tratto di cromosoma che li separa ed i gameti ricombinanti saranno di conseguenza frequenti, mentre se i geni sono più vicini è meno probabile che il crossing-over interessi il breve tratto di cromosoma che li separa ed i gameti ricombinanti saranno rari.
Dalla frequenza di ricombinazione tra due o più geni diversi, misurata in esperimenti di incrocio opportunamente progettati, è possibile dedurre quindi la distanza che intercorre tra loro su ciascun cromosoma e costruire così delle mappe cromosomiche o mappe genetiche. Il posto di un carattere nella mappa genetica si chiama locus (plur. loci).
La distanza tra due geni associati si misura in Unità di mappa o centimorgan (cM).
Per definizione due geni associati distano 1 cM quando si genera 1 gamete ricombinante ogni 100 gameti (1 ogni 25 meiosi). Normalmente si usa far coincidere la distanza in centimorgan con la percentuale di ricombinazione (1 cM = 1% di ricombinazione).
La distanza di mappa è quindi uguale alla frequenza di ricombinazione scritta come percentuale.
Le percentuali di ricombinazione possono essere utilizzate per individuare le posizioni relative dei geni all’interno dei cromosomi. Così se il gene A e B presentano una frequenza di ricombinazione del 5% (5 unità di mappa), il gene B e C del 3% (3 unità di mappa) ed il gene A e C dell’8% (8 unità di mappa), è evidente che il gene B si trova tra A e C.
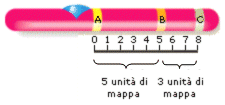
La misura sperimentale della frequenza di ricombinazione è più semplice se si reincrociano, come abbiamo appena visto, i diibridi F1 con gli omozigoti recessivi. In questo modo, poiché l’omozigote recessivo non ha effetti sul processo di ricombinazione presentando tutti alleli recessivi, le frequenze dei genotipi ricombinanti che si ottengono dall’incrocio dipendono solo dal diibrido e sono esattamente uguali alle frequenze con cui ricombinano i gameti del diibrido, frequenze che vogliamo appunto misurare.
La misura sperimentale della frequenza di ricombinazione incrociando due diibridi è comunque possibile anche se risulta più complessa.
Se chiamiamo p la probabilità che il diibrido formi gameti parentali (AB e ab) e q la probabilità che il diibrido formi gameti ricombinanti (Ab e aB), allora la probabilità di ricombinazione dei gameti che vogliamo calcolare sarà pari a 2q.
Tenendo ora presente che incrociando i diibridi il quadrato di Punnett ci fornisce i seguenti risultati
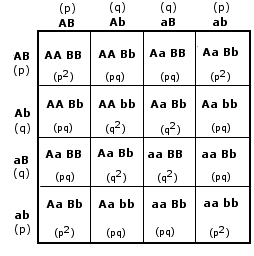
Ricordando inoltre che gli omozigoti recessivi (aa bb) sono gli unici individui che presentano un fenotipo differente da tutti gli altri e sono quindi facilmente individuabili, possiamo misurarne la frequenza p2. Estraendone poi la radice quadrata possiamo calcolare la frequenza p con cui si formano i gameti ab e AB. Ma poiché la somma di tutte le frequenze di formazione dei gameti deve dare l’unità (p + p + q + q = 2p + 2q = 1), possiamo calcolare la frequenza di ricombinazione 2q sottraendo 2p all’unità
2q = 1 - 2p
Ad esempio, incrociando i diibridi F1 di Drosofila con corpo grigio ed ali normali, avremmo ottenuto in F2 un 16.8 % (frequenza = 0,168) di individui, recessivi per entrambi i caratteri, a corpo nero ed ali atrofiche. Si ha quindi p2 = 0,168 e dunque p = 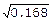 = 0.41.
= 0.41.
La frequenza di ricombinazione è allora 2q = 1 - 2p = 1 – 2(0.41) = 1 – 0.82 = 0.18 pari al 18%
Determinazione genetica del sesso
Nella specie umana esistono 23 coppie di cromosomi. 22 sono formate da cromosomi uguali (autosomi) e una coppia dai cromosomi sessuali. Le femmine possiedono due cromosomi sessuali uguali (due cromosomi X), mentre i maschi hanno due cromosomi sessuali diversi (un cromosoma X ed un cromosoma Y). Possiamo dunque indicare i due sessi come XX (femmina) e XY (maschio). Nella cavalletta e in altri insetti non c’è il cromosoma Y. In questo caso le femmine sono XX e i maschi X0 dove 0 indica l’assenza di un cromosoma. Nelle specie in cui il maschio è XY o X0 il sesso maschile è detto eterogametico mentre il sesso femminile è detto omogametico. Non in tutte le specie, tuttavia, il sesso maschile è eterogametico e il femminile omogametico. Negli uccelli e nelle farfalle il sesso eterogametico è quello femminile.
Al momento della formazione dei gameti la coppia di cromosomi sessuali si separa e in ciascun gamete va un solo cromosoma.
Nella specie umana, le femmine producono solo gameti contenenti un cromosoma X, mentre i maschi producono il 50% di gameti con il cromosoma X ed il 50% con il cromosoma Y. Il sesso viene determinato dai gameti maschili, in quanto solo questi hanno i due cromosomi sessuali diversi (X e Y) Il sesso di un individuo dipenderà allora da quale dei due cromosomi sessuali è contenuto nello spermatozoo al momento della fecondazione. L’unione di un uovo, che contiene sempre un cromosoma X con uno spermatozoo con cromosoma X produrrà uno zigote dal quale si svilupperà un individuo di sesso femminile. L’unione di un uovo con no spermatozoo con cromosoma Y produrrà uno zigote XY dal quale si svilupperà un individuo di sesso maschile.
L’ eredità del sesso, nell’ uomo, si comporta, quindi, come un classico carattere mendeliano, per cui la probabilità di ottenere maschi o femmine si può calcolare con un quadrato di Punnett ed è del 50%.
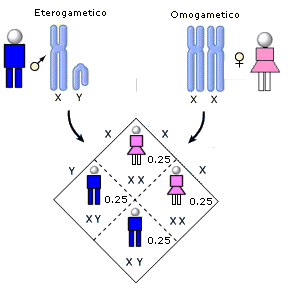
In realtà le cose vanno un po’ diversamente. Analisi condotte su alcune popolazioni umane hanno rivelato che alla nascita è presente una eccedenza di maschi (105/106 maschi ogni 100 femmine). L’ origine di tale sproporzione non è nota, tuttavia questo “vantaggio” viene poi riassorbito per la più alta mortalità che colpisce il sesso maschile.
Il primo punto critico per i maschi è tra i 15 e i 25 anni, quando lavoro, sport e spostamenti sulle strade provocano numerosi incidenti mortali che riducono il vantaggio iniziale.
Un secondo punto critico si ha tra i 50 e i 60 anni perché sia i tumori, sia le malattie dell’ apparato cardiovascolare sono più frequenti nei maschi che nelle femmine.
Di fatto, il traguardo dei 60 anni viene raggiunto dall’ 82,9% dei maschi contro il 91,5% delle femmine.
Eredità legata al sesso
Nell’uomo molti caratteri non sessuali (che non determinano il sesso dell’individuo e le sue caratteristiche sessuali) sono controllati da geni localizzati sui cromosomi sessuali. Tali caratteri si dicono caratteri legati al sesso (sex linked).
Il cromosoma Y è approssimativamente lungo un terzo del cromosoma X quindi la maggior parte dei geni del cromosoma X non hanno il loro corrispondente nel cromosoma Y. Si stima che il cromosoma Y contenga una trentina di geni contro i 1000-1500 del cromosoma X.
Le estremità di entrambi i cromosomi sono le uniche che si appaiano durante la meiosi e che possono ricombinarsi subendo il crossing-over. Tali brevi tratti sono detti regioni pseudoautosomiche o PAR (pseudoautosomal region). La regione mediana del cromosoma X è detta porzione non-pseudoautosomica X (NPX non-pseudoautosomal portion X), mentre la porzione intermedia del cromosoma Y è detta porzione maschiospecifica Y (MSY malespecific
portion Y).
Queste due porzioni non subiscono ricombinazioni durante la meiosi e contengono alcuni alleli che non hanno il loro corrispondente nell’altro cromosoma. I caratteri portati nel cromosoma X che non trovano l’equivalente nel cromosoma Y sono detti X-linked. I caratteri portati nel cromosoma Y che non trovano l’equivalente nel cromosoma X sono detti Y-linked. Si tratta in entrambi i casi di caratteri non sessuali, noti come caratteri legati al sesso o sex-linked, portati in forma aploide e per questo detti anche caratteri emizigoti.
I caratteri Y-linked sono molto rari (il cromosoma Y è piccolo e porta pochi caratteri). Più importante è l’eredità X-linked, anche perché tra i caratteri X-linked ve ne sono alcuni responsabili di importanti malattie ereditarie.
Nella specie umana si conoscono, attualmente, circa 20 geni posti sul cromosoma X ed assenti nel cromosoma Y, responsabili di alterazioni legate al sesso, tra cui le più note sono il daltonismo e l’ emofilia.
Il daltonismo consiste nell’ incapacità di distinguere alcuni colori (tipicamente rosso e verde). Il termine daltonismo deriva dal nome del chimico e fisico inglese John Dalton, che studiò su se stesso questo difetto. L’ emofilia è un insieme di gravi anomalie responsabili di un forte ritardo nella coagulazione del sangue che provocano una relativa facilità alle emorragie, spesso inarrestabili. Anche una lieve ferita cutanea può così risultare fatale all’emofiliaco.
Entrambi questi difetti genetici sono portati da un allele recessivo che si trova solo sul cromosoma X. Nelle femmine l'effetto recessivo di un allele X-linked portatore di difetti genetici può essere mascherato dall'allele dominante sano situato sull'altro cromosoma X. Nei maschi, invece, gli alleli X-linked recessivi possono manifestare i loro effetti perché non è presente un altro cromosoma X con geni dominanti che li mascherino e sul cromosoma Y manca l’allele.
Queste malattie si manifestano quindi quasi esclusivamente nei maschi, mentre le femmine sono in genere portatrici sane (eterozigoti). Vedremo che la tipica trasmissione ereditaria di queste malattie genetiche è per via materna, da madre portatrice sana a figlio maschio. I maschi malati generano invece femmine portatrici sane che a loro volta possono generare maschi malati con una trasmissione a “zigzag” tipica dei caratteri X-linked.
Prendiamo ad esempio l’emofilia causata da un gene recessivo (e) legato al sesso e portato dal cromosoma X (con E allele dominante sano).
Una femmina può presentare tre genotipi:
Genotipo |
Fenotipo |
XEXE omozigote dominante |
sana |
XEXe eterozigote |
Portatrice sana |
XeXe omozigote recessivo |
Malata |
Anche se, come abbiamo già detto, le donne malate sono rarissime
Un maschio che porta il carattere in emizigosi e non possiede l’allele sul cromosoma Y può presentare solo due genotipi:
Genotipo |
Fenotipo |
XEY0 omozigote dominante |
sano |
XeY0 eterozigote |
Malato |
Vediamo ora quali sono gli incroci che possono avvenire.
Femmina sana x Maschio malato
XEXE XeY0
♂ ♀ |
Xe |
Y0 |
XE |
XEXe
|
XEY0
|
XE |
XEXe |
XEY0 |
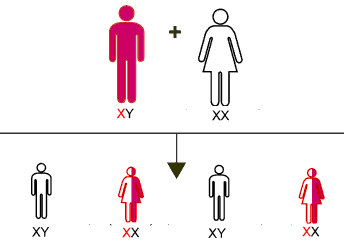
Se nasce una femmina sarà sicuramente portatrice sana (riceve il cromosoma Xe malato dal padre). Se nasce un maschio sarà sicuramente sano (i maschi non possono mai ricevere un difetto X-linked dal padre poiché dal padre ricevono sempre il cromosoma Y che non presenta il difetto genetico). Dunque i maschi malati trasmettono la malattia in forma latente alle figlie portatrici sane.
Femmina portatrice x Maschio sano
XEXe XEY0
♂ ♀ |
XE |
Y0 |
XE |
XEXE
|
XEY0
|
Xe |
XEXe |
XeY0 |

Se nasce una femmina avrà il 50% di probabilità di essere sana (se riceve dalla madre l’allele dominante) ed il 50% di probabilità di essere portatrice sana (se riceve dalla madre l’allele recessivo).
Se nasce un maschio avrà il 50% di probabilità di essere sano (se riceve dalla madre l’allele dominante) ed il 50% di probabilità di essere malato (se riceve dalla madre l’allele recessivo). I maschi ereditano dunque la malattia dalla madre portatrice sana (trasmissione per via materna, ma hanno solo 1 probabilità su 2 di nascere malati)
Affinché nascano femmine malate è necessario un improbabile incrocio tra una femmina portatrice sana ed un maschio malato.
Femmina portatrice x Maschio malato
XEXe XeY0
♂ ♀ |
Xe |
Y0 |
XE |
XEXe
|
XEY0
|
Xe |
XeXe |
XeY0 |
Se nasce una femmina avrà il 50% di probabilità di essere portatrice sana (se riceve dalla madre l’allele dominante) ed il 50% di probabilità di essere malata (se riceve dalla madre l’allele recessivo).
Se nasce un maschio avrà il 50% di probabilità di essere sano (se riceve dalla madre l’allele dominante) ed il 50% di probabilità di essere malato (se riceve dalla madre l’allele recessivo).
L’eredità X-linked fu scoperta per la prima volta da Morgan il quale notò che alcuni caratteri di Drosophila venivano ereditati con modalità diverse a seconda che provenissero dal padre o dalla madre. Un esempio classico è quello che riguarda il colore degli occhi bianco o rosso in Drosophila melanogaster che permise tra l’altro a Morgan di dimostrare la teoria cromosomica dell’eredità (il carattere colore degli occhi doveva necessariamente essere portato dai cromosomi sessuali).
Morgan aveva osservato la comparsa di un mutante ad occhi bianchi (allele r) che risultava recessivo rispetto al carattere selvatico ad occhi rossi (allele R).
Incrociando femmine di Drosophila selvatiche ad occhi rossi con maschi mutanti ad occhi bianchi, Morgan ottenne in F1 il 100% di progenie ad occhi rossi.
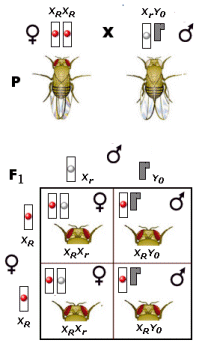
Incrociando gli ibridi F1 Morgan ottenne in F2 3/4 degli individui ad occhi rossi e 1/4 di individui ad occhi bianchi, solo in apparenza ancora in accordo con le regole di Mendel. Infatti mentre le femmine erano tutte ad occhi rossi, i maschi erano per metà ad occhi rossi e per metà ad occhi bianchi.
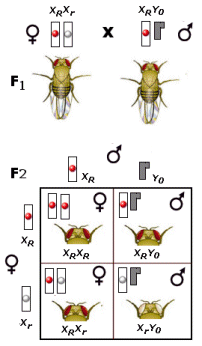
Queste anomalie si potevano spiegare ammettendo che il gene per il colore dell’ occhio fosse localizzato sul cromosoma sessuale X e che sul cromosoma sessuale Y del maschio non vi fosse alcun gene normale corrispondente.
Interazione tra geni
In alcuni casi un gene può interagire con altri geni per controllare la manifestazione di un unico carattere. L’esperimento classico che ha dimostrato l’esistenza di un’interazione tra geni diversi si deve a Bateson e Punnett (1905) in cui vennero incrociati polli che differivano per la forma della cresta (cresta a rosa x cresta a pisello). In F1 si ottennero un 100% di polli con cresta a noce (o Walnut), un fenotipo nuovo. Poteva trattarsi di un semplice caso di codominanza, con la comparsa di un carattere intermedio. Ma incrociando gli ibridi F1 si ottennero polli con 4 tipi di creste, con una distribuzione di frequenza 9:3:3:1 (9 a noce, 3 a rosa, 3 a pisello e 1 con cresta semplice).
La distribuzione 9:3:3:1 suggeriva che il carattere ‘forma della cresta’ fosse controllato non da uno, ma due geni secondo il seguente schema
- L’allele R da solo determina la cresta a rosa ed è dominante su r
- l’allele P da solo determina la cresta a pisello ed è dominante su p
- R e P sono codominanti e la loro presenza congiunta determina la comparsa della cresta a noce
- rrpp determina la comparsa della cresta semplice.
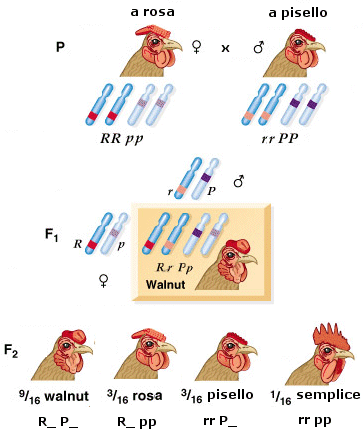
.
Nella scrittura R_ il trattino significa che il genotipo può essere indifferentemente RR o Rr
Nella scrittura P_ il trattino significa che il genotipo può essere indifferentemente PP o Pp.
Sono stati classificati i seguenti tipi di interazioni tra geni: epistasi, soppressione, complementazione e duplicazione genica.
- L’epistasi è un fenomeno di dominanza intergenica, in cui un gene si manifesta “coprendo” la manifestazione di un altro gene che rimane inespresso
- La soppressione è un fenomeno di inibizione intergenica in cui un gene blocca l’allele dominante di un altro gene permettendo l’espressione dell’allele recessivo
- La complementazione è un fenomeno di codominanza intergenica in cui due geni, presenti insieme con una particolare combinazione allelica, producono un fenotipo diverso.
- La duplicazione genica è un fenomeno di interazione in cui due geni identici controllano un medesimo carattere.
Il risultato di queste interazioni porta in genere ad un cambiamento caratteristico nel rapporto fenotipico (rapporti mendeliani atipici) in F2 rispetto a quello atteso in assenza di interazioni (9:3:3:1).
Si tenga presente che la classificazione delle interazioni geniche viene spesso proposta con criteri diversi, generando non poca confusione.
Epistasi
L’epistasi (leggi epìstasi) è un fenomeno di interazione definito per la prima volta dallo stesso Bateson (1909). Bateson descrisse il fenomeno essenzialmente come una estensione del concetto di dominanza al caso di alleli appartenenti a geni diversi. Il termine viene usato ancor oggi in senso stretto per indicare un effetto di copertura o mascheramento degli effetti di un gene detto ipostatico (letteralmente “che sta sotto”) da parte di un altro epistatico (letteralmente “che sta sopra”). Il gene epistatico si manifesta al posto di quello ipostatico. Si tenga tuttavia presente che successivamente il termine epistasi ha allargato il suo significato fino a descrivere in senso lato qualsiasi interazione tra geni diversi che conduca ad una variazione di un unico carattere fenotipico. In molti testi di genetica il termine “interazione epistatica” viene utilizzato come sinonimo di “interazione genica” ad indicare quindi qualsiasi tipo di effetto di un gene su di un altro, contribuendo non poco ad aumentare la confusione su questo argomento.
Noi useremo qui l’accezione più ristretta.
Si riconoscono due tipi di epistasi: dominante e recessiva
Nell’epistasi recessiva l’agente epistatico è un gene in forma omozigote recessiva.
Il rapporto fenotipico caratteristico incrociando i diibridi è 9:3:4
Se ne ha un esempio nel colore del mantello del topo con i due geni aguti ed albino.
Il geneagutipresenta i due alleli
A (dominante) = colore grigio (aguti) a (recessivo) = colore nero
Il genealbinopresenta i due alleli
C (dominante) = cromogeno (presenza di colore) c (recessivo) = assenza di colore
Il genotipo omozigote recessivo cc produce albinismo ed è epistatico verso AA, Aa e aa (ipostatici) mascherandone gli effetti. Se incrociamo due diibridi grigi (aguti) AaCc otteniamo infatti
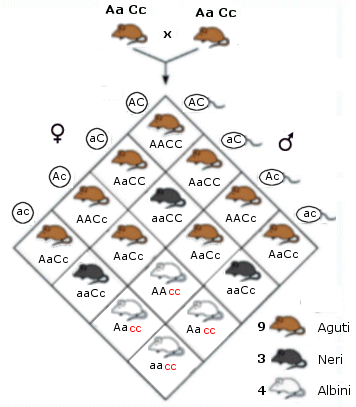
Genotipo |
Fenotipo |
Interazione genica |
9 A_C_ |
aguti |
Il gene dominante C_ (cromogeno) permette al colore aguti (A_) di manifestarsi |
3 A_cc |
bianco |
Il gene epistatico recessivo cc (assenza di colore) si manifesta, mascherando il colore aguti (A_) |
3 aa C_ |
nero |
Il gene dominante C_ (cromogeno) permette al colore grigio (aa) di manifestarsi |
1 aa cc |
bianco |
Il gene epistatico recessivo cc (assenza di colore) si manifesta, mascherando il colore grigio (aa) |
Nell’epistasi dominante il fattore epistatico è un gene dominante anche in singola dose. Affinché si abbia cioè l’effetto di mascheramento è sufficiente la presenza anche di un solo allele dominante.
Il rapporto fenotipico caratteristico incrociando i diibridi è 12:3:1.
Ne abbiamo un esempio nel colore bianco, nero e marrone del mantello delle pecore.
Anche in questo caso abbiamo due geni, uno che esprime per assenza/presenza di colore e l’altro che esprime per il colore nero/marrone. In questo caso l’allele assenza di colore (B = bianco) è dominante ed epistatico .
B (dominante) = assenza di colore, bianco (epistatico) b (recessivo) = presenza di colore
N (dominante) = colore nero n (recessivo) = colore marrone
L’allele B produce il colore bianco (assenza di colore) ed è epistatico verso NN, Nn e nn (ipostatici) mascherandone gli effetti. Il colore nero (genotipi NN ed Nn) e marrone (genotipo nn) si possono manifestare solo in assenza dell’allele B e quindi quando il gene epistatico è in forma omozigote recessiva (bb), Se incrociamo due diibridi bianchi BbNn otteniamo infatti
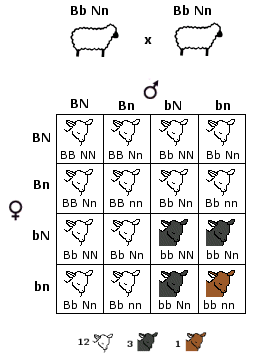
Genotipo |
Fenotipo |
Interazione genica |
9 B_N_ |
bianco |
L’allele B dominante epistatico bianco maschera il colore nero (N_) |
3 B_nn |
bianco |
L’allele B dominante epistatico bianco maschera il colore marrone (nn) |
3 bb N_ |
nero |
Il gene recessivo bb (cromogeno) permette al nero (N_) di manifestarsi |
1 bb nn |
marrone |
Il gene recessivo bb (cromogeno) permette al marrone (nn) di manifestarsi |
Oltre all’epistasi dominante e all’epistasi recessiva, alcuni autori classificano altre tre tipi di epistasi:
- doppia dominante
- doppia recessiva
- doppia dominante-recessiva.
Si tratta di interazioni che possono essere interpretate anche come non epistatiche e di cui parleremo in seguito.
Complementazione
L’interazione di geni complementari (o complementazione) è un fenomeno di interazione fra geni diversi che manifestano la loro azione solo quando sono presenti insieme, generando un fenotipo differente rispetto a quello che generano quando si presentano da soli.
Si riconoscono due tipi di complementazione: dominante e recessiva.
Nell’interazione di geni complementari dominanti (o epistasi doppia recessiva) due geni manifestano un fenotipo diverso quando sono contemporaneamente presenti entrambi almeno con un allele dominante per gene. I rapporti fenotipici caratteristici incrociando i diibridi sono due: 9:7 e 9:6:1.
Un esempio classico di complementazione dominante è quella che abbiamo già analizzato per la forma della cresta dei polli studiata da Bateson e che mantiene il classico rapporto 9:3:3:1, ma con quattro fenotipi differenti.
Genotipo |
Fenotipo |
Interazione genica |
9 R_P_ |
a noce |
La presenza del gene dominante R_ e del gene dominante P_ genera la cresta a noce |
3 R_pp |
a rosa |
La presenza del gene dominante R_ e l’assenza del gene dominante P_ genera la cresta a rosa |
3 rr P_ |
a pisello |
L’assenza del gene dominante R_ e la presenza del gene dominante P_ genera la cresta a pisello |
1 rr pp |
semplice |
L’assenza del gene dominante R_ e del gene dominante P_ genera la cresta semplice |
A Bateson si devono anche gli incroci su Pisello odoroso (Lathyrus odoratus), che esemplificano il rapporto fenotipico 9:7 .
Nel pisello odoroso la contemporanea presenza dell’allele C e P produce fiori violetti, mentre i genotipi C_pp, ccP_, e ccpp sono bianchi.
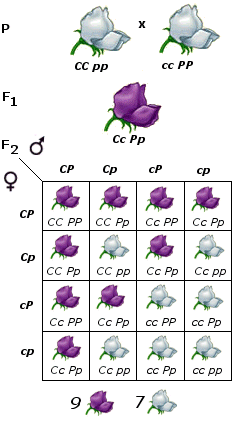
Genotipo |
Fenotipo |
Interazione genica |
9 C_P_ |
Fiori colorati: produzione di antocianina |
Enzimi C e P presenti |
3 C_pp |
Fiori bianchi: assenza di antocianina |
Enzima P assente |
3 ccP_ |
Fiori bianchi: assenza di antocianina |
Enzima C assente |
1 ccpp |
Fiori bianchi: assenza di antocianina |
Enzimi C e P assenti |
La medesima interazione genica legata alla sintesi di antocianina è responsabile anche della colorazione dei semi del mais
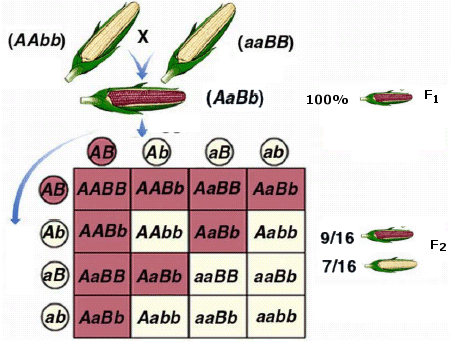
Il fenomeno prende anche il nome di epistasi doppia recessiva poiché ogni volta che è presente uno dei due geni in forma omozigote recessiva non è presente il colore. Si potrebbe dunque interpretare il fenomeno come un’azione epistatica del genotipo cc su P_ e del genotipo pp su P_ In realtà si ammette che la formazione del pigmento richieda la presenza contemporanea dell’allele C e P e si spiega attribuendo ad ognuno dei due geni l'azione di sintesi su elementi di una catena enzimatica che partendo da un composto incolore porta ad uno colorato.

L’azione di geni complementari può manifestarsi anche con un rapporto fenotipico 9:6:1.
Nella zucchina (Cucurbita pepo), ad esempio, la forma è controllata da due geni.
Il gene dominante A_ ed il gene dominante B_, presenti singolarmente, determinano la forma a sfera.
Il gene dominante A_ ed il gene dominante B_, presenti insieme, determinano la forma a disco. Il gene recessivo aa ed il gene recessivo bb, presenti insieme determinano la forma allungata.
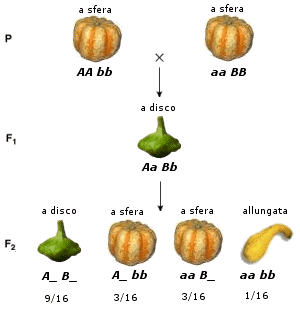
Genotipo |
Fenotipo |
Interazione genica |
9 A_B_ |
Forma a disco |
La presenza del gene dominante A_ e del gene dominante B_ genera la forma a disco |
3 A_bb |
Forma a sfera |
La presenza del gene dominante A_ e l’assenza del gene dominante B_ genera la forma a sfera |
3 aa B_ |
Forma a sfera |
L’assenza del gene dominante A_ e la presenza del gene dominante B_ genera la forma a sfera |
1 aa bb |
Forma allungata |
L’assenza del gene dominante A_ e del gene dominante B_ genera la forma allungata |
Duplicazione genica
La duplicazione genica (o epistasi doppia dominante o interazione di geni complementari recessivi) è un fenomeno di interazione fra geni diversi che si comportano allo stesso modo, producendo la medesima azione (geni duplicati).
Il rapporto fenotipico caratteristico incrociando i diibridi è 15:1.
Il colore della cariosside del frumento, ad esempio, è controllato da due geni duplicati cromogeni che, in forma dominante, manifestano il medesimo effetto inducendo entrambi la comparsa del pigmento.
Si ipotizza che il pigmento venga sintetizzato da un unico precursore grazie alla presenza di un enzima A o un enzima B o entrambi indifferentemente. La cariosside risulterà pertanto colorata se i due geni A e B che codificano per i rispettivi enzimi, si presenteranno, separatamente o contemporaneamente in forma dominante (A_bb, aaB_, A_B_). La cariosside sarà priva di colore solo se i due geni si presenteranno entrambi in forma recessiva (aabb).
Genotipo |
fenotipo |
Attività enzimatica |
9 A_B_ |
Cariosside colorata |
Entrambi gli enzimi funzionali |
3 A_bb |
Cariosside colorata |
Solo enzima A funzionale |
3 aaB_ |
Cariosside colorata |
Solo enzima B funzionale |
1 aabb |
Cariosside priva di colore |
Nessun enzima funzionale |
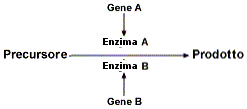
Questo tipo di interazione viene anche interpretata come una interazione di geni complementari recessivi se si considera l’assenza di colore un effetto della compresenza dei due geni allo stato omozigote recessivo (aabb).
Qualche autore la classifica anche come una epistasi doppia dominante poiché il gene dominante A_ può considerarsi epistatico su bb ed il gene dominante B_ può considerarsi epistatico su aa.
Soppressione genica
La soppressione genica è un fenomeno di interazione fra geni diversi in cui un gene in forma dominante (A_), detto gene soppressore, inattiva un altro gene dominante (B_) permettendo al suo eventuale allele recessivo (nel caso sia presente in forma eterozigote Bb) di esprimersi. Si noti la differenza rispetto ad una epistasi dominante in cui il gene epistatico non permette alla forma recessiva dell’altro gene di esprimersi, ma si esprime al suo posto.
Il rapporto fenotipico caratteristico incrociando i diibridi è 13:3.
La sintesi della malvidina nella Primula, ad esempio, è controllata da due geni: un gene dominante K_ che codifica per la sintesi della malvidina ed il gene soppressore dominante D_ che sopprime K e permette, se presente, la manifestazione del suo allele recessivo k (nessuna sintesi di malvidina).
Genotipo |
Fenotipo |
Interazione genica |
9 K_D_ |
Malvidina non sintetizzata |
L’allele D è presente e l’allele k recessivo può esprimersi |
3 K_dd |
Malvidina sintetizzata |
L’allele D è assente e l’allele K dominante può esprimersi |
3 kkD_ |
Malvidina non sintetizzata |
L’allele D è presente e l’allele k recessivo può esprimersi |
1 kkdd |
Malvidina non sintetizzata |
L’allele D è assente e l’allele K dominante potrebbe |
Il rapporto fenotipico 13:3 può essere anche interpretato come una epistasi doppia dominante-recessiva, con il gene dominante A_ del primo locus (epistatico su B_ e bb) che genera lo stesso fenotipo del gene recessivo bb del secondo locus (epistatico su aa) e viceversa
Prendiamo il seguente esempio
Locus 1: A bianco; a colore.
Locus 2: B colore; b bianco.
Genotipo |
Fenotipo |
Interazione genica |
9 A_B_ |
Bianco |
L’allele A è presente ed essendo epistatico su B_ si manifesta |
3 A_bb |
Bianco |
L’allele A è presente ed essendo epistatico su bb si manifesta |
3 aaB_ |
Colorato |
L’allele A è assente ed i geni B_ ed aa si manifestano |
1 aabb |
Bianco |
il gene bb è epistatico su aa e si manifesta |
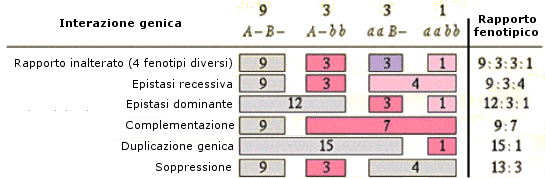
La bontà dell’adattamento: il test del chi-quadrato
Come abbiamo già avuto modo di dire, quando si eseguono degli incroci si osservano delle distribuzioni di frequenza che non coincidono quasi mai con le probabilità attese. La probabilità che ci siano i 9/16 della progenie di un incrocio diibrido che esprimono il fenotipo dominante in un campione di progenie di 16 individui è veramente scarsa. Nei piccoli campioni le fluttuazioni dovute al caso delle frequenze osservate rispetto a quelle attese possono essere molto vistose.
Abbiamo visto come più grande è la dimensione del campione e maggiore è la probabilità che gli effetti del caso producano piccole deviazioni sulle frequenze osservate rispetto a quelle attese. Tuttavia le fluttuazioni casuali delle frequenze sono ineliminabili e pertanto nella pratica sperimentale vi è la necessità di verificare se esiste accordo tra una distribuzione osservata e la corrispondente distribuzione attesa o teorica.
Si tenga inoltre presente che le frequenze osservate potrebbero ‘adattarsi’ a distribuzioni teoriche diverse. Se ad esempio in F2 otteniamo 53 individui con fenotipo A e 14 con fenotipo B, possiamo domandarci se siamo in presenza di un classico rapporto 3:1 con il carattere controllato da un unico gene o di una interazione genica con un rapporto 13:3 (soppressione genica).
È dunque possibile saggiare l’effetto del caso sulle frequenze osservate usando un metodo statistico chiamato test chi-quadrato (o test chi-quadro o test di Pearson).
Il test chi-quadrato valuta se le differenze rispetto al rapporto atteso sono dovute al caso o se sono differenze reali. Il test verifica in definitiva se le frequenze osservate si accordano (adattano) o meno con quelle attese ed è perciò definito un test per la bontà dell’adattamento (goodness of fit).
Il c2 si calcola facendo la sommatoria dei quadrati delle differenze tra le frequenze osservate e quelle attese (teoriche), ciascun quadrato diviso per la frequenza attesa (teorica).

Ad esempio, in uno dei suoi incroci diibridi per il colore e la forma del seme, Mendel ottiene 556 individui di cui:
315 Gialli e lisci 101 Gialli e rugosi 108 Verdi e lisci 32 verdi e rugosi
Le frequenze attese (teoriche) sulla base del rapporto fenotipico 9:3:3:1 sono
Gialli e lisci = 9/16 di 556 = 312,75
Gialli e rugosi = 3/16 di 556 = 104,25
Verdi e lisci = 3/16 di 556 = 104,25
Verdi e rugosi = 1/16 di 556 = 34,75
Calcoliamo c2

E’ ovvio come piccole differenze tra frequenze osservate ed attese possano essere ritenute accidentali e quindi non siano tali da negare un sostanziale accordo tra osservato ed atteso, mentre differenze grandi lascino supporre che non siano state ottenute per caso, ma che siano presenti fattori differenti da quelli ipotizzati. Dunque valori elevati di c2 indicano grandi differenze tra valori osservati e valori attesi e sono un indizio di una distribuzione realmente diversa da quella attesa.
Il problema ora è decidere quando il valore di c2 calcolato è talmente grande da farci rifiutare la sostanziale identità tra la distribuzione osservata e quella attesa.
L’ipotesi che le differenze osservate siano dovute a semplici fluttuazioni casuali e che siano talmente piccole rispetto alle frequenze attese, da essere trascurabili è nota come ipotesi nulla e viene indicata con H0. L’ipotesi alternativa, che le differenze siano significative e che quindi la distribuzione osservata sia realmente diversa da quella attesa, viene indicata con H1.
Dobbiamo allora valutare se il valore calcolato di c2 sia abbastanza piccolo da farci accettare l’ipotesi nulla: le variazioni sono casuali e trascurabili e la distribuzione osservata si accorda con quella teorica.
Il problema è che i valori di c2 dipendono dai gradi di libertà considerati e sono tanto più elevati quanto più numerosi sono i gradi di libertà.
I gradi di libertà (df = degrees of freedom) esprimono il numero di dati effettivamente disponibili per valutare la quantità d'informazione ottenuta. Infatti quando un dato non è indipendente, l'informazione che esso fornisce è già contenuta implicitamente negli altri ed è possibile effettuare i calcoli utilizzando soltanto il numero di osservazioni indipendenti (che rappresentano appunto i gradi di libertà). In generale i gradi di libertà sono pari al numero di classi studiate meno uno.
Nell’esempio precedente i gradi di libertà sono pari a 3 (4 classi osservate (4 fenotipi) meno 1).
Infatti, conoscendo il numero totale di individui ottenuti dall’incrocio (536) ed il numero di individui che costituiscono tre dei quattro fenotipi (osservazioni indipendenti), il numero di individui che costituiscono il quarto fenotipo resta univocamente determinato (individui totali meno individui dei primi tre fenotipi).
I valori di c2 si distribuiscono dunque in funzione del numero dei gradi di libertà. Si vedano ad esempio le seguenti due curve che rappresentano la distribuzione di frequenza di c2 per 4 e 10 gradi di libertà (in ascissa i valori di c2 ed in ordinata la probabilità che c2 assuma quel particolare valore).

Per valutare dunque il valore calcolato di c2 dobbiamo confrontarlo con i valori che esso può assumere, dato un certo numero di gradi di libertà. Presa dunque in considerazione la curva di c2 relativa al numero di gradi di libertà che stiamo considerando, possiamo verificare che il valore di c2 calcolato non cada nella parte finale della curva (coda) dove sono presenti valori troppo elevati. In genere si divide la curva in due regioni: quella a sinistra (regione di accettanza) con una probabilità del 95% che c2 cada al suo interno e quella a destra (regione di rifiuto) con una probabilità del 5% che c2 cada al suo interno.
Il valore di c2 che separa queste due regioni è detto valore critico a.

In pratica non è necessario utilizzare queste curve. È sufficiente consultare delle tabelle che contengono i valori critici (normalmente per il 5%) di c2 per i diversi gradi di libertà e confrontare il valore di c2 calcolato con il valore critico. Se il valore di c2 calcolato è inferiore al valore critico (cade nella regione di accettanza), allora possiamo considerarlo abbastanza piccolo da accettare l’ipotesi nulla.
gradi di libertà |
Valori critici (a) |
||
10% |
5% |
1% |
|
1 |
2.71 |
3.84 |
6.63 |
2 |
4.61 |
5.99 |
9.21 |
3 |
6.25 |
7.81 |
11.34 |
4 |
7.78 |
9.49 |
13.28 |
5 |
9.24 |
11.07 |
15.00 |
Dunque, se ora confrontiamo il valore di c2 che abbiamo calcolato nell’esempio precedente (c2 = 0,47) con il valore critico per il 5% di probabilità e per 3 gradi di libertà (7,81) troviamo che il c2 calcolato è inferiore al valore critico (0,47 < 7,81) . Possiamo accettare l’ipotesi nulla ed affermare che le frequenze osservate rappresentano una distribuzione 9:3:3:1 a meno di fluttuazioni da ritenersi casuali.
Penetranza ed espressività
Non sempre un carattere mendeliano si presenta con rapporti fenotipici caratteristici (tipici o atipici). In alcuni casi le interazioni geniche e quelle ambientali agiscono in modo imprevisto e non ancora chiarito. I concetti di penetranza ed espressività cercano allora di descrivere e quantificare gli effetti dell’ambiente e di altri geni sui caratteri ereditari, che non siamo in grado di imputare direttamente ad una causa specifica.
La penetranza indica in quale percentuale un certo genotipo esprime, in seno ad una popolazione, il suo fenotipo caratteristico. La penetranza è completa (100%) quando il fenotipo si esprime ogni volta che è presente il corrispondente genotipo. La penetranza è incompleta o ridotta quando il fenotipo si esprime solo in una frazione degli individui portatori del genotipo.
Ad esempio, in alcune malattie genetiche la penetranza incompleta di un carattere si manifesta con una proporzione di figli affetti minore di quella attesa dalle proporzioni mendeliane. La sindrome dell’X Fragile ha ad esempio una penetranza del 80% (8 individui su 10 con il genotipo della malattia esprimono il fenotipo).
L’espressività indica l’intensità della manifestazione fenotipica di un dato gene, considerata rispetto al fenotipo normale e misurata in termini qualitativi o quantitativi. L'espressività di un gene dipende da numerosi fattori, tra cui l'età ed il sesso del soggetto, gli effetti ambientali e quelli dovuti all'espressione di altri geni. Ad esempio certe malattie genetiche, come la sindrome dell’X Fragile, possono manifestarsi in individui diversi in forma più o meno grave e presentano dunque una espressività variabile.
Pleiotropia
La pleiotropia è il fenomeno per il quale un unico gene controlla più di un carattere all’interno del medesimo individuo. I caratteri controllati da un gene pleiotropico risultano tra loro strettamente correlati.
Nella maggior parte dei casi il gene pleiotropico codifica per una proteina enzimatica che sta a monte di diverse vie metaboliche o per una proteina strutturale che viene utilizzata nella costruzione di tessuti ed organi diversi.
Un interessante esempio di pleiotropia è fornito da un gene dominante epistatico W_ che nei gatti determina il colore bianco del mantello, occhi blu e sordità. Il gene W_ è epistatico su tutti gli altri geni che controllano il colore del mantello. Alcuni gatti bianchi hanno un occhio blu ed uno giallo-arancio. In questo caso sono sordi soltanto dall’orecchio che si trova dalla stessa parte dell’occhio blu.
La melanina, il pigmento che determina la colorazione del mantello è prodotta da cellule note come melanociti. La coclea dell’orecchio contiene una fascia di melanociti che funge da mediatore per la trasmissione dell’impulso nervoso sonoro al cervello.
Si tenga tuttavia presente che il colore bianco dei gatti può essere prodotto geneticamente in tre modi diversi. Può essere bianco (W_), albino (cc) o macchiato (S_, spotted) con una grande macchia bianca che copre tutto il corpo. I gatti albini hanno però occhi e pelle rosa
Fonte: http://rexmagister.altervista.org/downloads/BiologiaDOC.zip
sito web: http://rodomontano.altervista.org/biologia.php
Autore del testo: Rodomontano
Biologia appunti parte 3
Visita la nostra pagina principale
Biologia appunti parte 3
Termini d' uso e privacy