Calore e termochimica
Calore e termochimica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Calore e termochimica
Calore
Consideriamo il primo principio in forma differenziale
dU = dq + dw
Nel lavoro infinitesimo dw è compreso ogni tipo di lavoro: d’espansione, elettrico o altro. Il tipo di lavoro più comune che si incontra in chimica è il lavoro d’espansione. Quando, ad esempio, vi è sviluppo o consumo di gas in una reazione chimica, o più semplicemente quando il calore prodotto da una reazione porta ad un cambiamento di volume del sistema. Per questo motivo, se non è specificato, il lavoro viene considerato solo lavoro di espansione.
Ricordatevi che non necessariamente un sistema in espansione è nella fase gassosa. I liquidi e i solidi modificano il loro volume al variare di pressione e temperatura, anche se molto meno dei gas; tanto è vero che volendo aprire un barattolo di vetro con il tappo di metallo che non ne vuole sapere di aprirsi, si mette sotto l’acqua bollente, e si aspetta che il tappo di metallo si espanda, più di quanto si espanda il vetro.
Supponiamo che il sistema non compia lavoro: ne consegue che
dU = dq
e per un cambiamento finito
DU = q
Potete notare che non ho scritto Dq ma semplicemente q, per rimarcare che il calore, in generale, non è una funzione di stato per cui è privo di senso considerare una differenza di calore tra uno stato iniziale e uno stato finale. Possiamo solo parlare di calore trasferito durante tutto il processo.
Questa equazione ci mostra una via per calcolare le variazioni d’energia interna di un sistema che non compie lavoro, ad esempio un sistema a volume costante. È sufficiente misurare il calore trasferito usando un calorimetro.
Calorimetria
Che cosa succede quando scaldiamo un corpo? Ovviamente questo aumenta di temperatura. Si osserva anche il viceversa: raffreddando un corpo questo diminuisce la propria temperatura. Fissata la quantità di calore scambiata, come posso sapere di quanto cambia la temperatura? Questa è la domanda cui la calorimetria vuole rispondere.
Cominciamo con un semplice esperimento: prendiamo un termometro, una pentola contenente un litro d’acqua e poniamola su un fornello. Oppure, se preferite immedesimarvi in uno scienziato dell’inizio del secolo scorso, usate una candela. Misuriamo la temperatura iniziale dell’acqua e poi accendiamo il gas per un minuto. Spegniamo il gas e misuriamo la nuova temperatura. Osserveremo ovviamente una temperatura superiore a quella iniziale. Ora prendiamo una pentola con una quantità doppia d’acqua, alla stessa temperatura iniziale, e manteniamo acceso il fornello per lo stesso tempo. Ci accorgeremo che la temperatura finale sarà inferiore. In altre parole, l’innalzamento della temperatura dipende dalla quantità di sostanza che voglio scaldare. Questo non vi stupisce di certo.
Nella figura potete osservare una versione meno casalinga di questo esperimento.
Ora, da buoni scienziati, cominciate a porvi delle domande.
- E se prendiamo un litro, o meglio, un kilogrammo, di una sostanza diversa? Olio ad esempio, oppure alcool
- E se ripetessimo l’esperimento partendo da acqua molto fredda? Diciamo a 5 gradi? Oppure da acqua già molto calda? 50 gradi ad esempio.
- E se ripetessi l’esperimento in alta montagna? Oppure al mare?
- E cosa succede se, mentre scaldo l’acqua, questa inizia a bollire?
L’elenco di domande può proseguire quasi all’infinito. Cambierebbe qualche cosa se oggi, invece di una giornata di sole, avessi avuto un temporale? E se ci fosse la luna piena? E se avessi la cravatta rossa? E se l’esperimento lo avesse compiuto il mio amico? E se invece di bruciare una candela intera, la divido in due e brucio due mezze candele contemporaneamente? Ad alcune di queste domande è possibile rispondere immediatamente. Ci stupiremmo molto se il risultato dell’esperimento dipendesse dal colore della cravatta. Altre domande invece possono richiedere un attimo di riflessione prima di poter decidere se vale la pena di eseguire un esperimento. Perché mai eseguire l’esperimento in alta montagna dovrebbe influenzare l’esperimento? Quali condizioni stanno variando? Di sicuro la pressione esterna, e quindi, in linea di principio, potrei osservare delle differenze. Non abbiate paura di porvi delle domande. Senza domande non si trovano le risposte, e solamente da buone domande possono arrivare buone risposte.
Alla prima domanda è facile rispondere: prendete dell’olio ed eseguite l’esperimento nelle stesse condizioni in cui avete eseguito il primo. Noterete che l’incremento di temperatura è diverso. Quindi, non solo il DT dipende dalla quantità di sostanza, ma anche dal tipo.
Anche il secondo esperimento è facile da eseguire: prendete un litro di acqua dal frigorifero, misurate la sua temperatura, e dopo averla scaldata osservate che la sua temperatura è aumentata, supponiamo, di 10 gradi. Ora prendete dal rubinetto dell’acqua molto calda, la scaldate per lo stesso tempo, e, oibò! il DT è diverso. A questo punto potete cominciare ad elaborare la struttura matematica della calorimetria, e accantonate per un attimo le altre domande (che riconsidereremo più avanti).
Vogliamo dare una descrizione matematica di questo esperimento: partiamo da una certa quantità di sostanza e forniamo calore in piccole dosi. Dopo ogni dose misuriamo la temperatura del campione.
La struttura matematica di cui noi abbiamo bisogno è qualche cosa che “correli” la temperatura al calore scambiato. Viene naturale pensare al concetto di funzione. Immaginiamo quindi di voler riportare in grafico la temperatura della sostanza contro il calore fornito. Possiamo riportare sull’asse delle x il calore fornito e sull’asse y la temperatura del campione. Non preoccupiamoci ora delle unità di misura del calore: possiamo misurarla in “candele consumate” o “minuti di accensione del fornello”.
Ci aspettiamo un grafico crescente. Aumentando il calore fornito, aumenta la temperatura raggiunta.

Se, raddoppiando il calore fornito, raddoppiasse anche l’incremento di temperatura, ci dovremmo aspettare un grafico rettilineo. Questo però contraddice uno degli esperimenti che abbiamo eseguito. Abbiamo stabilito che il DT dipende dalla temperatura del campione. Dopo la prima candela, o dopo il primo minuto di fornello, la temperatura del campione sarà diversa da quella iniziale, e quindi la seconda candela, o il secondo minuto, innalzerà di una diversa quantità il campione. In altre parole, ci dobbiamo aspettare un grafico non rettilineo.
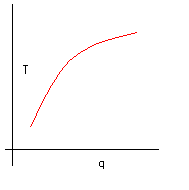
Se decidiamo di usare le candele, oppure i minuti di fornello, stiamo lo stesso fornendo calore in piccole “dosi” tutte uguali. Il grafico corrispondente quindi non sarà “liscio” ma formato da una serie di piccoli segmenti.
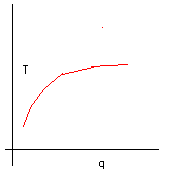
Tanto più la “dose” di calore è piccola, tanto più sarà liscia la curva.
Come prima formalizzazione matematica del nostro esperimento può andare bene, ma è necessario migliorarla. Prima di tutto deve essere compatibile con la struttura generale della termodinamica che abbiamo sinora sviluppato. In particolare può essere problematico considerare il calore come variabile indipendente. Sappiamo, infatti, che il calore non è una funzione di stato e quindi, anche se durante l’esperimento noi consideriamo la temperatura come variabile dipendente, sarebbe più soddisfacente se il calore fosse considerato funzione della temperatura. Matematicamente, e graficamente, questo lo otteniamo semplicemente scambiando gli assi.
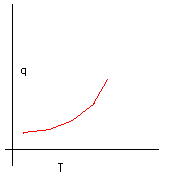
È importante capire che non stiamo cambiando in alcun modo l’esperimento. Durante l’esperimento noi raccogliamo solo un insieme di coppie di numeri: (dosi di calore, temperatura) e queste non cambiano considerando T indipendente.
Se preferite è possibile anche escogitare un esperimento in cui la temperatura sembra più indipendente che nel precedente esperimento. Consideriamo un’unica candela molto lunga quale fonte di calore. Su questa candela sono segnate delle tacche graduate. Accendiamo la candela e immergiamo il termometro. Ad ogni grado d’incremento di temperatura, controlliamo le tacche consumate sulla candela. Ovviamente l’ipotesi è che ogni tacca consumata fornisca la stessa quantità di calore (se la candela è omogenea e uniforme questa ipotesi è corretta). Ora possiamo porre in grafico le tacche consumate, nuova unità di misura del calore, contro la temperatura.
Questo esperimento concettuale è esattamente equivalente al precedente, anche se “psicologicamente” può apparire diverso.
Ora possiamo formalizzare con una formula quanto abbiamo detto. Consideriamo il calore come funzione della temperatura q = f(T). Se avessimo ottenuto un grafico rettilineo, la relazione sarebbe lineare:
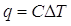
con C costante indipendente dalla temperatura (ma dipendente dal materiale).
Considerando un aumento infinitesimo di temperatura avremo
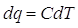
o, alternativamente
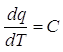 .
.
C è chiamata Capacità Termica, e in generale dipende dalla temperatura e dalla pressione (non vi siete dimenticati dell’esperimento eseguito in alta montagna vero?)
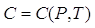 .
.
Se C fosse indipendente da P e T sarebbe costante, e quindi otterremmo il grafico di una curva con derivata costante, in altre parole una linea retta. È rassicurante osservare che matematicamente otteniamo lo stesso risultato del ragionamento qualitativo eseguito in precedenza.
La capacità termica quindi è la pendenza della curva “calore contro temperatura”. Possiamo quindi considerare la Capacità Termica come una proprietà di ogni sostanza. Fissate le condizioni di temperatura e pressione (oppure temperatura e volume) è possibile, concettualmente, costruire il grafico precedente per ogni sostanza. Possiamo anche immaginare di partire da una temperatura e diminuirla togliendo calore al sistema. La funzione da considerare è esattamente la stessa.
Nonostante il tempo sia una variabile necessaria alla esecuzione pratica di questo esperimento, vi ricordo ancora una volta come la variabile tempo non compaia mai in termodinamica classica. Non ha importanza quanto tempo impiega la candela a bruciare perché, dopo essersi spenta, la candela avrà fornito la medesima quantità di calore.
La conoscenza dei valori di capacità termica di vari materiali, ha grandi applicazioni pratiche e tecnologiche. Alcune sostanze hanno capacità termiche molto alte, altre molto più basse. Se togliamo dal forno a 250 °C un salmone arrostito su un foglio d’alluminio, osserviamo come, dopo qualche minuto il salmone sia ancora molto caldo mentre il foglio d’alluminio sia quasi a temperatura ambiente. Questo tipo di fenomeno è interpretabile con il concetto di capacità termica. Dal punto di vista costruttivo, è importante che le pareti esterne del forno abbiano una bassa capacità termica, per evitare di ustionarci quanto tocchiamo il forno. In realtà in questo caso è importante studiare il fenomeno della conduzione del calore. Questo però è un fenomeno dipendente dal tempo e non ce ne occuperemo in questo corso.
Capacità termica a volume costante CV
All’inizio del corso abbiamo più volte ricordato come uno dei pilastri della termodinamica sia l’osservazione della dipendenza delle varie grandezze macroscopiche. Fissata la composizione, Pressione, Volume e Temperatura non sono grandezze indipendenti, e si osserva sperimentalmente come solo due di queste, a scelta, si possono considerare variabili indipendenti. Il primo principio della termodinamica aggiunge un’altra funzione macroscopica alla lista: l’energia interna U. È ancora vero però che solo due variabili tra le quattro (p,V,T,U) sono indipendenti. È sempre vero che per ogni sistema possiamo considerare, ad esempio, l’energia interna U come dipendente da V e T; oppure potrei considerare la temperatura come funzione di U e p. Questo fatto è vero anche se non conosco la dipendenza esatta di U da V e T. La matematica ci permette di trarre delle conclusioni anche solo dall’enunciato d’esistenza di una funzione, anche senza conoscerne la forma analitica.
Consideriamo l’energia interna come funzione di T e V
U = U(T,V)
e consideriamo il caso in cui il sistema venga mantenuto a volume costante. L’andamento tipico di U rispetto a T è
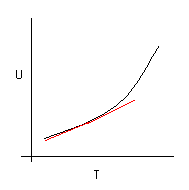
Fissiamo la temperatura di un corpo e immaginiamo di innalzare questa temperatura di una quantità infinitesima dT. A volume costante, il corpo innalzerà la sua energia interna di un infinitesimo dU. La costante di proporzionalità che lega i due infinitesimi si chiama Capacità Termica a volume costante e si indica con CV.
dU = CV dT.
Un altro modo di scrivere questa definizione è
dU / dT = CV
da cui si evince che la capacita termica a volume costante è la pendenza della curva U in funzione di T a volume costante.
Più correttamente dovremmo scrivere
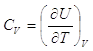
In termodinamica è uso riportare al pedice la variabile che rimane costante durante la derivazione. In realtà questo sarebbe del tutto superfluo visto che, per definizione, eseguendo una derivata parziale, tutte le altre variabili sono automaticamente mantenute costanti. Il solo vantaggio di una simile notazione è quello di poter ricordare quali sono le variabili indipendenti. È importante infatti sapere se, ad esempio, le due variabili indipendenti sono V e T, oppure p e U o qualche altra coppia.
Prima di tutto notiamo che la capacità termica dipende dalla temperatura: l’aumento di energia interna, a parità di innalzamento di temperatura, dipende dalla temperatura di partenza. In altre parole, CV è una funzione della temperatura.
A volte viene utilizzato il calore specifico, o capacità termica specifica, che è la capacità termica diviso per la massa espressa in grammi
Un’utile osservazione sperimentale è che, per intervalli di temperatura non troppo grandi, CV è approssimativamente costante, perciò
DU » CV DT
Come possiamo procedere nel caso fossimo a conoscenza della dipendenza esatta della capacità termica dalla temperatura? Visto che dU = CV dT, integrando ambo i membri tra lo stato iniziale e lo stato finale ottengo:
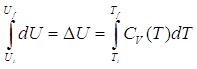
se l’intervallo di temperatura è piccolo, posso considerare approssimativamente CV una costante e ottenere la formula precedente.
Per alcuni materiali, si possono trovare tabulate delle formule empiriche approssimate che danno la dipendenza di CV dalla temperatura, ad esempio
CV = a + b T + c / T2
dove a, b e c sono parametri caratteristici del materiale.
Dopo tutto questo discorso una domanda nasce spontanea: abbiamo detto che l’energia interna non è osservabile direttamente. Come posso pensare di tracciare un grafico della sua dipendenza dalla temperatura da cui poi calcolare la capacità termica? Qui entra in gioco il primo principio: a volume costante la variazione di energia interna è pari al calore scambiato, perciò
qV » CV DT
dove abbiamo esplicitato che il calore viene scambiato a volume costante.
Questa equazione fornisce un modo pratico per misurare CV : forniamo una quantità nota di calore e misuriamo l’innalzamento della sua temperatura.
I vari materiali hanno capacità termiche differenti. L’acqua ha una capacità termica insolitamente alta: questo significa che grandi quantità di calore portano ad un innalzamento modesto della temperatura. In altre parole l’acqua è un ottimo “serbatoio” di calore. Questo è il motivo per cui le località di mare hanno durante l’inverno un clima mediamente più mite di località continentali: il mare durante l’inverno cede lentamente il calore che ha immagazzinato durante i mesi caldi.

L’alta capacità termica dell’acqua pone fine anche al “mistero della patata bollente”. Perché le patatine fritte si raffreddano molto più velocemente delle patate bollite? Questo nonostante le patate fritte partano da una temperatura molto più elevata (l’olio all’ebollizione raggiunge circa i 300 °C)
È noto a tutti come sia estremamente facile ustionarsi le labbra e la lingua cercando di addentare una patata bollita, anche lasciata raffreddare per svariati minuti. Perché? Bollendo, la patata, già ricca d’acqua naturalmente, ne assorbe ulteriormente, e porta la sua temperatura a 100 gradi Celsius (la temperatura d’ebollizione dell’acqua). Data la grande capacità termica dell’acqua, anche dopo aver emanato una grande quantità di calore, la sua temperatura è scesa solo di pochi gradi. Le patate fritte invece, perdono parte della loro acqua naturale per evaporazione, dato che la temperatura di ebollizione dell’olio è molto superiore a quella dell’acqua. Se queste si riempissero d’olio bollente, sarebbero ustionanti e McDonald non potrebbe venderle. Fortunatamente però, friggendo, le patate formano una cuticola esterna parzialmente impermeabile all’olio. Questo permette a parte dell’acqua di rimanere all’interno della patata, che rimane così morbida internamente e croccante sulla superficie. Questo è anche il motivo per cui le patate vanno gettate nell’olio già molto caldo, in modo che le patate sviluppino subito la cuticola fritta protettiva, e non si inzuppino d’olio, risultando anche più dietetiche.

Entalpia
La maggioranza delle reazioni chimiche studiate avviene a pressione costante (quella atmosferica). In queste condizioni, parte dell’energia è utilizzata per produrre lavoro se vi sono variazioni di volume. Dalla prima legge, il calore scambiato da una reazione a pressione costante è
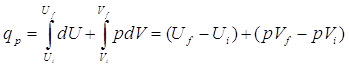
Dato che la pressione iniziale e quella finale sono identiche, possiamo riarrangiare questa equazione per mostrare come il calore scambiato sia la differenza tra un termine che dipende solo dallo stato finale e da un termine che dipende dallo stato iniziale.

Notate come il membro di destra dell’equazione sia composto solamente di funzioni di stato. Quindi anche il membro di sinistra, il calore, in condizioni di pressione costante, ha medesime proprietà. In particolare, il calore scambiato in queste condizioni è indipendente dal cammino ma dipende solamente dallo stato iniziale e quello finale.
Viene naturale a questo punto, definire una funzione “ausiliaria”: l’Entalpia.
H = U + pV
Possiamo scrivere quindi che il calore scambiato a pressione costante è uguale alla differenza di entalpia
qp = DH
Utilizzare l’entalpia è molto comodo quando si lavora a pressione costante. Ora il nostro elenco di variabili macroscopiche contiene p,T,V,U e H. L’entalpia tuttavia, a differenza dell’energia interna, non ci è stata “imposta” dalla natura, ma solo “suggerita” dalle circostanze. Non è una grandezza fondamentale, nonostante la sua grande importanza pratica.
 Immaginiamo per un attimo di venire in contatto con una razza aliena. Dopo aver confrontato le rispettive conoscenze scientifiche, scopriamo come anche la loro termodinamica ha sviluppato il concetto di energia interna, oltre ovviamente a pressione, volume e temperatura. Tuttavia non hanno mai sentito il bisogno di definire una funzione analoga alla nostra entalpia. Come mai? Una visita sul loro pianeta mostra come le loro condizioni atmosferiche siano molto più violente e mutevoli di quelle terrestri. In particolare, la loro pressione atmosferica non è costante, e cambia selvaggiamente nell’arco anche di pochi secondi. In queste condizioni il concetto di entalpia risulta molto meno utile di quanto lo sia per noi terrestri.
Immaginiamo per un attimo di venire in contatto con una razza aliena. Dopo aver confrontato le rispettive conoscenze scientifiche, scopriamo come anche la loro termodinamica ha sviluppato il concetto di energia interna, oltre ovviamente a pressione, volume e temperatura. Tuttavia non hanno mai sentito il bisogno di definire una funzione analoga alla nostra entalpia. Come mai? Una visita sul loro pianeta mostra come le loro condizioni atmosferiche siano molto più violente e mutevoli di quelle terrestri. In particolare, la loro pressione atmosferica non è costante, e cambia selvaggiamente nell’arco anche di pochi secondi. In queste condizioni il concetto di entalpia risulta molto meno utile di quanto lo sia per noi terrestri.

Per inciso, anche sulla terra la pressione atmosferica varia con le condizioni climatiche. Il bollettino meteo è pieno di “alte pressioni” e “basse pressioni”. Tuttavia queste variazioni, pur essendo sufficienti ad influenzare i fenomeni metereologici, sono troppo piccole per avere conseguenze significative sui fenomeni chimici. Sentiamo infatti parlare di millibar, cioè di variazioni pari ad un millesimo di un bar, molto picco quindi.
Dalla definizione di entalpia, possiamo calcolare la sua variazione infinitesima:
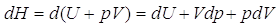
Questa è, in generale, la variazione infinitesima dell’entalpia. Lavorando a pressione costante, la variazione infinitesima di pressione è nulla e quindi
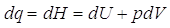
la variazione infinitesima di entalpia, a pressione costante, è pari al calore infinitesimo scambiato nel processo.
Capacità termica a pressione costante CP
Dalla discussione precedente sulle proprietà generali della capacità termica, non dovrebbe sorprendere come, accanto a CV venga anche utilizzata la capacità termica a pressione costante Cp. Per una variazione infinitesima di temperatura, la variazione infinitesima di calore scambiato nel processo è
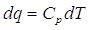
ma, come abbiamo già visto, in condizioni di pressione costante il calore scambiato è pari alla variazione di entalpia. Scriviamo quindi
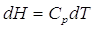
Ricordatevi che sarebbe scorretto scrivere
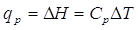
perché la capacità termica dipende dalla temperatura, e quindi il segno di eguaglianza è solo approssimato.
Analogamente a quanto abbiamo visto per la capacità termica a volume costante, possiamo integrare la relazione differenziale e ottenere
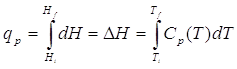
È più grande Cp o Cv ?
Per un certo materiale, è più grande la capacità termica a pressione costante o quella a volume costante? Supponiamo di fornire una data quantità di calore e di misurare l’incremento di temperatura. Lavorando a volume costante non viene compiuto lavoro e tutto il calore viene utilizzato per aumentare l’energia interna. Se invece lavoriamo a pressione costante, parte del calore fornito viene speso per compiere del lavoro di espansione. In questo caso, l’incremento di energia interna, e quindi di temperatura, è necessariamente minore. Quindi Cp è maggiore di CV.
Possiamo vedere la cosa utilizzando la matematica: TODO
Termochimica e variazioni di Entalpia
- La termochimica studia il calore scambiato durante le reazioni chimiche.
- Lavorando a pressione o temperatura costante possiamo identificare il calore scambiato con le variazioni di due funzioni di stato: l’entalpia e l’energia interna.
- A pressione costante, condizione tipica per moltissime reazioni chimiche, il calore scambiato è pari alla differenza di entalpia.
Se DH < 0 allora q < 0: il sistema cede calore. La reazione si dice esotermica.
Se DH > 0 allora q > 0: il sistema assorbe calore. La reazione si dice endotermica. - il DH di una reazione o processo è la differenza di entalpia tra i prodotti e i reagenti.
- il DH° standard di una reazione è la differenza di entalpia tra prodotti e reagenti, tutti nei loro stati standard, alla pressione di 1 bar e alla temperatura fissata.
- Di solito la temperatura convenzionale a cui si riportano i DH è 25°C (298.15 K) ma spesso, per i cambiamenti di fase, è comodo riportare le differenze di entalpia alla temperatura di transizione


Vediamo come sia il DH° di vaporizzazione che quello di fusione siano positivi. Sappiamo infatti che si deve fornire calore sia per sciogliere del ghiaccio sia per far evaporare dell’acqua. Notiamo come il calore necessario per la fusione sia molto minore di quello necessario per l’evaporazione. Questo è dovuto al fatto che nello stato liquido persistono ancora numerose interazioni fra le molecole d’acqua; interazioni che devono essere rotte per permettere alle molecole di lasciare lo stato liquido.
Poichè l’entalpia è una funzione di stato, il DH non dipende dal cammino percorso. Questo fatto è di enorme importanza in termochimica perchè permette di calcolare il DH per un processo scegliendo il cammino più comodo.
Esempio. Supponiamo di voler conoscere il calore coinvolto nel processo di sublimazione dell’acqua. Se disponiamo dei dati di entalpia per i processi di fusione e vaporizzazione (alla stessa temperatura) possiamo calcolare il DH di sublimazione semplicemente calcolando i DH dei sue processi.
Nella sublimazione vi è una transizione dalla fase solida alla fase gassosa (o viceversa) senza passare dalla fase liquida. È un processo abbastanza inusuale da osservare in natura a pressione ambiente. Un esempio, anche se non troppo “naturale” si può osservare in discoteca, quando il pavimento si riempie di una nebbiolina biancastra. Quella nebbiolina è anidride carbonica direttamente sviluppata da anidride carbonica solida, chiamata anche ghiaccio secco. Il ghiaccio secco sublima sviluppando anidride carbonica gassosa, che essendo più densa dell’aria non si alza da terra. Un esempio meno mondano è visibile nelle mattinate fredde e secche. Se si è formata della brina sul parabrezza dell’automobile, e possibile veder scomparire i cristalli di ghiaccio senza la formazione di goccioline d’acqua.
La legge di Hess
La legge di Hess in realtà non meriterebbe l’appellativo di “legge”, poiché è solamente l’applicazione del primo principio della termodinamica al calore sviluppato o assorbito dalle reazioni chimiche. Non è una legge indipendente; la ricordiamo così solamente perché il chimico russo Germain Henry Hess (1802-1850) la enunciò qualche anno prima dell’enunciazione della legge di conservazione dell’energia. I chimici suoi contemporanei erano poco interessati al calore sviluppato o assorbito dalle reazioni chimiche. Invece Hess ne fece il motivo conduttore dei suoi studi. Tra il 1839 e il 1842 eseguì una serie di esperimenti in cui dell’acido solforico veniva prima diluito in acqua, con sviluppo di calore, e successivamente neutralizzato con ammoniaca, con ulteriore sviluppo di calore. Hess osservò come il calore sviluppato nei due stadi dipendeva, ovviamente, dalla quantità d’acqua e di ammoniaca aggiunta. Tuttavia, partendo dalla stessa quantità di acido e arrivando allo stesso volume di soluzione finale, la somma del calore dei due stadi era con buona approssimazione costante. In altre parole, il calore totale sviluppato in una reazione dipendeva solamente dallo stato dei reagenti e dei prodotti, ed era indipendente dagli stadi intermedi delle reazioni. Con le sue parole
Il calore sviluppato in una trasformazione chimica è costante, sia che avvenga direttamente, o indirettamente in più passaggi.
Se la reazione chimica avviene a pressione costante, il calore totale sviluppato dipende solamente dai reagenti e dai prodotti, indipendentemente dai passaggi intermedi in cui è suddivisa la reazione. Questo avviene in virtù del fatto che, nonostante il calore non sia, in generale, una funzione di stato, a pressione costante il calore scambiato è uguale alla differenza di entalpia, che è una funzione di stato.
Ora noi enunciamo così la legge di Hess
Il DH di una reazione chimica è la somma dei DH di reazione individuali in cui è possibile scomporre la reazione.
Esempio: consideriamo la combustione del carbone per produrre calore

A volte il carbone non si ossida immediatamente a diossido di carbonio, ma passa attraverso lo stadio intermedio di monossido

che a sua volta viene ossidato

Possiamo notare come la somma dei DH delle due reazioni parziali sia pari al DH della reazione totale
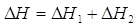
Un modo alternativo di affermare lo stesso fatto è: data una certa quantità di carbone, non è possibile ricavare più calore di quello che il primo principio della termodinamica ci permette, e cioè -787 kJmol-1.

Se in una televendita, qualcuno vi propone di acquistare una stufa straordinaria che, a parità di carbone, “scalda il triplo delle stufe concorrenti”, probabilmente o è un truffatore oppure la sua stufa consuma il carbone tre volte più velocemente. In entrambi i casi, la prima legge non è stata violata (ma forse il codice penale sì).

Possiamo calcolare il calore sviluppato da una reazione, se siamo in grado di suddividerla in una sequenza di reazioni di cui conosciamo i DH individuali. Ad esempio, supponiamo di voler conoscere il calore sviluppato dalla combustione del propene
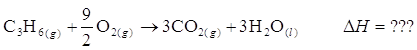
Possiamo ricavarlo dall’entalpia di idrogenazione del propene
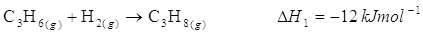
combinata con l’entalpia di combustione del propano
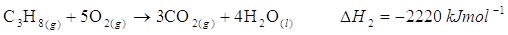
e con l’entalpia di formazione dell’acqua

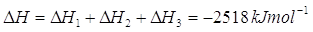
TODO
Legge di Hess ed energia gratis
Se la legge di Hess non fosse valida, potremmo generare energia dal nulla. Supponiamo, riprendendo un esempio precedente, che la combustione del carbone sviluppi i seguenti calori di reazione, in cui la legge di Hess non è soddisfatta

Vediamo ora com’è possibile sfruttare queste reazioni per produrre energia dal nulla: partiamo dall’anidride carbonica e dissociamola fornendo calore:

questi due passi hanno bisogno di 700 kJmol-1, che però possiamo recuperare bruciando, in un unico stadio, il carbonio prodotto

ottenendo un avanzo netto di –100 kJmol-1. Abbiamo creato energia dal nulla, partendo da anidride carbonica, dissociandola e sintetizzandola di nuovo.

Questo purtroppo non è possibile, essendo vietato dalla prima legge della termodinamica.
Legge di Hess, patatine fritte e cereali a colazione
Il professor Germain Henri Hess non ha mai avuto il piacere, o quantomeno l’opportunità, di gustarsi un hamburger con patatine fritte e un bicchiere di Coca-Cola. Dopo tutto, nella San Pietroburgo del 1840 i McDonalds e i BurgerKing non erano ancora molto comuni. Se avesse avuto questa opportunità, forse si sarebbe soffermato a considerare come la legge che porta il suo nome può trovare applicazione per aiutare gli avventori a giudicare e classificare in modo rigoroso e quantitativo, dal punto di vista dietetico, il cibo e le bevande che si apprestano ad ingerire.
La termodinamica, pur essendo nata dall’esigenza di capire meglio e migliorare, se possibile, l’efficienza dei motori a vapore messi a disposizione dalla rivoluzione industriale, è una scienza universale e trova applicazione ovunque vi sia un trasferimento di energia. Il nostro corpo è un “motore” che consuma “carburante” per produrre energia. È possibile, allora, applicare la legge di Hess per calcolare l’energia sviluppata da un hamburger con patatine o da un gelato al cioccolato.
Quanto calore, o lavoro, può produrre il nostro corpo bevendo una lattina di Coca-Cola? Per semplicità supponiamo che il solo ingrediente altamente energetico della Coca-Cola sia lo zucchero. Una lattina venduta in Italia contiene 39g di zucchero (in altri paesi la dose è diversa: c’è a chi piace molto più dolce e a chi meno). Più correttamente contiene 39 grammi di glucosio C6H12O6. Il glucosio, così come il comune zucchero da cucina, il saccarosio, appartiene alla grande famiglia dei carboidrati. Bruciando dello zucchero, questo si trasforma in diossido di carbonio e acqua, sviluppando calore.
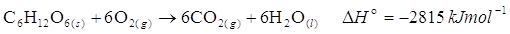
Sebbene non sia facilmente incendiabile, a volte può capitare che lo zucchero prenda fuoco mentre, in un pentolino, si cerca di preparare del caramello, sciogliendo in poca acqua lo zucchero e facendolo fondere pian piano. Se si scalda con troppo vigore, lo zucchero fuso può prendere fuoco e bruciare con sviluppo di molto calore, mostrando direttamente il suo alto contenuto energetico.
Se bruciata, una mole di glucosio produce 2815 kJmol-1 di calore. Cosa succede se, invece di bruciare all’aria, il glucosio viene assimilato dal corpo umano? Nel nostro corpo i carboidrati sono trasformati e assimilati in una serie di reazioni biochimiche; tuttavia i prodotti finali sono sempre, acqua e anidride carbonica, come nella combustione. Questo significa che, secondo la legge di Hess, l’energia che una mole di glucosio mette a disposizione del corpo umano è esattamente pari al calore sviluppato nella combustione descritta in precedenza, indipendentemente dal numero di reazioni intermedie. Nella combustione, l’energia si libera tutta sotto forma di calore, mentre nel nostro corpo, parte di quella energia viene utilizzata per compiere lavoro, movendo i muscoli degli arti, contraendo ritmicamente il cuore, espandendo i polmoni ed eseguendo tutti i movimenti, volontari e involontari, che ci mantengono vivi. Un’altra parte viene utilizzata per fornire energia a reazioni endotermiche e il resto viene immagazzinata nei legami di molecole sintetizzate a questo scopo.
Conoscendo il contenuto dei vari cibi, e conoscendone i prodotti metabolici finali, prodotti dal nostro corpo, mediante la legge di Hess possiamo conoscere esattamente la quantità di energia liberata
Non vorrei aver dato l’impressione che l’energia si libera solamente mediante la combustione. Questo non è assolutamente vero. Le proteine ad esempio, se bruciate, producono una certa quantità di calore. Quando vengono metabolizzate dal corpo umano, l’azoto contenuto viene invece trasformato, ed espulso, sotto forma di urea. Poiché i prodotti metabolici sono diversi da quelli ottenuti semplicemente bruciando le proteine in presenza di ossigeno, non è possibile utilizzare un normale calorimetro per misurare l’energia sviluppata. Una soluzione utilizzata in passato è stata quella di chiudere un animale in un calorimetro (!!!), somministrargli del cibo e misurare così il calore prodotto.

I primi scienziati a condurre esperimenti di questo tipo furono Antoine Lavoisier e Pierre Simon de Laplace (si, quello del  ). Nel calorimetro mostrato in figura (tratta da Lavoisier, Traitè Èleméntaire de Chemie, 1789) Lavoisier e Laplace chiudevano un piccolo mammifero (un topo o una cavia) in un cestino, circondato dal ghiaccio. Il calore sviluppato dal metabolismo veniva calcolato misurando la quantità di ghiaccio disciolto. Era necessario rinchiudere un mammifero, perché l’azoto contenuto nelle proteine, dai rettili e dagli uccelli, viene metabolizzato ad acido urico e non a urea.
). Nel calorimetro mostrato in figura (tratta da Lavoisier, Traitè Èleméntaire de Chemie, 1789) Lavoisier e Laplace chiudevano un piccolo mammifero (un topo o una cavia) in un cestino, circondato dal ghiaccio. Il calore sviluppato dal metabolismo veniva calcolato misurando la quantità di ghiaccio disciolto. Era necessario rinchiudere un mammifero, perché l’azoto contenuto nelle proteine, dai rettili e dagli uccelli, viene metabolizzato ad acido urico e non a urea.
I dietologi hanno misurato che, tipicamente, zuccheri, grassi e proteine, generano le seguenti quantità di calore
Cibo |
Energia |
Carboidrati |
4 Kcal/g |
Grassi |
9 Kcal/g |
Proteine |
4 Kcal/g |
Il risultato di queste misure è riassunto sull’etichetta di molti cibi in Calorie per grammo (notate la lettera maiuscola, per distinguerle dalle piccole calorie. Una Caloria equivale ad una Kilocaloria). Giusto per dare un’idea, 2000 Kilocalorie, l’apporto calorico giornaliero di una dieta non troppo ricca, sono sufficienti per portare all’ebollizione quasi 30 litri d’acqua.
È importante conoscere quali sono i prodotti metabolici del corpo umano quando trasforma i vari cibi, per poterne calcolare l’apporto energetico. Alcuni carboidrati, come gli zuccheri e gli amidi, sono completamente digeriti e metabolizzati. Per questi, l’energia liberata è uguale al calore di combustione. Altri carboidrati invece, come la cellulosa, vengono metabolizzati dai ruminanti, ma non dall’uomo o da altre specie di mammiferi, per mancanza degli enzimi adatti. In questo caso, l’apporto energetico della cellulosa al metabolismo è nullo, nonostante la cellulosa possa liberare un enorme calore di combustione.  Normalmente, infatti, buttiamo sul camino della legna da ardere, e non delle zollette di zucchero.
Normalmente, infatti, buttiamo sul camino della legna da ardere, e non delle zollette di zucchero.

Oggi noi sappiamo con esattezza quali cibi sono digeriti e quali no, e possiamo misurare con esattezza il potere energetico. Queste informazioni sono state ottenute con pazienti esperimenti su animali ed esseri. Gli scienziati hanno misurato il calore sviluppato dai vari cibi con lunghi e complessi esperimenti. Addirittura, verso la fine del secolo scorso, vennero costruiti dei calorimetri enormi, per poter contenere bovini, ovini e perfino uomini. Questi vivevano per alcuni giorni all’interno del calorimetro. Il calore prodotto veniva misurato accuratamente, assieme all’anidride carbonica prodotta, all’acqua e all’ossigeno consumato
Tutto questo per fortuna non è più necessario. Per conoscere il contenuto calorico dei ChocoCrispies, la Kellog’s non rinchiude, fantozzianamente, dei dipendenti in enormi calorimetri costringendoli a cibarsi solo di cereali al cioccolato per poter misurare il calore prodotto. È sufficiente eseguire un’analisi chimica del cibo e classificare le componenti nelle varie tipologie. Per molti alimenti queste informazioni si trovano di solito stampate sull’etichetta.
Perché si ingrassa?
Perché si ingrassa? In ultima analisi è “colpa” del principio della conservazione dell’energia. Se l’entalpia di metabolizzazione dei cibi che assumiamo in un giorno è superiore al calore sviluppato e al lavoro eseguito nello stesso giorno, l’energia in eccesso non può svanire nel nulla. Il corpo umano la immagazzina sintetizzando principalmente grassi, che fungono da serbatoio di energia. È possibile notare dalla tabella precedente che, a parità di peso, i grassi immagazzinano più energia di zuccheri o proteine. Per non ingrassare la termodinamica ci pone di fronte a due e solo due scelte: o si mangia di meno o si consuma di più facendo più esercizio.
[FIGURA]
Urea = NH2CONH2, metabolismo?
Acido Urico uccelli e rettili.
Entalpie standard di formazione
Legge di Kirchoff
Fonte: http://scienze-como.uninsubria.it/bressanini/thermo/07_Calore/caloreeTermochimica.doc
Sito web da visitare: http://scienze-como.uninsubria.it/bressanini/thermo/07_Calore
Autore del testo: non indicato nel documento di origine
Parola chiave google : Calore e termochimica tipo file : doc
Visita la nostra pagina principale
Calore e termochimica
Termini d' uso e privacy