Virologia generale
Virologia generale
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione)
VIROLOGIA
I VIRUS
La parola latina virus significa veleno. I virus sono organizzazioni biologiche caratterizzate da un livello subcellulare di struttura. Sono agenti infettivi responsabili di numerose patologie umane ed animali.
Possono definirsi parassiti intracellulari obbligati (possono moltiplicarsi solo all' interno di una cellula vivente), sono di piccole dimensioni (< 0.2 mm), sono costituiti essenzialmente da materiale genetico formato da un solo acido nucleico (RNA o DNA) contenuto in un rivestimento di natura proteica che ha la duplice funzione di proteggere il genoma virale e di mediare la penetrazione virale intracellulare interagendo con la superficie delle cellule sensibili. Sono sprovvisti di ribosomi e di sistemi enzimatici deputati alla produzione di energia.
Tabella 1. Principali differenze tra virus e microrganismi procarioti
|
Eubatteri |
Micoplasmi |
Rickettsie |
Clamidie |
Virus |
Presenza contemporanea di DNA e RNA |
+ |
+ |
+ |
+ |
- |
Presenza di ribosomi |
+ |
+ |
+ |
+ |
- |
Presenza di capacità biosintetiche autonome |
+ |
+ |
+ |
+ |
- |
Sensibilità agli antibatterici |
+ |
+ |
+ |
+ |
- |
Presenza di sistemi enzimatici deputati alla produzione di energia |
+ |
+ |
+ |
- |
- |
Crescita extracellulare in terreni artificiali |
+ |
+ |
- |
- |
- |
Moltiplicazione inibita dagli anticorpi in assenza di complemento |
- |
+ |
+ |
+ |
+ |
Sensibilità all' interferone |
- |
- |
- |
+ |
+ |
Figura 1. Dalla relativa semplicità di struttura di virus e batteri alla complessità di organizzazione di protozoi e muffe.

COMPOSIZIONE CHIMICA E STRUTTURA DEI VIRUS
I virus sono in grado di alternarsi in due distinti stati: intracellulare ed extracellulare o infettivo. I virus maturi, cioè le particelle virali complete extracellulari, sono chiamati virioni, si identificano con le particelle infettanti e si liberano al termine di replicazione virale.
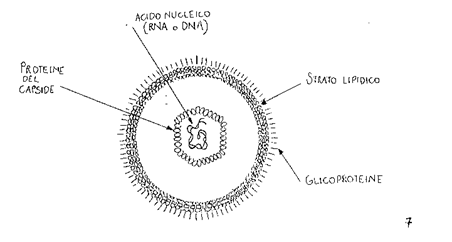
Il virione è costituito da un solo acido nucleico metabolicamente inerte (DNA o RNA) che deve penetrare in una cellula vivente per esplicare la sua attività ed è chiuso in un guscio proteico, (capside), che ha il compito di proteggerlo dalle nucleasi presenti nei fluidi biologici e di favorirne l' entrata nelle cellule suscettibili.
Capside + Genoma virale = Nucleo capside.
All' esterno del nucleo capside in alcuni virus (orthomyxovirus, herpesvirus, poxvirus) si osserva la presenza di una membrana limitante esterna detta pericapside o peplos o envelope, che contiene prevalentemente lipidi, proteine e carboidrati e che può essere disgregata dall' etere o da altri solventi dei lipidi.
L' envelope facilita l' entrata del virione nella cellula ospite, consentendo l' adsorbimento specifico, la fusione con la membrana cellulare e l' accesso al nucleo capside all' interno della cellula. L' envelope può contenere due diversi tipi di proiezioni esterne o peplomeri che si differenziano in emoagglutinine (strutture a bastoncino, aculei o spikes) e neuraminidasi con struttura a forma di fungo ad attività enzimatica.
Il capside è formato da numerose subunità strutturali chiamate capsomeri.
Figura 2.

Tabella 2. Terminologia utilizzata in virologia.
______________________________________________________________________
 Core
Core
Acido nucleico più ogni molecola che ne determina la stabilità.
Capside Struttura proteica che racchiude l' acido nucleioco o il core.
Capsomero Unità proteica che, ripetuta, forma il capside icosaedrico.
Nucleo capside Acido nucleico più capside.
Envelope Involucro lipoproteico esterno.
Peplomeri Proiezioni superficiali che protudono dall' envelope.
Virione Particella virale completa come si può osservare al di fuori della cellula.

STRUTTURA
Il capside che avvolge il genoma virale si suddivide in subunità dette capsomeri, strutturati in modelli geometricamente esatti. Il capside è formato dalla ripetizione di poche specie differenti di polipeptidi. Poichè una catena polipeptidica è una molecola asimmetrica, esistono due sole modalità di disposizione possibili per formare un involucro completo intorno all' acido nucleico virale:
- Simmetria elicoidale (prevalentemente a forma di bastoncino): le unità polipeptidiche sono disposte intorno ad un asse ideale, formando un cilindro cavo all' interno del quale si trova l' acido nucleico. L' acido nucleico è elicoidale ed intimamente associato con i capsomeri, per i quali forma un supporto. Es. : virus del mosaico del tabacco (TMV).
- Simmetria cubica o icosaedrica (a forma sferica): le unità polipeptidiche si dispongono sulla superficie di un icosaedro ideale, assumendo una disposizione tale per cui si riuniscono in gruppi, ognuno dei quali forma un capsomero. Ogni capsomero che occupa un vertice dell' icosaedro è formato da cinque subunità, e dà luogo ad un profilo pentagonale (pentone); mentre ogni altro capsomero disposto in un' altra zona dell' icosaedro, formato da sei catene polipeptidiche, dà luogo ad un profilo esagonale (esone). Es. : adenovirus, herpesvirus, picornavirus, reovirus.
VIRUS A STRUTTURA COMPLESSA
Oltre agli iridovirus, retrovirus e bunyavirus, ricordiamo i poxvirus, virus animali il cui virione possiede una complessa struttura ovaloide o cilindroide appiattito, e i batteriofagi contenenti RNA a simmetria cubica e a DNA con struttura complessa. I rapporti tra i diversi componenti non sono del tutto conosciuti.
Figura 3.
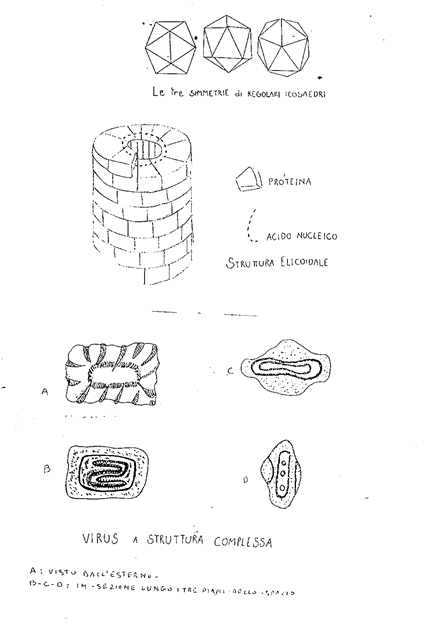
Figura 4. Batteriofagi: virus parassiti dei batteri divisi in sei diversi tipi morfologici A,B,C,D,E,F

Nei primi tre gruppi il genoma è formato da DNA bicatenario (A,B,C);
nel quarto e sesto gruppo l' acido nucleico è costituito da DNA monocatenario (D-F);
nel quinto gruppo da RNA monocatenario (E).
AGENTI INFETTANTI A STRUTTURA PECULIARE
Viroidi: agenti infettanti le piante costituiti da frammenti di acido nucleico (RNA) privi di guscio proteico.
Prioni: agenti responsabili di particolari malattie neurologiche ad evoluzione lenta (DSE, kuru) costituiti da frammenti glicoproteici autoreplicanti privi di acido nucleico.
COMPOSIZIONE CHIMICA
Acidi nucleici virali. Il genoma virale è costituito da un solo acido nucleico, DNA o RNA. Il DNA è costituito solitamente da un doppio filamento lineare come nei poxvirus; fa eccezione il DNA dei parvovirus che è a singolo finamento, quello dei papovavirus che è circolare e quello degli hepadnavirus che è a doppio filamento circolarizzato di cui uno solo completo.
L' RNA virale è quasi sempre a singolo filamento, come nei reovirus. Spesso è estatto in frammenti; fa eccezione nelle reoviridae e nelle birnaviridae, dove è a doppio filamento segmentato.
Proteine virali:
- proteine che permettono all' acido nucleico virale di replicarsi (DNA o RNA polimerasi).
- proteine strutturali.
- proteine che alterano alcune funzioni e strutture della cellula ospite (trascrizione del DNA cellulare)
La porzione proteica costituisce la parte più cospicua del virione ed è rappresentata principalmente dalle proteine strutturali strettamente associate all' acido nucleico. (proteine del capside). Esse servono per la protezione nell' ambiente e per la penetrazione del virus nella cellula; il loro numero è relativamente modesto e vario.
Altri costituenti chimici. La componente lipidica (colesterolo, fosfolipidi e grassi neutri), presente esclusivamente nel pericapside, può essere cospicua in alcuni virus (poxvirus ed orthomyxovirus, togavirus), ed è responsabile della sensibilità dei virus al trattamento con solventi dei lipidi che ne aboliscono la capacità infettante. Nel peplos, oltre ai lipidi in doppio strato, è contenuta una piccola quantità di carboidrati legata alle proteine, le quali hanno il compito di garantire la rigidità del peplos. Nei poxvirus sono presenti rame, FAD (flavin-adenin-dinucleotide) e biotina, il cui ruolo molto importante nel metabolismo cellulare è sconosciuto nella particella virale.
Figura 5.
PROPRIETA' CHIMICO-FISICHE
CARATTERI ANTIGENI
L' interazione degli anticorpi con i virioni riflette la presenza di siti antigenici nella struttura stessa del virione, data la prevalente concentrazione delle proteine virus-specifiche nel capside e nei peplomeri dell' involucro lipoproteico. Nei virus provvisti di involucro pericapsidico, gli antigeni del nucleo capside sono accessibili agli anticorpi solo dopo la rottura del peplos.
ENZIMI
I virus non sono del tutto sprovvisti di proteine ad attività enzimatiche. Si conoscono due enzimi associati a particelle virali, e cioè l' enzima di tipo lisozimico, presente in alcuni batteriofagi, capace di attaccare il peptidoglicano della parete cellulare batterica e le neuraminidasi presenti negli orthomyxovirus. Inoltre nei virus animali sono presenti altri enzimi legati al processo di trascrizione delle informazioni contenute nel genoma virale, implicati nel processo di formazione degli RNA messaggeri virus specifici.
MORFOLOGIA
I virus sono di dimensioni molto piccole. Quelli visualizzati al microscopio elettronico si presentano sotto varia forma: sferica, ovoidale, allungata, poliedrica, a mattone, a ditale, a mina marina. Le loro dimensioni nanometriche (1 nm = 10 -9 m) vanno dai 27 nm dei più piccoli (Picornavirus) ai 300 nm dei più grossi (Poxvirus), determinabili anche indirettamente mediante filtrazione attraverso membrane a porosità nota.
RESISTENZA AGLI AGENTI CHIMICI E FISICI
Sono sensibili ai comuni agenti disinfettanti e sterilizzanti ma non sono suscettibili all' azione dei chemioantibiotici normalmete attivi sui batteri. I virus sono:
- Altamente termosensibili, esposti ad una temperatura di 55 - 60 °C, dopo 30 minuti o dopo pochi secondi a 100 °C, le proteine del capside vengono denaturate e il virus perde la capacità infettante.
- Stabili a bassa temperatura. Vengono conservati a -70 °C.
- Facilmente inattivati dai raggi UV, formaldeide e da agenti ossidanti, sensibili alle radiazioni ionizzanti (più sensibili alle radiazioni i virus con acido nucleico monocatenario).
I virus provvisti di involucro lipoproteico sono più labili rispetto ai virus con nucleocapside nudo, inattivati dai solventi dei lipidi, dal trattamento con etere e cloroformio. Nei riguardi de fenolo molti virus sono resistenti.
Tabella 3. Classificazione dei virus.
______________________________
1. Secondo l’organismo parassitato
virus batterici
virus vegetali
virus animali - insetti
- vertebrati
2. Secondo il tipo di acido nucleico
deossiribovirus (dna)
ribovirus (rna)
3. Secondo la simmetria
elicoidale
icosaedrica
complessa
4. Presenza o meno di peplos (involucro pericapsidico)
Tabella 4. Virus a RNA
Famiglia |
Virus rappresentativi |
Dimensioni (nm) |
Peplos |
Caratteristiche |
Picornaviridae |
Enterovirus dell' uomo, compresi poliovirus, virus Coxsckie,ed echovirus; rhinovirus;virus piede bocca del bestiame; epatite A |
20-30 |
- |
Si riproducono nel citoplasma; forma sometrica |
Reoviridae |
Reovirus (infezioni latenti respiratorie ed enteriche); orbivirus, della febbre da zecca del Colorado e della malattia del cavallo africano; rotavirus che causano la gastroenterite infantile |
60-80 |
- |
RNA a doppio elemento; forma isometrica |
Togaviridae |
Alphavirus, compreso il virus di Sindbis; flavovirus, compreso il virus della febbre gialla; rubivirus, compreso il virus della rosolia; pestivirus, compreso il virus della diarrea mucosa |
40-70 |
+ |
Copertura di lipidi; le varietà originate dagli artropodi si riproducono negli artropodi e negli uomini; forma sferica |
Arenaviridae |
Virus di Lassa; virus della coriomeningite dei topi |
50-300 |
+ |
Granuli di RNA all' interno del virione, alcuni ribosomi della cellula ospite |
Coronaviridae |
Virus respiratori dell' uomo; virus della bronchite infettiva degli uccelli; virus della diarrea dei vitelli; virus enterico dei suini |
80-30 |
+ |
Proiezioni a forma di pelato, simili alla corona solare |
Retroviridae |
Virus oncogeni a RNA di topi, uccelli e gatti; visnavirus degli ovini; leucemia umana a cellule T; HIV |
100 |
+ |
Contiene enzima trascrittasi inversa, che usa RNA virale per sintetizzare trascritto di DNA; forma sferica |
Bunyaviridae |
Virus della febbre di Rift Valley; virus Bunyamwera |
90-100 |
+ |
Originati da artropodi, si moltiplicano negli artropodi: gemmano attraverso la membrana citoplasmatica |
Orthomyxoviridae |
Virus dell' influenza (tipi A, B e C) dell' uomo, dei suini e degli equini |
80-120 |
+ |
RNA a singolo elemento, segmentato; fosfolipidi, neuramidasi e RNA-polimerasi RNA-dipendente; forma sferica |
Paramyxoviridae |
Parotite; morbillo; virus della malattia di Newcastle; virus della malattia di Carrè |
150-300 |
+ |
RNA non segmentato, a singolo elemento: neuramidasi e polimerasi di RNA RNA-attivati; forma sferica |
Rhabdoviridae |
Virus della rabbia; virus della stomatite vescicolosa dei bovini |
70-175 |
+ |
RNA elicoidale, a singolo elemento; gemmano attraverso la membrana citoplasmatica; forma allungata |
Tabella 5.Virus a DNA
Famiglia |
Virus rappresentativi |
Dimensioni (nm) |
Peplos |
Caratteristiche |
Parvoviridae |
Parvovirus dei roditori, virus satelliti adenovirus-associati (difettivi) |
20 |
- |
i riproducono nel nucleo |
Papovaviridae |
Virus del papilloma: virus del polioma dei topi; vacuolizzante , dellescimie (SUGO) |
45-55 |
- |
Si riproducono nel nucleo; latenti; oncogeni - manifestazioni simil tumorali (condilomi-verruche-papillomi); |
Adenoviridae |
Virus delle malattie respiratorie ed enteriche (nelle infezioni |
60-90 |
- |
Molti sono latenti; producono tumori nei criceti neonati; forma isometrica |
Herpesviridae |
Virus dell' herpese simplex, tipi 1 e 2; virus varicella -zoster; citomegalovirus, virus di Epstein-Barr - HHV6 - HHV7 |
100-200 |
+ |
Molti latent; possono causare infezioni ricorrenti, alcuni associati a tumori (herpes tipo 2, virus di Epstein-Barr); forma rotondeggiante |
Poxviridae |
Vaiolo; mollusco contagioso; fibroma e mixoma dei conigli |
230-400 |
+ |
Si riproducono nel citoplasma, polimerasi di RNA DNA-attivati ed altri enzimi; forma ovoidale |
Hepadnaviridae |
Virus epatite B - tumori primitivi del fegato |
42 |
- |
Spiccato tropismo per gli epotociti; meccanismo di replicazione complesso; forma circolare |
LA MOLTIPLICAZIONE DEI VIRUS
I virus sono metabolicamente inerti e incapaci di moltiplicarsi per divisione binaria. Si moltiplicano attraverso la replicazione separata dei diversi componenti del virione e il successivo assemblaggio dei componenti virali neoformati nella progenie virale. La moltiplicazione avviene quando il virus, penetrato nella cellula, è stato denudato dalle protezioni proteiche.
La moltiplicazione ha luogo in un sito endocellulare specifico per ogni tipo di virus: i virus a DNA si replicano nel nucleo (ad eccezione dei poxvirus che si replicano nel citoplasma); i virus a RNA si replicano nel citoplasma (ad eccezione dei virus influenzali che si replicano nel nucleo e del virus Delta dell' epatite).
In un solo ciclo riproduttivo e da un singolo virione si produce una progenie che è costituita da un numero molto elevato di virioni neoformati. Caratteristica dei virus è l' assoluta uniformità nelle dimensioni e nella forma dei virioni nell' ambito di ogni specie virale.
PROCESSI DELLA REPLICAZIONE VIRALE
1) Adsorbimento:prima tappa della capacità invasiva del virus. Attacco del virus alla membrana citoplasmatica della cellula.
2) Penetrazione: - per endocitosi (virus privi di involucro pericapsidico).
- per fusione (virus provvisti di peplos).
3) Esposizione dell' acido nucleico virale: denudazione (uncoating).
4) Sintesi dei componenti virali
5) Assemblaggio dei componenti capsidici neosintetizzati (formazione dei virioni)
6) Liberazione della progenie virale: formazione del pericapside e fuoriuscita del virus neoformato dalla cellula.
- ADSORBIMENTO. L'attacco del virus alla celliula avviene tra le proteine presenti sulla superficie del virus - antirecettori - con le proteine complementari sulla membrana cellulare - recettori specifici cellulari -. Il contatto consiste in un' attrazione di tipo ionico tra il virus e la cellula (in pH neutro sia il virus che la cellula sono caricati negativamenrte e quindi è necessaria la presenza di ioni positivi quali il magnesio). L'attacco non richiede reazioni con produzione di energia ed è possibile solo con cellule che possiedono recettori idonei a reagire con gli antirecettori del virus. La sensibilità di una cellula è definita e limitata dalla presenza di recettori idonei che sono strutture con altre funzioni cellulari che casualmente hanno zone complementari agli antirecettori virali. L' adsorbimento rende il virus non più neutralizzabile da anticorpi specifici e permette la fase successiva, cioè la penetrazione del virus.
- PENETRAZIONE. Il processo di penetrazione dei virus nelle cellule animali avviene con intervento attivo delle cellule dopo la prima fase di adsorbimento. Sono necessarie temperature ottimali per le cellule. La penetrazione avviene mediante endocitosi (viropessi) nel caso di virus privi di involucro pericapsidico (meccanismo simile alla fagocitosi) o per fusione con la membrana cellulare ed immediata denudazione del nucleo capside all' interno del citoplasma (es. paramyxovirus ed herpesvirus). La fusione richiede l' intervento di specifiche proteine presenti nell' inviluppo del virione.
- ESPOSIZIONE DELL' ACIDO NUCLEICO VIRALE (UNCOATING). Il virione penetrato nella cellula viene denudato dagli involucri proteici che racchiudono l' acido nucleico ad opera di enzimi proteolitici endocellulari: il genoma virale ha così accesso a quei costituenti cellulari che ne permetteranno la replicazione.
SINTESI DEI COMPONENTI VIRALI. La nuova progenie virale richiede la sintesi ex novo di acidi nucleici e proteine virali che sono rappresentate da proteine non strutturali precoci (enzimi replicativi e regolatori sintetizzati dopo l' esposizione dell' acido nucleico virale e tradotte da RNA messaggeri trascritti dal genoma del virus). Esse inibiscono la sintesi di macromolecole cellulari rendendo i poliribosomi cellulari liberi per la trascrizione delle proteine virali. Dopo la replicazione dell' acido nucleico virale sono sintetizzate le proteine strutturali tardive (costituenti il virione) e sono tradotte da RNA messaggeri trascritti dall' acido nucleico virale neoformato. La sintesi delle macromolecole virus specifiche e il loro assemblaggio porta alla formazione di nuova progenie virale. Tali eventi biosintetici consistono nella:
- trascrizione dell' informazione genica in RNA messaggero
- traduzione dei messaggeri virali con sintesi di proteine funzionali e strutturali
- replicazione del genoma virale.
- ASSEMBLAGGIO DEI COMPONENTI CAPSIDICI NEOSINTETIZZATI (FORMAZIONE DEI VIRIONI). La configurazione delle proteine strutturali condiziona la riunione dei diversi componenti virali secondo determinati progetti di simmetria. Nel caso di virus con capside isometrico l' assemblaggio del capside precede l' ingresso del genoma virale nell' involucro proteico, completato poi successivamente dall' ingresso dell' acido nucleico. Nei virus con capside isometrico senza envelope, i virioni neoformati formano ammassi accumulati nella sede di montaggio con un aspetto tridimensionale di formazioni "cristalline".
LIBERAZIONE. E' la tappa conclusiva del ciclo replicativo. Solo con la morte e la lisi delle cellule infette, i cui tempi dipendono dal tipo di virus e dal tipo di cellula, si ha liberazione di virus neroformati nell' ambiente esterno. I virus provvisti di peplos richiedono per il montaggio definitivo delle particelle virali finali l' intervento della membrana cellulare, contemporaneamente alla fuoriuscita del virione dalla cellula infetta (processo di gemmazione). In essi il danno cellulare è meno drammatico ed è in qualche caso compatibile con la sopravvivenza cellulare, mentre nei virus sprovvisti di peplos i materiali prodotti danneggiano profondamente il metabolismo della cellula e ne provocano la morte.
DURATA DEL CICLO DI REPLICAZIONE VIRALE
E' estremamente variabile nei diversi gruppi di virus e anche nell' ambito di una stessa famiglia di virus (negli herpesviridae varia da 18-20 ore degli alphaherpesvirus a 3-4 giorni dei betaherpesvirus. La durata del ciclo replicativo è proporzionale alla complessità e alle dimensioni del genoma) ed è in funzione della quantità degli eventi biosintetici necessari.
ANTIGENI VIRUS SPECIFICI NEL CORSO DEL CICLO DI REPLICAZIONE VIRALE
Le proteine virus specifiche che si producono nel corso della moltiplicazione virale possiedono determinanti antigenici e stimolano come antigeni la reazione immunitaria nell'organismo infetto. Sono riconoscibili come antigeni all' interno delle cellule infette e vengono utilizzate in diagnostica per accertare la presenza di un'infezione virale. Si distinguono in antigeni non strutturali normalmente precoci, e meno immunogeni e di breve durata, e antigeni strutturali tardivi e molto immunogeni.
CLASSI REPLICATIVE
In base alla strategia messa in atto per la loro replicazione, in funzione del tipo e della struttura dell' acido nucleico del differente modo, quindi, di trascrizione dell' acido nucleico nel rispettivo mRNA, i virus animali sono stati divisi in sei classi:
Classe I (DNA a doppio filamento): alcuni virus come i papovavirus, adenovirus ed herpesvirus, usano per il processo di trascrizione, replicandosi nel nucleo, usano una RNA-polimerasi cellulare. Altri usano una propria poichè si replicano nel citoplasma (poxvirus ed iridovirus). La trascrizione e la traduzione avviene in due o tre cicli e la produzione delle proteine strutturali è determinata da mRNA generati nell' ultimo ciclo di trascrizione.
Classe II (DNA a singolo filamento): viene sintetizzato un filamento complementare ad opera di una polimerasi cellulare e su tale stampo viene replicato l' acido nucleico virale. Si ha poi la trascrizione del genoma e la sintesi delle componenti virali (parvovirus).
Classe III (RNA a doppio filamento): l' RNA è segmentato e una polimerasi che è presente nel virione trascrive in altrettanti mRNA separati ciascun segmento(reovirus, birnavirus). Le molecole di mRNA hanno due funzioni: di essere tradotte per produrre proteine strutturali e di assemblarsi parzialmente e servire da stampo per la sintesi di filamenti complementari.
Classe IV (RNA a singolo filamento con polarità + ): il genoma formato da una molecola di RNA monocatenario ha la stessa polarità del RNA-messaggero. Produce un' unica poliproteina, demolita poi selettivamente in proteine virali strutturali. Una polimerasi catalizza la formazione di un nuovo RNA genomico. Nei picornavirus e nei calicivirus il genoma viene trascritto per intero, nei togavirus e nei coranavirus la trascrizione di RNA-m avviene da tratti distinti del genoma.
CLASSE V (RNA a singolo filalamento con polarita' - ): l' RNA non può funzionare direttamente come messaggero, per cui il genoma deve essere trascritto in un RNA-m ad opera di una polimerasi presente nel virione. L' RNA del genoma funziona da stampo per la trascrizione e la replicazione. Questi virus (orthmixovirus, bunyavirus ed arenavirus)hanno un genoma segmentato.
CLASSE VI (retrovirus): questi virus perlopiù oncogeni possiedono l' enzima DNA-polimerasi DNA dipendente che trascrive l' RNA virale in un DNA virale. A sua voolta questo fa da stampo per la formazione del filamento complementare. Si ha così un DNA a doppio filamento integrato nel genoma virale (provirus). Si ha poi la ritrascrizione del DNA virale integrato per mezzo di una polimerasi cellulare con produzione di nuove molecole di RNA genomico e di mRNA più piccoli, tradotti poi per produrre poliproteine strutturali.
GENETICA VIRALE
Anche i virus come i batteri possono mutare. Nel genoma virale avvengono mutazioni spontanee o causate da agenti mutageni chimici o fisici, che portano alla formazione di nuove catene con proprietà differenti dal virus parentale.
Le mutazioni nel genoma di un virus si verificano durante il processo di sintesi del nuovo genoma nel processo di replicazione. I virus a DNA sono più stabili: gli "errori" sono contenuti e limitati rispetto ai virus a RNA che presentano una maggiore frequenza di mutazione (modificazione antigenica delle proteine del capside o del pericapside).
Le mutazioni da uno stipite originario, da una sola proteina del capside o del peplos, possono determinare nel virus mutato proprietà antigeni, proprietà emoagglutinanti e proprietà infettanti per alcune cellule, o produrre resistenza a farmaci antivirali.
I mutanti sono identificati dalle proprietà indotte dalla mutazione:
- Mutazioni letali: sono difficili da isolare perchè il virus non può replicarsi.
- Mutanti di placca: virus che producono placche di citolisi su monostrati di colture cellulari con caratteri morfologici diversi dallo stipite originario.
- Mutanti di spettro d' ospite: differiscono per il tipo di cellule che possono infettare.
- Mutanti attenuati: causano infezioni con patologie meno gravi nell' uomo e nell' animale.
- Mutanti condizionali: sensibili alle temperature (i mutanti crescono da 30-35 °C, temperature assai inferiori di quelle che consentono la replicazione del virus originale, mentre sono inattivi a 38-40 °C ). Riguardano essenzialmente mutazioni letali.
Nuovi ceppi virali possono formarsi dall' interazione genetica tra due virus della stessa specie ma differenti in qualche proprietà, o tra i virus e la cellula ospite, coinvolgendo i genomi e i loro prodotti terminali.
Le interazioni genetiche sono:
1) Ricombinazione: avviene facilmente tra virus a DNA, ambedue attivi della stessa specie, differenti in alcuni caratteri fenotipici (es. HSV-1 e HSV-2).
2) Riattivazione crociata: ricombinazione di due virus della stessa specie, differenti in alcuni caratteri genotipici, uno attivo e l' altro inattivo.
3) Riattivazione da molteplicità d' infezione: ricombinazione fra due o più genomi di virus identici e tutti inattivati, in porzioni differenti del genoma.
Le interazioni non genetiche sono:
1) Mescolamento fenotipico: il genoma di un virus viene incorporato nel capside di un altro virus della stessa specie ma con caratteri antigeni diversi (transcapsidazione).
2) Mescolamento genotipico: i nucleocapsidi di due virus correlati ma differenti per qualche carattere genetico sono inglobati nello stesso involucro pericapsidico. Si ha così la segregazione dei due genotipi.
3) Interferenza: la presenza di un virus in una cellula impedisce la moltiplicazione di un altro virus superinfettante. Tale interferenza può essee causa della produzione di interferon.
4) Complementazione: la moltiplicazione di uno o più virus in una infezione virale doppia o multipla, è dovuta all' utilizzazione di proteine del genoma di un virus coinfettante. Si può verificare tra virus della stessa specie o molto diversi.
COLTURE CELLULARI
I virus sono incapaci di moltiplicarsi in terreni artificiali, in quanto necessitano di cellule viventi per la loro replicazione. Si utilizzano, pertanto, animali da laboratorio, uova embrionate e colture cellulari in vitro. Pasteur fu il primo ad ottenere il vaccino antirabbico utilizzando animali da laboratorio. Gli embrioni di pollo contengono vari tipi di cellule, nelle quali possono replicarsi vari tipi di virus, e ciò ha reso possibile l' infezione e la coltura di diversi virus in cellule idonee. Attualmente le colture cellulari hanno sostituito l' uso delle uova embrionate, salvo alcune eccezioni come il virus dell' influenza
Le colture cellulari sono ottenute da tessuti o organi, prelevati da animali, che vengono trattati con enzimi proteolitici per ottenere delle sospensioni di singlole cellule. Tali cellule dopo la crescita non presentano tracce della primitiva organizzazione e morfologia, assumendo un aspetto epitelioide o fibroblastico. Le principali fonti sono: tessuto epiteliale, connettivo, muscolare e nervoso, anche in relazione al fatto che alcuni virus vivono solo in determinati tessuti. Le cellule ottenute da questi tessuti, dopo trattamento proteolitico sono fatte crescere a 37 °C con speciali terreni di coltura in recipienti di vetro o di plastica. Questi terreni, costituiti da soluzioni saline bilanciate e opportunamente tamponate con sodio bicarbonato a pH 7.4, contengono sali, idrati di carbonio, vitamine, aminoacidi e siero fetale, tutte sostanze nutritizie di cui le cellule hanno bisogno per crescere. Inoltre possono essere addizionati con antibiotici, antibatterici ed antimicotici, per prevenire le contaminazioni batteriche e fungine.
Le cellule così ottenute sono messe in coltura: il primo strato di cellule confluenti viene denominato coltura in monostrato. Le cellule che si moltiplicano in sospensione, in continuo movimento, sono dette colture in sospensione. Le colture cellulari si distinguono in colture primarie se provengono da tessuti od organi prelevati direttamente dall' animale; se vengono subcoltivate una prima volta danno origine a colture secondarie.
Le linee cellulari più comunemente usate sono contrassegnate con le sigle Hela (carcinoma della cervice umana), Hep-2 (carcinoma dei ratti neonati), MRC5 (fibroblasti di polmone), VERO (rene normale di scimmia).
MODALITA' DI TRASMISSIONE DEI VIRUS
I virus possono essere trasmessi da un individuo all' altro con diversi meccanismi e modalità.
Tabella 6. Schema sulle modalità di trasmissione dei virus
Tipo di trasmisione |
Modalità |
Esempi e virus |
|
Transplacentale |
in gravidanza, HIV, HCMV, Rosolia |
Trasmissione verticale |
Perinatale |
al parto, HSV, papillomavirus, HIV, HBV |
|
Neonatale |
HBV, HIV |
|
Diretta |
contatto diretto, rapporto sessuale, trasfusioni, trapianti, inoculazione accidentale, graffi, ecc. |
Trasmissione orizzontale |
Indiretta |
Veicoli, oggetti, sostanze contaminate |
|
|
Vettori, (insetti o artropodi) |
Tabella 7. Trasmissione orizzontale di alcuni virus umani
Via di trasmissione |
Virus |
Patologia provocata |
Contatto diretto, trasfusioni, |
Herpesvirus |
Generalizzata |
inoculazione |
Retrovirus |
Generalizzata |
|
Hepadnavirus |
Generalizzata |
Respiratoria |
Rhinovirus |
Respiratoria localizzata |
|
Adenovirus |
Respiratoria localizzata |
|
Paramyxovirus |
Generalizzata |
|
Orthomyxovirus |
Generalizzata |
Acqua, alimenti, altri veicoli |
Enterovirus |
Generalizzata |
contaminati (via oro-fecale) |
Epatite A |
Generalizzata |
|
Adenovirus |
Enterica localizzata |
|
Rotavirus |
Enterica localizzata |
Vettori (insetti, artropodi) |
Togavirus |
Generalizzata |
|
Flavivirus |
Generalizzata |
|
Bunyavirus |
Generalizzata |
Morso di animale |
Arenavirus Rhabdovirus |
Generalizzata Localizzta al sistema nervoso centrale |
AZIONE PATOGENA DEI VIRUS (Capacità di determinare malattia)
I virus, a differenza dei batteri, devono penetrare e moltiplicarsi nelle cellule dell' ospite per determinare alterazioni morbose. La malattia è sempre preceduta dalla moltiplicazione virale; l'azione patogena dei virus è caratterizzata dalla realizzazione dell' infezione e dalla produzione ed estrinsecazione delle lesioni, che sono a loro volta condizionate dal virus e dalle caratteristiche e modalità di risposta dell' ospite.
INFEZIONE
La sensibilità cellulare e la permissività dovuta ai recettori di membrana condizionano il suo meccanismo. La resistenza all' infezione è legata a mancato adsorbimento virale. La realizzazione dell' infezione si attua mediante la penetrazione dell' agente nell' ospite e la sua replicazione in organi e tessuti specifici.
La penetrazione può essere passiva (epatite B, AIDS) e si attua con una immissione diretta per via cutanea per mezzo di siringhe, aghi infetti, oppure per superamento di barriere mucose (inalazione o ingestione).
La replicazione può essere primaria nelle cellule permissive, in corrispondenza del sito d' ingresso, e può assumere caratteri estensivi, per cui il processo infettivo può rimanere localizzato. Può essere secondaria, ed avviene in aree lontane dal sito d' ingresso con diffusione successiva ad organi diversi (viremia). Nel caso di infezioni disseminate la diffusione virale è condizionata dai caratteri di virulenza del virus e dai meccanismi di difesa dell' ospite. Vari sono i modelli di malattia e variano secondo le tendenze dei virus a diffondersi ai tessuti sottostanti. La malattia può essere localizzata quando la moltiplicazione e il danno cellulare rimangono confinati al sito d' ingresso o ci può essere trasporto mediante secrezioni, o in cavità con coinvolgimento d' organo (raffreddori o influenze, gastroenterite virale). Può essere disseminata quando l' infezione si sviluppa a tappe successive (viremia) come nel morbillo, parotite. Può essere inapparente quando non sussiste sintomatologia ma si ha immunità.
Tabella 8. I diversi tipi di infezione virale
|
Clinicamente inapparente |
|
Infezione acuta |
Con malattia conclamata |
|
|
Cronica |
Con sintomatologia o clinicamente inapparente |
Infezione persistente |
Latente |
Clinicamente inapparente se non durante la riattivazione |
|
Lenta |
Evoluzione clinicamente lenta e progressiva |
LE LESIONI
Dopo l' infezione si determinano diversi tipi di lesioni anatomo-funzionali negli organi interessati. Tali lesioni possono derivare direttamente dall' azione citopatogena del virus o essere conseguenze dell' attivazione delle risposte immunitarie dell' ospite.
LESIONI DIRETTAMENTE PROVOCATE DAL VIRUS
Nelle infezioni citocide (acute) la replicazione del virus determina danni irreversibili nelle cellule infette causandone la morte per inibizione delle sintesi macromolecolari della cellula, modificazione della membrana citoplasmatica, alterazioni lisosomiali. Le malattie sono acute con brevi periodi d' incubazione (influenza, poliomelite, enteriti, encefaliti erpetiche). L' immunità esercita un ruolo in genere protettivo.
Nelle infezioni latenti il virus non uccide le cellule in cui si moltiplica, instaura un rapporto di parassitismo controllato, non si replica e la cellula può sopravvivere e duplicarsi. Si ha integrazione del genoma virale in quello dell' ospite, si possono avere infezioni asintomatiche, riattivazione, con episodi di malattie recidivanti.
Le infezioni persistenti rappresentano una condizione di parassitismo controllato. Qui però vi è una continua produzione di antigeni virali e di virus infettante. Le cellule non subiscono danni letali direttamente dal virus ma sono esposte ad azioni lesive del sistema immunocompetente dell' ospite. Ne conseguono malattie cronicamente evolutive (epatite cronica attiva) o malattie lente a prognosi infausta (PESS da morbillo).
Nella trasformazioni alcune cellule in vitro vanno incontro a modificazioni dovute ad infezioni ad opera di virus oncogeni. La trasformazione cellulare viene considerata l' equivalente in vitro dell' oncogenicità virale in vivo. Le difese immunitarie dell' ospite hanno un ruolo efficiente produttivo.
LESIONI DIPENDENTI DAL COINVOLGIMENTO DEL SISTEMA IMMUNITARIO DELL' OSPITE
Le risposte immunitarie dell' ospite, che contribuiscono in gran parte alla guarigione, possosno partecipare ai processi patologici ed alle manifestazioni cliniche dovute al virus. Le modalità di coinvolgimento del sistema immunitario sono dovute alla stimolazione antigenica costante dei virus infettanti e alla capacità di alcuni di essi di infettare le cellule immunocompetenti. I virus possono provocare danno a cellule del sistema immunocompetente, depressione transitoria dell' immunità cellula mediata (Rosolia, EBV), deficit immunitario permanente (HIV); comparsa di antigeni anomali sulla membrana delle cellule infette; si può avere lisi cellulare perchè le cellule modificate vengono attaccate dal sistema immunocompetente, determinando un danno cellulare (esantema tubeolico). Si possono innescare meccanismi immunopatologici e malattie da immunocomplessi circolanti (esantema morbilloso).
LE DIFESE ANTIVIRALI DELL' ORGANISMO
Nelle infezioni virali l' ospite viene esposto a dosi elevate di antigeni virali. I virus sono buoni immunogeni perchè le proteine strutturali e non strutturali stimolano la risposta immune. Compaiono in circolo, durante l' infezione virale, linfociti di grandi dimensioni detti reattivi o virociti che sono l' espressione di una massiccia attivazione del sistema immunitario. Si ha produzione di anticorpi delle diverse classi immunoglobuliniche (risposta umorale) e di linfociti T sensibilizzati (risposta cellula mediata) che distruggono le cellule infettate prima che possano produrre numerosa progenie di virus; gli anticorpi aboliscono l' infettività dei virioni (neutalizzazione) già liberati dalle cellule infette.
Si ritienen che in alcune infezioni virali le risposte umorali svolgano un' azione difensiva preminente ed in altre quelle cellulo-mediate. Ha maggior efficacia la risposta umorale (anticorpi) nelle infezioni da virus che restano limitati alle superfici mucose o che tendono a disseminarsi per via ematica (enterovirus, togavirus). Ha maggior efficacia la risposta cellulo-mediata nelle infezioni da virus che diffondono da cellula a cellulu per contiguità, ad esempio nei trapiantati, nelle malattie linfoproliferative, il virus citomegalico, varicella-zoster, herpes simplex.
RISPOSTA UMORALE
La risposta anticorpale varia d' intensità ed andamento nel tempo a seconda del virus, dell' individuo e della sede dell' infezione. Essa si manifesta con la produzione di anticorpi dimostrabili nel siero, 5-10 giorni dopo l' inizio dell' infezione. Nell' infezione primaria compaiono prima le immunoglobuline di classe IgM che permangono per alcuni mesi e poi decadono fino a scomparire, mentre le classi IgG ed IgA compaiono più tardi ma permangono molto più a lungo per anni o per tutta la vita. Nelle reinfezioni e nelle riattivazioni di infezioni latenti, la produzione di IgM è scarsa o assente.
MECCANISMI DELL' AZIONE PROTETTIVA DEGLI ANTICORPI
Gli anticorpi hanno effetto neutralizzante, cioè sono in grado di eliminare la capacità dei virioni di infettare nuove cellule, impedendo ai virus di assorbirsi alle cellule suscettibili coprendo gli antirecettori e legandosi direttamente ad essi. Hanno azione antivirale attuata mediante la citolisi delle cellule infette complemento-dipendente: infatti gli anticorpi che attivano la via classica del complemento si combonano con antigeni virali espressi sulla superficie della cellula infetta e rapidamente la disgregano; rallentano la replicazione virale modificando gli antigeni virali di superficie; accelerano la fagocitosi dei virus da parte dei macrofagi in quanto il virus fagocitato, neutralizzato dall' anticorpo , è incapace di iniziare l' infezione dei fagociti e viene degradato (effetto opsonizzante). Inoltre i complessi immuni insieme al complemento attivano la reazione infiammatoria.
RISPOSTA CELLULO-MEDIATA
Nel corso delle infezioni virali i linfociti T sensibilizzati compaiono alcune ore o giorni prima degli anticorpi per poi scendere a livelli molto bassi nel giro di alcuni mesi; rimangono tuttavia cellule T con memoria immunitaria capaci di dare una rapida ed intensa risposta. I linfociti T riconoscono gli antigeni solo se questi sono strettamente associati con gli antigeni self di classe 1 (citotossici) o di classe 2 (helper) del sistema maggiore di istocompatibilità. Sono incapaci, quindi, di contastare i virus extracellulari e interagiscono solo con gli antigeni virali espressi sulle superfici cellulari
MECCANISMI DELL' AZIONE PROTETTIVA DELLA RISPOSTA CELLULO-MEDIATA
I linfociti T quando incontrano cellule che esprimono gli antigeni virali verso i quali sono sensibilizzati sulla loro superficie, blastizzano, proliferano e si differenziano in alcune linee funzionali fra cui i linfociti citotossici, i linfociti helper e i linfociti Td che hanno varie azioni protettive e regolatorie, producono linfochine e hanno azione di difesa antivirale (azione citotossica).
VALORE DIAGNOSTICO DEI PARAMETRI IMMUNITARI
E' importante per la diagnosi eziologica la dimostrazione di anticorpi in fase acuta di malattia in una determinata infezione. Essa si può ottenere accertando che nel corso della malattia si è avuta sieroconversione (comparsa di anticorpi nel siero di un soggetto che ne era privo) oppure un aumento significativo del titolo anticorpale.
Ricercando gli anticorpi di classe IgM, titolando anticorpi diretti verso antigeni diversi del virus, che riescono ad evidenziare uno stadio particolare della malattia (EBV, HBV), accertando un' eventuale discesa del titolo anticorpale nei mesi successivi alla convalescenza.
PROFILASSI ANTIVIRALE IMMUNITARIA
La profilassi mediande la somministrazione di vaccini, rimane il metodo di elezione per la prevenzione delle infezioni virali.
Immunizzazione attiva: si attua allestendo due tipi fondamentali di vaccini virali, e cioè vaccini allestiti con virus inattivati (influenza, rabbia, febbre gialla); vaccini con antigeni prodotti per sintesi o antigeni ricombinanti mediante tecniche del DNA ricombinante (epatite B); vaccini attenuati (polio, morbillo, rosolia).
Immunizzazione passiva: a scopo profilattico è possibile usare nei soggetti a rischio virale, la somministrazione di gammaglobuline iperimmuni specifiche (virus rabbico).
MECCANISMI DIFENSIVI NON DIPENDENTI DALLE RISPOSTE IMMUNI
Ricordiamo che gli organismi superiori possiedono barriere anatomiche, come la cute e le mucose, opposte dall' organismo alla penetrazione dei virus. A livello, poi, del siero e dei tessuti, esistono vari tipi di inibitori non anticorpali. Vi è poi l' importante fattore della fagocitosi, la febbre, la risposta infiammatoria, e l' attivazione del sistema dell' interferon.
INTERFERONE (IFN)
L' interferone fa parte dei meccanismi difensivi naturali dell' ospite contro l' ingresso di agenti estranei. E' costituito da una famiglia di molecole divise in tre specie: interferon alfa, beta e gamma. Sono proteine cellulari indotte da vari stimoli, non possiedono attività antivirale diretta ma inducono uno stato di resistenza antivirale; non sono virus-specifiche ma sono dotate di specificità di specie (agiscono su cellule della stessa specie animale). Persistono nell' organismo da poche ore a pochi giorni. Hanno azione depressiva sulla produzione di anticorpi prima della differenziazione di linfociti B a plasmacellule e azione di potenziamento quando agiscono su plasmacellule secernenti. Potenziano le espressioni degli antigeni di istocompatibilità. Agiscono sui macrofagi, potenziando la fagocitosi , la citocidia e la produzione di monochine. Sui linfociti citotossici naturali e sulla proliferazione cellulare, riducendola o rallentandone le fasi. Inibiscono la differenziazione cellulare.
I FARMACI ANTIVIRALI
Le ricerche di farmaco-terapia hanno portato in questi ultimi anni, all' individuazione di un certo numero di molecole dotate di un' azione selettiva tale da essere impiegate nella pratica clinica.
Tabella 9.Agenti antivirali
Principio attivo |
Meccanismo d' azione |
Indicazioni |
1. Uso Sistemico |
|
|
Amantadina idrocloruro |
Inibizione della fusione con la membrana della cellula ospite del virus dell' influenza A |
Profilassi dell' imfluenza A; ridotti, ma definiti effetti terapeutici sull' influenza A |
Acyclovir (ACV) |
Inibizione della DNA-polimerasi degli herpesvirus |
Herpes genitale primario; meno efficace per infezioni da HSV genitale ricorrenti; indicato per il virus varicella- zoster in pazienti immuno-compromessi e non; encefalite da HSV; in neonati opazienti immuno-compromessi |
Diidrossipropossimetilguanina (Ganciclovir) |
Inibizione della DNA-polimerasi degli herpesvirus |
Gravi infezioni da CMV, in particolare retiniti |
Tabella 9. continua
Principio attivo |
Meccanismo d' azione |
Indicazioni |
Adenina Arabinoside (AraA) (vidarabina) |
Inibizione della DNA-polimerasi dell' herpesvirus. Incorporazione nel DNA virale allo scopo di produrre falso DNA virale |
Terapia di HSV neonatale |
Fosfonoformato (foscarnet) |
Inibizione della DNA-polimerasi degli herpesvirus e del virus dell' epatite B; inibizione della trascrittasi inversa di HIV |
Infezioni da CMV in soggetti immunodepressi, herpes labiale e genitale, infezione da HIV |
2. Uso topico |
|
|
a. Pelle |
|
|
Acyclovir |
Vedi acyclovir uso sistematico |
Infezione primaria da herpesvirus genitale in pazienti immuno-logicamente normali; infezione cutanea limitata da Herpes simplex in pazienti immuno-compromessi |
b. Occhi |
|
|
5-Iodo-2-desossiuridina |
Inibitore della DNA-polimerasi dell' erpesvirus |
Terapia topica di congiuntiviti o cheratiti superficiali causate da HSV |
Adenin Arabinoside |
Vedi 5-Iodo-2-desossiuridina |
Vedi 5-Iodo-2-desossiuridina |
Trifluridina |
Vedi 5-Iodo-2-desossiuridina |
Vedi 5-Iodo-2-desossiuridina |
In via di perimentazione |
|
|
Ribavirina (Virazolo) |
Inibizione dell' RNA-polimerasi dei virus ad RNA |
Febbre di Lassa, gravi polmoniti da virus respiratorio sinciziale, influenza A e B |
Fonte: http://www.microbiologia.unige.it/dpb/Appunti/14%20VIROLOGIA.doc
sito web: http://www.microbiologia.unige.it/
Autore del testo: non indicato nel documento di origine
Virologia generale
HERPESVIRIDAE
Si conoscono almeno 80 virus appartenenti a questa famiglia capaci di infettare l'uomo e diverse specie animali. Il genoma è costituito da DNA lineare a doppio filamento racchiuso in un capside proteico icosaedrico (Æ 100 nm) costituito da 162 capsomeri cavi. Materiale amorfo detto "tegumento" avvolge il capside, l'involucro esterno è costituito da glicoproteine e lipidi, pertanto i solventi organici distruggono l'infettività del virus. I virioni hanno forma sferoidale con un diametro tra 120 e 300 nm. L'uomo è ospite naturale dei seguenti herpes virus contraddistinti con la numerazione progressiva da 1 a 7:
Herpes simplex di tipo 1 (HSV 1)
Herpes simplex di tipo 2 (HSV 2)
Virus Varicella Zoster (VZV)
Virus Epstein Barr (EBV)
Virus Citomegalovirus (HCMV)
Herpesvirus umano 6 (HHV6)
Herpesvirus umano 7 (HHV7)
Virus B della scimmia
Caratteristiche biologiche comuni.
-la sintesi del DNA virale e l'assemblaggio del capside avvengono nel nucleo della cellula infetta.mentre l'involucro esterno si forma durante la maturazione nel passaggio attraverso la membrana cellulare.
Il DNA contiene geni che codificano enzimi specifici per la sintesi del DNA-polimerasi ed il clivaggio delle proteine virali
-le cellule infette vengono sempre distrutte.
-tendenza a determinare una infezione latente per tutta la vita
-caratteristiche epidemiologiche comuni.
la modalità di replicazione degli herpesvirus si attua attraverso un ciclo particolare, chiaramente schematizzato nella Figura n. 1
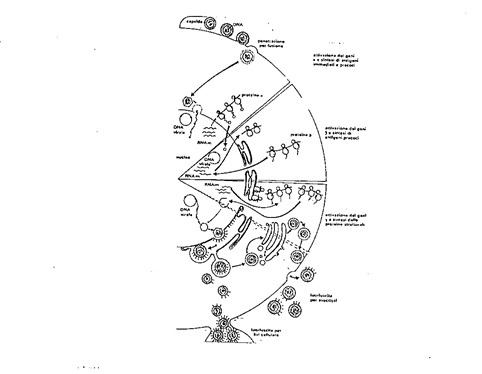
Gli herpes virus dopo l'esaurimento della fase clinica dell'infezione primaria si mantengono allo stato latente per molti anni o per tutta la vita localizzandosi in organi o tessuti diversi, riattivandosi a seguito di stimoli quali febbre, traumi, immunodepressione o per una diminuita attività immunitaria cellulo mediata.
Riattivandosi danno origine ad un quadro sintomatologico identico dell'infezione primario o totalmente diverso.
HERPES SIMPLEX
Fa parte della sottofamiglia degli Alfaherpesvirinae.
Si distinguono due tipi di herpes simplex: HSV1 e HSV2 che possiedono strutture antigeniche in parti comuni e in parte distinte. Hanno glicoproteine ad attività diversa, differiscono nella neurovirulenza negli animali da laboratorio e per la differente sensibilità alle alte temperature. L`HSV1 e` responsabile di manifestazioni cutanee localizzate nella parte superiore del corpo. L`HSV2 provoca lesioni nella parte inferiore, cute dei genitali maschili e femminili. La maggior parte delle persone si infettano con uno di questi virus durante le prime due o tre decadi di vita. Il contagio interumano è attraverso la saliva , bicchieri infetti. L’ HSV2 si contrae tramite rapporti sessuali.
Le infezioni primarie o iniziali si manifestano con segni clinici evidenti o del tutto asintomatici. Le lesioni cutanee hanno un aspetto vescicoloso, riunite in grappoli vanno incontro a rottura con erosioni che guariscono con esiti cicatriziali. (proliferazione e morte cellulare)
DIFFUSIONE DEL VIRUS DAL SITO D` IMPIANTO
Durante l` infezione primaria l` HSV si moltiplica localmente e diffonde da cellula a cellula.
Instaura una viremia di breve durata. Durante questa fase il virus entra nelle fibre sensitive locali. Si suppone che la diffusione centripeta del virus lungo il nervo puo` avvenire lungo l`assone stesso, i linfatici perineurali o lo spazio endoneurale o le cellule di Shwans. Recentemente si dà una maggiore importanza alla teoria del trasporto passivo retrogrado assoplasmatico. L`HSV1 raggiunge alla velocita` di circa 200-400 mm per giorno i gangli del trigemino. L` HSV2 i gangli sacrali prima dell` instaurarsi della latenza. Se l`infezione non procede oltre i gangli sensitivi fino al nevrasse, l`organismo ospite diviene portatore di un` infezione latente.
LATENZA
E` una condizione statica con il virus che non si replica mantenuto silente per integrazione nei cromosomi della cellula ospite oppure perche` isolato in un episoma ( il genoma virale acquisisce una configurazione circolare e rimane nella cellula in forma episomiale).
RIATTIVAZIONE
A seguito di stimoli, stress, febbre,eventi scatenanti, interventi dentali, mestruazioni, si ha una recrudescenza con replicazione del virus che si origina nel ganglio cranio-spinale responsabile dell` innervazione del sito di recrudescenza. Il virus prodotto migra lungo le terminazioni nervose fino a giungere alle zone cutanee innervate dove si ha poi la manifestazione erpetica.
L` immunita` umorale e quella cellulare limitano l`infezione del virus favorendo la guarigione. La riattivazione del virus si manifesta con una patologia meno grave per la presenza di anticorpi specifici che determinano una piu` veloce risoluzione dell` infezione.
Di solito i neuroni non sono danneggiati dal virus durante la latenza e la riattivazione. La resezione della radice sensitiva del ganglio trigemino causa la riattivazione dell` herpes simplex, la manipolazione chirurgica delle sue radici causa herpete facciale ricorrente.
IDENTIFICAZIONE
Il virus si isola in coltura, prelevato dalle vescicole cutanee, dalla saliva, dal liquido cefalorachidiano. Si identifica con le reazioni di neutralizzazione di immunofluorescenza direttamente sul materiale patologico impiegando anticorpi monoclonali. L` unica metodica per chiarire se l`infezione e` primaria o ricorrente e` quella di determinare la presenza di anticorpi specifici di classe IgM che rimangano per settimane. I test RIA e ELISA sono indicati per questo tipo di indagine.
IMMUNIZZA ZIONE
Esistono dei vaccini contenenti le glicoproteine del peplos (GD) purificate da colture cellulari infette.
CHEMIOTERAPICI
L` acyclovir agisce iin modo selettivo sulle cellule infette provocando la sintesi di DNA virale non funzionante. Puo` essere somministrato sia per via generale che a livello topico. E` molto efficace nelle infezioni primarie , meno efficace in quelle ricorrenti.
SINDROMI CLINICHE SPECIFICHE CAUSATE DALL’ HSV 1
Gengivostomatite o stomatite aftosa
Si manifesta generalmentenei bambini fra gli 1 e 6 anni ed è caratterizzata da febbre, eruzioni vescicolari, ulcerative, delle gengive, della lingua, della mucosa della bocca, labbra, con linfoadenopatia locale. La guarigione si ha in 2-3 settimane.
Eczema erpetico
Manifestazioni cutanee generalizzate, eruzioni vescicolari diffuse o in alcune aree del corpo. Si manifesta piu` frequentemente in persone con disturbi eczematosi con frequenti abrasioni cutanee.
Infezione erpetica delle dita (girodito)
E` causata da HSV di entrambi i tipi. Le vie d` ingresso sono le zone cutanee con soluzione di continuita`. Dolori e vescicole nelle zone cutanee delle dita si risolvono in 2-3 settimane. Gli odontoiatri sono particolarmente esposti a questa infezione poiche` spesso presentano lesioni cutanee alle dita data la maggior esposizione con materiale infetto.
Herpes oftalmico
Fra i sintomi della malattia si riscontrano sensazioni di corpo estraneo ,dolori, lacrimazioni, fotofobia., piccole vescicole o ulcere sulla cornea ; il decorso è di 2 settimane. Per un processo di scivolamento delle cellule l’ulcera si ripara e dopo la cicatrizzazione non rimangono croste. Nei soggetti con ulcere ricorrenti si può avere una diminuzione visiva. L’ulcera protratta causa opacità corneale. Il virus dopo l`infezione mucocutanea labiale migra attraverso il nervo olfattivo, al lobo temporale, può causare lesioni cerebrali. Non trattato e` letale e i pazienti sopravvissuti presentano deficit neurologici di notevole grado.
Herpes labiale
E` la piu` comune manifestazione clinica con eruzioni vescicolari raggruppate o singole a livello della giunzione mucocutanea delle labbra , dolorose e fastidiose.
I pazienti colpiti da tale infezione costituiscono una fonte d`infezione per gli odontoiatri che debbono prendere le dovute precauzioni
Herpes genitale
Il quadro clinico e` caratterizzato da un esantema vescicolare poco esteso con dolori, irritazioni, circoscritti alle zone genitali. Lesioni localizzate sul prepuzio, dorso del pene, scroto, ano, vulva. Spesso infezioni batteriche si sovrappongono alle lesioni. L’h erpes neonatale e` una conseguenza dell` herpes genitale: infatti i neonati contraggono l` infezione alla nascita da madri con herpes genitale per contatto diretto durante il tragitto lungo il canale del parto. E` una patologia grave che puo` compromettere la sopravvivenza del neonato per coinvolgimento del sistema nervoso centrale, fegato, polmone.
VIRUS DELLA VARICELLA- ZOSTER
Fa parte della sottofamiglia delle Alfaherpesvirinae.
Mentre la varicella è un` affezione esantematica dell` età infantile, l`herpes-zoster è un` affezione esclusiva dell` eta` adulta e si manifesta nei soggetti che hanno sofferto di varicella nell` età infantile.
Il virus VZV è lo stesso che causa la varicella e l` herpes-zoster.
I virus responsabili di queste due patologie sono morfologicamente e immunologicamente indistinguibili.
Varicella
L`infezione primaria avviene prevalentemente nell` eta` infantile anche se si puo` contrarre nell` età adulta. Il periodo d` incubazione è di circa due settimane e la malattia si manifesta con papule cutanee che evolvono in vescicole che rapidamente si rompono con formazione di croste. Le croste si staccano in una decina di giorni lasciando la pelle sana o con piccole cicatrici. Complicazioni: sepsi, sintomi emmorragici, epistassi, melena o ematuria. Il virus può coinvolgere frequentemente il polmone e la polmonite virale e` la complicanza piu` seria specialmente negli individui immunocompromessi. La varicella puo` inoltre causare serie complicanze in donne gravide nei primi e ultimi mesi di gestazione.
Herpes-Zoster
Come avviene per gli altri herpesvirus anche il VZV dopo l`infezione primaria, stabilisce latenza nei nervi cranici o nelle radici dorsali dei nervi sensitivi. Da queste sedi il virus si riattiva migrando attraverso le fibre nervose fino a raggiungere la cute dove provoca un esantema vescicolare. Sono le persone anziane e i soggetti con deficit immunitari che manifestano complicanze nevralgiche post erpetiche con sindrome dolorosa che persiste per mesi ed anni. Il virus cresce esclusivamente in colture di fibroblasti umani e non si trasmette agli animali o embrioni. L` isolamento del VZV puo` essere effettuato da materiale prelevato dalle vescicole. Mediante i metodi IFA e i test ELISA si possono ricercare, per verificare la situazione immunitaria dei soggetti o per documentare un’infezione attiva, gli anticorpi anti VZV. L’osservazione dell’IgM specifiche anti VZV possono attestare un’infezione primaria. E` disponibile attualmente un vaccino ricavato dalla particella zoster (OKA) che conferisce una buona protezione. Viene somministrato agli individui immunocompromessi. Altre terapie: l`acyclovir e le immunoglobuline specifiche.
Virus Epstein-Barr
Fa parte della sottofamiglia deiGammaherpesvirinae
E’ stato osservato per la prima volta in biopsie di un linfoma di Burkitt, è coinvolto in altre manifestazioni cliniche come il linfoma a cellule B in pazienti con immunodeficienza acquisita. Il virus provoca la mononucleosi infettiva malattia tipica dell’età giovanile. Dopo un periodo di incubazione i primi sintomi che si manifestano sono: febbre, cefalea, anoressia, faringiti, linfo e splenomegalia, rush cutanei, una forma leggera di epatite.
Anche l’EBV può rimanere latente e riattivarsi in individui immunodepressi; l’eliminazione con la saliva de virus in pazienti asintomatici con la saliva richiede un adeguata protezione con maschere, guanti, occhiali per prevenire il rischio dell’esposizione agli odontoiatri in corso di trattamento con pazienti affetti. Nel corso dell’infezione produttiva il virus da origine alla produzione di numerose proteine virali antigene EA-VCA-MA. Si ritiene che l’infezione avviene nei linfociti B del tessuto linfonodale dell’anello del Waldayer e nelle cellule epiteliali del rinofaringe e ghiandole salivari. Da questi siti le cellule infettate dal virus EBV vengono disseminate nel corpo attraverso il sangue; tuttavia l’azione dei linfociti T limita la proliferazione dei linfociti B e quindi della malattia. Questo processo infettivo stimola l’immunità umorale e l’immunità cellulomediata così, prima dei sintomi si possono trovare anticorpi, possiamo avere ricadute dopo 6-12 mesi successivi alla prima infezione.
Le complicanze sono: meningiti, encefaliti, danno epatico cellulare, rottura della milza, l’ edema delle tonsille, adenoidi e ugola può provocare cianosi.
CITOMEGALOVIRUS
Fa parte della sottofamiglia dei Betaherpesvinae.
Il virus cresce solo nelle colture cellulari di fibroblasti umani , cellule come quelle della tiroide e i fibroblasti di coniglio sono passibili di infezione, ma non permettono la produzione dei virioni.
A differenza dell’HSV il CMV non impedisce la sintesi di macromolecole dell’ospite, ma stimola la sintesi di DNA , RNA e proteine.
Il genoma del CMV stimola l’attività di sintesi della cellula ospite mentre una funzione precoce del virus interrompe la sintesi delle macromolecole. Il virus attiva transitoriamente le funzioni cellulari nelle cellule destinate a produrre virioni e in modo continuativo nelle cellule non permissive infettate.
Il CMV blocca successivamente le funzioni dell’ospite come la produzione di Interferone.
Le infezioni da CMV sono clinicamente per 80% inapparenti, dopo l’infezione primaria il virus rimane in uno stato di latenza e si riattiva con o senza manifestazioni apparenti.
Il virus può essere isolato nell’urina , saliva, sangue, seme , latte materno.
L’infezione primaria avviene attraverso la via orale o respiratoria. L’infezione congenita e neonatale può avvenire in utero o durante il parto per contatto con secrezioni genitali contenenti virus
I bambini con infezione congenita o gravemente affetti presentano una minore capacità uditiva, basso peso alla nascita, epatosplenomegalia con ittero, anemia emolitica, ritardo mentale, squilibri motori. In alcuni soggetti trasfusi si sviluppa una patologia simile alla mononucleosi con febbre, epatite, splenomegalia. Ciò avviene in soggetti giovani trasfusi ed è quindi necessario distinguere questo quadro di mononucleosi da quello causato dal virus da Epistein- Barr.
Stati febbrili, sindrome da mononucleosi ed epatiti polmoniti da CMV possono causare morte nei trapiantati renali.
Per la ricerca di anticorpi della classe IgG ed IgM vengono utilizzati test RIA ed ELISA.
Per l’isolamento virale il virus può essere isolato su leucociti o urine utilizzando colture di fibroblasti umani (viruria e viremia). Si possono ricercare su leucociti polimorfonucleati antigeni precoci (EA) o immediatamente precoci (IEA) utilizzando anticorpi monoclonali con metodica IFA (antigenemia).
IL VIRUS DELL’AIDS (HIV)
Nel 1981 negli USA vennero osservati in una popolazione di omosessuali maschi un complesso di sintomi che vennero definiti come sindrome da immunodeficienza acquisita (AIDS) causata da microrganismi opportunisti su una situazione di grave deficit immunitario.
Nel 1983 contemporaneamente sia in Francia che negli USA si identificò e isolò da pazienti affetti da AIDS un virus della famiglia dei Retrovirus considerato l’agente etiologico della sindrome: HIV (HUMAN IMMUNODEFICIENCY VIRUS).
L’HIV è il prototipo dei Lentivirinae, una delle tre sottofamiglie in cui sono divisi i Retroviridae che infettano l’uomo.
Si distingue dagli altri Retrovirus per la complessa struttura genomica e la capacità di esprimere differenti prodotti genici caratteristiche importanti nell’indurre lo stato di persistenza e di latenza.
Struttura e Replicazione
L’HIV è un Retrovirus umano il cui virione presenta al microscopio elettronico una forma quasi sferica con un Æ di 80-130 nm, costituito da un peplos con pleplomeri evidenti che racchiude un capside isometrico ;a sua volta quest’ultimo contiene un nucleo capside di probabile organizzazione elicoidale. La parte centrale densa (core) di forma cilindrica è avvolta da un rivestimento lipidico acquisito durante la gemmazione delle particelle virali delle cellule infette. Il virione contiene 7-8 proteine strutturali: le glicoproteine del peplos contengono antigeni specifici, mentre le proteine intere contengono antigeni di gruppo.
L’HIV possiede due copie di RNA genomico a singolo filamento 35 S con polarità positiva e quindi uguale a quella dell’RNA messaggero. L’RNA genomico contiene l’enzima trascrittasi inversa (p55-p61), l’endonucleasi (p32) e la proteina gag derivata che lega l’RNA (p9). Il core del HIV contiene 4 proteine del nucleocapside, p24, p17, p9, p7 che derivano dal taglio proteolitico del precursore di 53 Kd codificato dal gene gag. La proteina p24 forma la parte interna del nucleocapside mentre la p17 forma il guscio esterno ed è associata con la superficie interna del doppio strato lipidico. La proteina p7 si lega direttamente all’ RNA genomico e con la p9 forma il core. La glicoproteina extracellulare (gp120) e la transmembrana (gp41) si trovano nel pericapside sottoforma di complesso non covalente.
ORGANIZZAZIONE DEL GENOMA.
Il genoma dell’ HIV-1 oltre a tre geni strutturali (gag, pol, env) codifica per altri 8 geni.
REPLICAZIONE.
La replicazione avviene ad opera dell’enzima trascrittasi inversa presente nel virione. Essa inizia la trascrizione inversa (RNAàDNA) di ciascuna molecola di RNA del virus infettante in una molecola di DNA bicatenario che si integra nel genoma della cellula infetta dal quale poi viene trascritto, ad opera dell’ RNA polimerasi II della cellula, l’ RNA che provvede sia i messaggeri virus specifici sia i genomi per la nuova progenie virale. L’assemblaggio delle particelle virali neoformate avviene nel citoplasma insieme all’acquisizione del peplos mediante gemmazione.
MECCANISMI PATOGENETICI.
Le principali cellule bersaglio dell’HIV sono i linfociti T che esprimono il recettore CD4+, monociti ed i macrofagi.
Il virus viene internalizzato nella cellula mediante endocitosi cellulo-mediata o per fusione del virus con la membrana cellulare. La fusione coinvolge la proteina gp41
che si ancora allo strato lipidico del pericapside. La morte delle cellule è dovuta a meccanismi citopatici indotti dal virus con formazione di sincizi ed aumento della permeabilità della membrana cellulare. L’infezione da HIV può indurre nei linfociti persistentemente una riduzione dell’espressione del recettore CD4+ e della produzione di interleuchina 2 con diminuzione alla risposta agli antigeni e l’attivazione di altre cellule T.
MODALITA’ DI TRASMISSIONE DELL’INFEZIONE
Il virus dell’HIV determina negli individui infetti un’infezione latente cronica con scarsa sintomatologia clinica: Questa è la prima tappa di un processo che può durare anche anni e che può evolvere in un quadro patologico con conseguente riduzione del numero dei linfociti CD4+ che si conclude con la morte del paziente.
Il virus è presente nel sangue e nel liquido seminale dei soggetti HIV positivi; Si trasmette per contatto sessuale per esposizione al sangue ed ai prodotti derivati da esso o liquidi biologici . Si può ritrovare nella saliva, ma con scarsa potenzialità.Tra i tossicodipendenti
si può trasmettere attraverso la via intravenosa.
La trasmissione verticale da madre a figlio può venire per via transplacentare o nel
periodo perinatale, durante il parto e l’allattamento.
L’infezione primaria ha un periodo di incubazione di 3-6 settimane può decorrere asintomatica o manifestarsi con i sintomi della mononucleosi infettiva. Si riscontra in essa una elevata viremia con risposta immunitaria che riduce quest’ultima mentre il virus si localizza nei linfonodi.
Nei soggetti infetti si ha un calo di linfociti CD4+ circolanti , il quadro non diventa drammatico fino a che i linfociti T4 superano 5-600/mm3 .
Nell’infezione HIV-1 i linfociti T4 sono il miglior bersaglio del virus , ma il numero dei T4 non supera il 20 - 30% della popolazione totale ed è inspiegabile come possa verificarsi una totale distruzione anche perchè in condizioni normali vengono rimpiazzati. Si suppone pertanto che i T4 non infetti siano sequestrati ed indotti a una morte cellulare programmata. Proteine liberate da cellule infette funzionano da amplificatori del danno cellulare inducendo in cellule non infette la produzione di citochine in modo abnorme provocando disgregazione nei sistemi omeostatici che controllano la proliferazione cellulare. Sembrerebbe che le proteine virus specifiche, eliminate dalle cellule infette, interagendo con elementi cellulari non infetti inducano il manifestarsi di patologie che coinvolgono tutte le cellule.
SINTOMATOLOGIA
I primi sintomi si verificano quando la proliferazione virale nei linfonodi raggiunge livelli critici. Si hanno i seguenti stadi:
LAS - comparsa di linfoadenopatie persistenti.
ARC - calo ponderale, diarrea, astenia diminuzione dei linfociti T helper circolanti 3- 400\mm3, anemie ed altre emocitopenie periferiche.
AIDS - in concomitanza con l’ulteriore riduzione dei linfociti T-helper ad di sotto dei valori di 3-400\ mm3 inizia la fase di AIDS conclamata.
I linfonodi presentano gravi lesioni, il virus è presente nel sangue (viremia) seguono infezioni causate da agenti opportunisti o da altri virus che evolvono in forme gravi (toxoplasmosi viscerale - polmonite da Pneumocystis carinii, candidosi - polmoniti da entonylviris - Herpes simplex - Sarcoma di Kaposi - lesioni degenerative del sistema nervoso.
Nei neonati infetti nati da madre siero-positiva l’evoluzione della malattia è molto piu rapida e si conclude con la morte nei giro di 5-6 anni.
DIAGNOSTICA
L’indagine più indicata come test di screening è la ricerca degli anticorpi che viene effettuata con metodi immunoenzimatici (ELISA). Il test di conferma per L’ELISA è rappresentato dal Western blot dotato di elevatissima specificità ed il RIPA (radio immunoprecitazione) altro test di conferma sensibile e specifico. Il test per la rivelazione del virus sono: l’isolamento virale che viene effettuato su linfociti in coltura; vengono utilizzate poi metodiche di ibridazione degli acidi nucleici e la PCR per amplificare la quantità di acido nucleico virale.
TERAPIA
FARMACI |
MODALITA’ D’AZIONE |
Azidotimidina (AZT) Zidovudina |
Inibisce la trascrittasi inversa |
Dideoxycytidina (DDC) |
Inibisce la trascrittasi inversa |
Dideoxyinosina (DDI) |
Inibisce la trascrittasi inversa |
Fosfonoformato (Foscarnet) |
Inibisce la trascrittasi inversa |
Ribovirina |
Inibisce la trascrittasi inversa |
CD4 solubile |
Blocco del recettore virale (gp 120) |
a-interferone |
Diverse |
|
Inibitori della proteasi |
VIRUS EPATITICI
Premessa: negli ultimi 25 anni le conoscenze sull'epatite virale hanno avuto uno straordinario sviluppo, culminato nel 1988 con l'identificazione del virus C. Purtroppo per quanto riguarda la terapia, non esiste, a tutt'oggi una cura farmacologica specifica per l'epatite virale in fase acuta.
VIRUS DELL'EPATITE A (HAV)
Epidemiologia: le indagini sierologiche hanno permesso di constatare che la diffusione dell'infezione é ubiquitario, con tassi di prevalenza che variano col differire delle condizioni socio economiche, geografiche, climatiche ed ín relazione con la realizzazione di adeguate infrastrutture di igiene ambientale. Esistono quíndi Paesi a bassa prevalenza di anticorpi specifici (Paesi Scandinavi), a media prevalenza (Paesi Nord Americani) e popolazioni ad elevata prevalenza (Paesi dell'area Mediterranea, Paesi Africani e dell'Asia Orientale). In Italia l'incidenza dell'epatite virale acuta dal 1974 si é stabilizzata su 25.000/30.000 casi /anno, con netta differenza tra Nord, Sud ed Isole in cui fino al 90% della popolazione esaminata dimostra presenza di anticorpi contro il virus A.
L'infezione si trasmette per via oro-fecale, attraverso l'ingestione . dí acqua contaminata, frutta e verdura lavate male, frutti di mare consumati crudi.
Non esistono portatori cronici del virus A.
Eziologia: virus a RNA monocatenario, 27 nm, simmetria cubica, privo di involucro. Appartenente alla famiglia dei Picornavirus (Enterovírus), tipo antigene 72, é inattivato dalla formalina e dal cloro, dai raggi U.V. e da temperature superiori a 60°C, resiste all'etere, al congelamento e agli acidi.
Clinica: periodo di incubazione compreso tra 20 e 40 gg. 11 virus viene eliminato con le feci, con una concentrazione massima nel periodo che precede l'insorgenza dell'ittero; nell'infanzia la malattia é prevalentenlmente anitterica. La sintomatologia é simile a quella delle altre epatiti, guarisce nella maggior parte dei casi. Raramente evolve in epatite fulminante; non cronicizza mai.
Diagnosi: Diretta: (dimostrazione del virus)
- su materiale fecale (6-7 gg. prima dell'inizio dei sintomi)
- su sangue in fase acuta.
Piú frequentemente diagnosi sierologica: (ricerca nel sangue di Ab anti-HAV).
Precocemente (infezione acuta) Ig M che cominciano a comparire 3/4 settimane dopo l'infezione e possono essere presenti in circolo, anche se a basso titolo, fino a 12 mes¡. in convalescenza: IgG anti-HAV che persistono per oltre 6 mes¡ ed anche per tutta la vita.
Profilassi: Preinfezione: misure igieniche Ig umane (0.02-0.12 n-d/kg), vaccinazione (indicata nei viaggiatori in zone endemiche senza Ab anti-HAV nel sangue). Postesposizione: -globuline indicate nei familiari di soggetti con epatite A o in casi di epatite A epidemica.
VIRUS DELL"EPATITE B
Epidemiologia: nel mondo ci sono circa 300 milioni di portatori del virus B, con variazioni geografiche nella prevalenza: dallo 0.1% de¡ Paesi Anglosassoni al 20% e più dei Paesi Africani ed Oriental¡. In Itali a la prevalenza é del 4-5%.
L'infezione avviene in tre modi:
l) trasmisione orizzontale (passaggio da un individuo affetto da malattia o portatore sano ad uno non immunizzato). Le categorie di persone a rischio sono medici e personale paramedico, emotrasfusi, emodializzatí, tossicodipendenti.
2) Trasmissione verticale (dalla madre al figlio, si verifica al momento della nascita nel periodo immediatamente post-natale.
3) Trasmissione per via sessuale.
Eziologia: virus a DNA circolare a doppia elica incompleta (0 42 nm), resistenti al congelamento, all'etere a temperatura di 60 'C, ai raggi U.V.; inattivabile ad alte temperatura 121 'C e dal trattamento con acidi,
Appartiene alla famiglia degli Hepadnavirus provvisto di peplos con specificitá antigenica di gruppo.
Clinica: incubazione da 30 a l80gg; nei casi tipici la malattia dura pochi mesi ed è frequente il decorso sub-clinico anitterico. Possono manifestarsi forme con decorso prolungato e recidivante e forme colestatiche. Cronicizza in modo variabile secondo l'etá: neonato 75%, bambino 50%, adulto meno del 5%. Puó evolvere in cirros¡ epatica ed epatocarcinoma.
Diagnosi: metodi radioimmunologici ed inununoenzimatici in microscopio elettronica (ricerca Ag):
l) particelle rotondeggianti (0 42=) virioni completi detti "particelle di Dane".
2) particelle tubolari o sferoidali piú piccole, prive di strutturazione interna (0 22nm)
detti "gusci vuoti": HBsAg (prímo marcatore a comparire nel siero si evidenzia un mese prima delle manifestazioni cliniche).
3) HBcAg (Core Antigene) é il piú importante Ag espresso sul nucleocapside: non è determinabile nel sangue ma solo negli epatociti con biopsia epatica.
4) HBeAg: componente solubile del nucleocapside virale
Metodiche biochimiche ricerca negli epatociti nel siero di attivitá della DNA polimerasi del'HBV (presenza del virus nella sua forma completa)
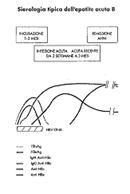
Markers:
HBsAg: (Antigene Australía) compare nel sangue un mese prima delle manifestazioni cliniche. Il virus si sta replicando negli epatociti e libera nel sangue involucrí in eccesso.
HBcAg: (antigene core) é presente negli epatociti dopo un mese dall'infezione, quando la replicazione del vírus ha raggiunto un livello critico e le particelle virali complete sono presenti in circolo. E' presente negli epatociti per tutto il periodo della malattia.
Ab-anti HBs: dimostrabili solo nella convalescenza. Prima di classe IgM (scompaiono rapidamente), poi di classe IgG (persistono per molti anni), il paziente è immune e non contagia.
Ab-Anti HBc: compaiono nel sangue all'inizio della fase clinica dell'epatite prima di classe lgM poi di classe IgG.
N.B Nel periodo compreso tra scomparsa dell'HBsAg e comparsa dell'Ab-AntiHBs, gli Ab-AntiHBc di tipo IgM possono costituire l'unico marker sierologico di una recente infezione da virus B (Finestra di convalescenza o core window).
HBeAg: (antigene e) dimostrabile nel sangue giá all'inizio della fase clinica scompare peró rápidamente.
Ab-AntiHBe: compaiono dopo gli Anti HBc e persistono per alcuni anni.
N.B. La persistenza di HBsAg e-HBeAg nel sangue sta ad indicare la presenza del virus nell'organismo e quindi la possibilitá di contagio (probabilmente anche una maggiore tendenza alla cronicizzazione).
Profilassi: Pre-esposizione: vaccinazione (vaccino prodotto con la tecnica del DNA ricombinante) indicata in tutti i soggetti HBsAg e anti-HBs negativi appartenenti a categorie a rischio. Essa é obbligatoria in Italia dal 1992.
Post-esposizione globuline iperimmuni associate alla vaccinazione
VIRUS DELL'EPATITE C
Epidemiologia: in passato denominata epatite non A-non B, é diffusa in tutto il mondo e ad essa si può attribuire circa il 30% delle epatiti virali acute. La fonte di infezione é costituita dal sangue e dagli emoderivati. La trasmissione é simile a quella dell' HBV. Categorie a rischio sono: i politrasfusi, gli emodializzati e i tossicodipendenti. E' stato il diffondersi dell'AIDS che ha riportato drammaticamente in primo piano la virulenza dell'epatite C.
Eziologia: virus a RNA monocatenario (0 60nm), appartenente ai Flavivirus.
Clinica: periodo d'incubazione variabile da 2 settimane a 6 mesi. La forma post trasfusionale é piú spesso un'epatite subclinica anitterica. La forma sporadica puó dar luogo a forme colestatiche di lunga durata. Alta tendenza alla cronícizzazione e all’evoluzione in cirrosi (20%). Può dar luogo ad epatiti fulminanti ad elevata mortalitá.
Diagnosi: sierologia: Ab anti-HCV che compaiono nel sangue dopo 1-3 mesi dall'esordio clinico dell'epatite.
Identificazione dei diversi genotipi grazie ad una procedura di PCR specifica.
Profilassi: somministrazione di globuline standard.
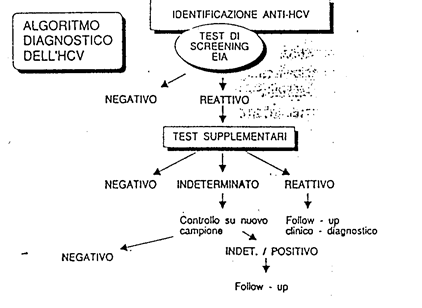
Algoritmo diagnostico dell'HCV.
VIRUS DELL"EPATITE D
Epidemiologia: comune in Italia, nelle zone mediterranee, nel Medio Oriente ed in aree isolate del Sud America. Il virus delta si sta diffondendo sempre di piú negli USA e nell'Europa Settentrionale: in Svezia I'HVD, comparsa nei tossicodipendenti nel 1973, ha raggiunto nel 1981 -oltre i 2/3 di questa popolazione. Si calcola che almeno il 5% dei portatori cronici di HBsAg siano infettati dal virus delta. La trasmissione dell'infezione é simile a quella dell'HBV, peró la trasmissione verticale materno-fetale sembrerebbe rara.
Eziologia: piccolo virus (0 35 nm) ad RNA, defettivo perché necessita della presenza del virus B (virus helper) per la sua replicazione. (I1 rivestimento del virus delta è dato dall'HBsAg).
Clinica: l'epatite delta non avviene in assenza di HBsAg nel sangue. L'infezione acuta puó avvenire in due modi:-coinfezione (epatite acuta contemporanea B+D)
- superinfezione (epatite acuta delta in portatore cronico di HBsAg).
Nella coinfezione il virus D non sembra aumentare il -rischio di evoluzione cronica dell'epatite B, ma provoca epatiti fulminanti in una percentuale maggiore rispetto a quelle da HBV. Nei casi di superinfezione il vírus D aumenta la gravitá delle lesioni epatiche.
Sierologia: nel caso di coinfezione dopo il periodo di incubazione compare nel siero l'antigene HBs e delta. La durata dell'antigenemia delta é variabile peró generalmente é breve. Utile la ricerca di anticorpi anti HDV IgM e lgG. Nel caso di superinfezione in un portatore cronico di HBsAg, dopo 3-8 settimane dall'ínfezione compare nel siero l'antigene D.
Profilassi: mancando una profilassi attiva o passiva é fondamentale la prevenzione dell'epatite B con la vaccinazione.
VIRUS DELLEPATITE E
Epidemiologia: anche detta epatite NANB epidemica. E' diffusa nei paesi in via di sviluppo. La prima epidemia fu osservata in India nel 1956, probabilmente dovuta ad acqua contaminata. La trasmissione dell'infezione avviene per via oro-fecale, colpisce soprattutto soggetti fra i 15 e i 40 anni. Sono stati descritti casi sporadici nelle regioni occidentali ma solo in viaggiatori in zone endemiche.
Eziologia: virus a RNA ad elica singola (0 27-38 n-m) privo di "envelope",
appartenente alla famiglia dei Calicivirus.
Clinica: l'epatite E possiede una stagionalitá invernale e primaverile (simile alla A); il periodo di incubazione va da 2 a 9 settimane. Non sono mai state osservate forme croniche di HEV mentre sono possibili forme subcliniche. L'epatite presenta un'alta mortalitá (10-20%) in donne gravide.
Sierologia: il virus é stato identificato nelle-feci di soggetti con HEV epidemica. Utile è la ricerca di anticorpi HEV e la ricerca di antigeni specifici.
fonte: http://www.microbiologia.unige.it/dpb/Appunti/15%20Viruspeciale.DOC
sito web: www.microbiologia.unige.it
Autore del testo: non indicato nel documento di origine
Virologia generale
Visita la nostra pagina principale
Virologia generale
Termini d' uso e privacy