Tabla periódica de los elementos químicos completa
Tabla periódica de los elementos químicos completa
Ayúdanos a hacernos saber Larapedia.com informó a un amigo / amiga o marcado nuestro sitio web en tu blog o foro marcadores sociales como Facebook eTwitter, gracias
Los siguientes textos son propiedad de sus respectivos autores y les damos las gracias por la oportunidad que nos brindan para presentar gratis a estudiantes, profesores y usuarios de la Web para sus textos ilustrativos con fines educativos y científicos.
La información en la medicina y la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede sustituir en ningún caso el consejo de un médico (o una persona legalmente autorizada para la profesión).
Tabla periódica de los elementos químicos completa
1.2 Características de la clasificación periódica actual de los elementos químicos.
INTRODUCCIÓN
¿Por qué determinados elementos tienen propiedades semejantes? esta pregunta se puede contestar con la moderna teoría atómica en función de las estructuras electrónicas. Elementos diferentes cuyos átomos tienen estructuras electrónicas semejantes en sus capas externas o niveles de valencia tienen muchas propiedades químicas en común. Esta idea que relaciona la semejanza en las estructuras con la semejanza en las propiedades es la base de la ley periódica
- CLASIFICACIONES PERIÓDICAS INICIALES
Los científicos ven la necesidad de clasificar los elementos de alguna manera que permitiera su estudio más sistematizado. Para ello se tomaron como base las similaridades químicas y físicas de los elementos. Estos son algunos de los científicos que consolidaron la actual ley periódica:
Johann W. Dobeneiner: |
Hace su clasificación en grupos de tres elementos con propiedades químicas similares, llamadas triadas. |
John Newlands: |
Organiza los elementos en grupos de ocho u octavas, en orden ascendente de sus pesos atómicos y encuentra que cada octavo elemento existía repetición o similitud entre las propiedades químicas de algunos de ellos. |
Dimitri Mendeleiev y Lothar Meyer: |
Clasifican los elementos en orden ascendente de los pesos atómicos. Estos se distribuyen en ocho grupos, de tal manera que aquellos de propiedades similares quedaban ubicados en el mismo grupo. |
- TABLA PERIÓDICA
En 1913 Henry Moseley basándose en experimentos con rayos x determinó los números atómicos de los elementos y con estos creó una nueva organización para los elementos.
Ley periódica: → |
" Las propiedades químicas de los elementos son función periódica de sus números atómicos " |
Lo que significa que cuando se ordenan los elementos por sus números atómicos en forma ascendente, aparecen grupos de ellos con propiedades químicas similares y propiedades físicas que varían periódicamente.
- ORGANIZACIÓN DE LA TABLA PERIÓDICA
Los elementos están distribuidos en filas (horizontales) denominadas períodos y se enumeran del 1 al 7 con números arábigos. Los elementos de propiedades similares están reunidos en columnas (verticales), que se denominan grupos o familias; los cuales están identificados con números romanos y distinguidos como grupos A y grupos B. Los elementos de los grupos A se conocen como elementos representativos y los de los grupos B como elementos de transición. Los elementos de transición interna o tierras raras se colocan aparte en la tabla periódica en dos grupos de 14 elementos, llamadas series lantánida y actínida.
La tabla periódica permite clasificar a los elementos en metales, no metales y gases nobles. Una línea diagonal quebrada ubica al lado izquierdo a los metales y al lado derecho a los no metales. Aquellos elementos que se encuentran cerca de la diagonal presentan propiedades de metales y no metales; reciben el nombre de metaloides.
Metales: |
Son buenos conductores del calor y la electricidad, son maleables y dúctiles, tienen brillo característico. |
No Metales: |
Pobres conductores del calor y la electricidad, no poseen brillo, no son maleables ni dúctiles y son frágiles en estado sólido. |
Metaloides: |
Poseen propiedades intermedias entre Metales y No Metales. |
- LOCALIZACIÓN DE LOS ELEMENTOS
Las coordenadas de un elemento en la tabla se obtienen por su distribución electrónica: el último nivel de energía localiza el periodo y los electrones de valencia el grupo.
Elementos representativos: |
Están repartidos en ocho grupos y se caracterizan porque su distribución electrónica termina en s-p o p-s. El número del grupo resulta de sumar los electrones que hay en los subniveles s ó s y p del último nivel. |
EJEMPLO: localice en la tabla periódica el elemento con Z= 35
La distribución electrónica correspondiente es: |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 |
la cual en forma ascendente es ; |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 |
El último nivel de energía es el 4, por lo tanto el elemento debe estar localizado en el cuarto periodo. El grupo se determina por la suma 2+5=7, correspondiente al número de electrones ubicados en el último nivel, lo cual indica que el elemento se encuentra en el grupo VII A.
Algunos grupos representativos reciben los siguientes nombres:
Grupo IA: |
Alcalinos |
Grupo IIA |
Alcalinotérreos |
Grupo VIIA: |
Halógenos |
Grupo VIIIA: |
Gases nobles |
Elementos de transición: |
Están repartidos en 10 grupos y son los elementos cuya distribución electrónica ordenada termina en d-s. El subnivel d pertenece al penúltimo nivel de energía y el subnivel s al último. El grupo está determinado por la suma de los electrones de los últimos subniveles d y s. |
Si la suma es 3, 4, 5, 6 ó 7 el grupo es IIIB, IVB, VB, VIB,VIIB respectivamente. Si la suma es 8, 9 ó 10 el grupo es VIIIB primera, segunda o tercera columna respectivamente. Y si la suma es 11 ó 12 el grupo es IB y IIB respectivamente.
EJEMPLO: localice en la tabla periódica el elemento con Z= 47
La distribución electrónica correspondiente es: |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 4p6 5s2 4d4 |
la cual en forma ascendente es ; |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d4 5s2 |
El último nivel de energía es el 5, por lo tanto el elemento debe estar localizado en el quinto periodo. El grupo se determina por la suma 9+2=11, lo cual indica que el elemento se encuentra en el grupo I B.
Elementos de tierras raras: |
Están repartidos en 14 grupos y su configuración electrónica ordenada termina en f-s. Es de notar que la serie lantánida pertenece al periodo 6 y la actínida al periodo 7 de la tabla periódica. |
LOCALIZACIÓN DE LOS ELEMENTOS EN LA TABLA

- COMPORTAMIENTO DE LAS PROPIEDADES EN LA TABLA:
Radio atómico: Es una medida del tamaño del átomo. Es la mitad de la distancia existente entre los centros de dos átomos que están en contacto. Aumenta con el periodo (arriba hacia abajo) y disminuye con el grupo (de derecha a izquierda).
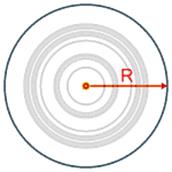 |
El radio atómico dependerá de la distancia al núcleo de los electrones de la capa de valencia |
Energía de ionización: Es la energía requerida para remover un electrón de un átomo neutro. Aumenta con el grupo y disminuye con el período.
Electronegatividad: Es la intensidad o fuerza con que un átomo atrae los electrones que participan en un enlace químico. Aumenta de izquierda a derecha y de abajo hacia arriba.
Afinidad electrónica: Es la energía liberada cuando un átomo neutro captura un electrón para formar un ion negativo. Aumenta de izquierda a derecha y de abajo hacia arriba.
VARIACIÓN DE LAS PROPIEDADES PERIÓDICAS
Tabla Periódica Actual
En 1927 Henry Moseley descubre un modo práctico de hallar los números atómicos, se utiliza un criterio para ordenar a los elementos químicos.
Se enunció: “Las propiedades físicas y químicas de los elementos son funciones periódicas de los números atómicos”.
- Es decir los elementos están ordenados en función creciente de sus números atómicos.
- La tabla periódica actual (forma larga) fue diseñada por Werner y es una modificación de la tabla de Mendeleiev.
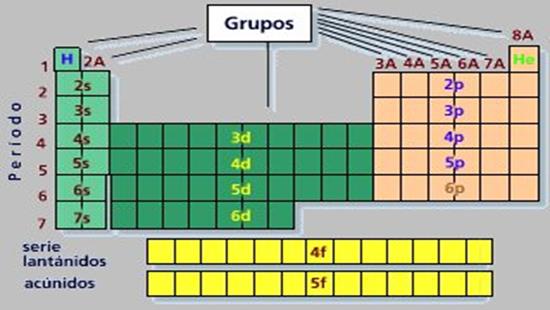
Descripción: Los elementos se hallan distribuidos:
- En 7 filas denominadas (periodos).
- En 18 columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.
PERIODOS: Son las filas horizontales, nos indican el último nivel de energía del elemento. Existen 7 periodos o niveles.
- Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos respectivamente, son denominados Periodos cortos.
- Periodos 4, 5 y 6 son los Periodos largos, el 7º periodo se halla incompleto.
- Los elementos cuyos números atómicos se hallan comprendidos entre el La (Z= 57) y el Lu (Z= 71) se llaman Lantánidos.
- Los elementos con número atómico superior al Ac (Z= 89) se denominan Actínidos.
- Ellos se encuentran separados en 2 filas de la tabla periódica, con el objeto de no extender demasiado la figura.
- Los elementos después del Uranio (Z= 92) se han obtenido en forma artificial del uranio, denominándose a éstos Trans uránicos.
GRUPOS O FAMILIAS: Son agrupaciones verticales, que nos indican que poseen propiedades químicas semejantes, debido a que poseen los mismos electrones de valencia.
En la tabla periódica están ordenados en grupos A y B.
a) GRUPO A:
- Están situados en los extremos de la tabla periódica.
- Nos indican el número de electrones de la última capa y se representan en números romanos.
- Terminan en el subnivel “s” y “p”

a) GRUPO B:
- Están situados en la zona central de la tabla periódica.
- El número de electrones de la última capa, no nos indica el grupo; debido a que la valencia es variable.
- La configuración electrónica termina en el subnivel “d”.
- Los elementos de transición interna, llamados tierras raras: su configuración electrónica termina en “f”.
Tienen 8 subgrupos. El grupo VIII B tiene 3 casilleros.
Clasificación de los elementos químicos
Los elementos químicos se pueden clasificar en: Metales, no metales, metaloides (anfóteros) y gases nobles.
Metales:
- Son buenos conductores del calor y la electricidad.
- Se oxidan (pierden electrones).
- Se les denomina también reductores.
- Son electropositivos.
- Son sólidos a excepción del mercurio (líquido a temperatura ambiente).
No metales:
- Son malos conductores del calor y la electricidad.
- Se reducen (ganan electrones).
- Se les denomina también oxidantes.
- Son electronegativos.
- La mayoría a temperatura ambiente se encuentran en estado sólido. Como gases están N, O, F, Cl, H y en estado líquido el Br.
Metaloides o anfóteros:
Son elementos que tienen propiedades metálicas y no metálicas. Ocupan una región diagonal que se observa en la tabla periódica (transición entre metal y no metal); entre ellos podemos encontrar al B, Si, Ge, As, Sb, Te, Po.
Gases nobles:
- Son elementos químicamente estables por tener su última capa 8 e- a excepción del He que tiene 2 y se representan.
n s2 p6 - No se combinan con ningún otro elemento. Sólo a temperaturas exigentes el Xe puede reaccionar.
- Sus moléculas son monoatómicas.

De acuerdo a su configuración electrónica, los elementos químicos se clasifican en: gases nobles, elementos representativos y elementos de transición.
1. Gases nobles: Son los que se ubican en el extremo derecho de la tabla periódica, en el grupo 0, u VIII A (también 18). Los átomos de estos gases, con excepción del helio, tienen 8 electrones de valencia. Esto significa que el último nivel de energía tiene sus orbitales completos (8 e-), distribuidos según la configuración n s2 p6. Donde "n" representa el nivel de energía más externo.
2. Elementos representativos: Se ubican en los grupos A de la tabla periódica. Estos elementos tienen sus electrones de valencia en los orbitales "s" o "p" y sus configuraciones externas van desde n s1 hasta n s2 p5, excluyendo al 1s2 (helio que corresponde a un gas noble).
3. Elementos de transición: Se sitúan en los grupos B de la tabla periódica. Sus átomos presentan configuraciones más complejas; los electrones de valencia se encuentran en los orbitales "d" o "f".

Fuente del documento :http://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r54292.DOC
Sitio para visitar: http://www.itescam.edu.mx/
Autor del texto: no especificado en el documento de origen o se indique en el texto
Palabras clave de Google: Tabla periódica de los elementos químicos completa Tipo de Archivo: doc
Si usted es el autor del texto anterior y se compromete a no compartir sus conocimientos para la enseñanza, la investigación, la erudición (para uso razonable como indicato en los Estados Unidos copyrigh bajo "for fair use as indicated in the United States copyrigh low"), por favor envíenos un e-mail, y procederemos a eliminar el texto rápidamente.
Tabla periódica de los elementos químicos completa
![]()
Si desea acceder rápidamente a páginas relacionadas con un tema específico, como Tabla periódica de los elementos químicos completa utilizar el motor de búsqueda siguiente:
Visite la página principal
Tabla periódica de los elementos químicos completa
Condiciones generales de "uso y aviso legal
Este sitio no es una agencia de noticias que se actualiza sin ningún tipo de periodicidad, únicamente sobre la base de la disponibilidad del material, por lo que no es un producto sujeto a la disciplina editorial en el arte. 1, párrafo III de la Ley no. 62 de 07.03.2001. Los resúmenes, notas, letras de canciones y citas contenidas en este sitio están disponibles de forma gratuita a los estudiantes, investigadores, profesores, técnicos ilustrativos con fines educativos y científicos con el concepto de uso justo y con miras al cumplimiento de la Directiva Europea 2001/29 / CE y del Derecho. Artículo 633. Dlg 70 y 68. El sitio está dirigido y coordinado por el autor únicamente con fines informativos y educativos. Si bien creemos que las fuentes utilizadas fiable, el autor de este sitio no puede garantizar la exactitud e integridad de la información y por lo tanto se exime de cualquier responsabilidad derivada de los problemas o daños causados por errores u omisiones, si tales errores u omisiones resultantes de negligencia , accidente u otra causa. Todas las notas, citas de los textos e imágenes son propiedad de sus respectivos autores o estudios que poseen los derechos, si los beneficiarios se consideraron dañados por la inclusión de los archivos anteriores en este sitio o se habían introducido inadvertidamente imágenes, información, texto o material con derechos será retirado de inmediato, y / o se hará referencia a las fuentes de la simple advertencia y 'e-mail en la página de contacto.
Los objetivos de este sitio son los avances de la ciencia y las artes útiles porque pensamos que son muy importantes para nuestro país los beneficios sociales y culturales de la libre difusión de la información. Toda la información e imágenes en este sitio se utilizan aquí únicamente con fines educativos, cognitivos e informativos. La información en la medicina y la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede sustituir en ningún caso el consejo de un médico (o una persona legalmente autorizada para la profesión). En este sitio hemos hecho todo lo posible para garantizar la exactitud de herramientas, calculadoras e información, no podemos hacer una garantía ni se hace responsable de los errores que se han hecho, los textos utilizados fueron tomados de los sitios que han puesto en disponible de forma gratuita para darlas a conocer en la web con fines educativos. Si usted encuentra un error en esta página web, o si tiene un texto o herramienta que pueda violar las leyes aplicables de derechos de autor, por favor notifique a nosotros por e-mail y rápidamente lo eliminará.
Para más información importante acerca de los términos de "el uso del sitio y leer las políticas de privacidad cuidadosamente el texto en el siguiente enlace (en italiano):
