Proteinas e aminoácidos bioquimica resumo
Proteinas e aminoácidos bioquimica resumo
Ajude-nos a deixar-nos saber Larapedia.com relatou a um amigo / amiga ou relatar nosso site fórum sobre seu blog ou bookmarks sociais como o Facebook eTwitter, graças
Los siguientes textos son propiedad de sus respectivos autores y les damos las gracias por la oportunidad que nos brindan para presentar gratis a estudiantes, profesores y usuarios de la Web para sus textos ilustrativos con fines educativos y científicos.
La información en la medicina y la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede sustituir en ningún caso el consejo de un médico (o una persona legalmente autorizada para la profesión).
Proteinas e aminoácidos bioquimica resumo
- Proteínas
“Ó Deus, dá-me a serenidade para aceitar as coisas que não posso mudar; a coragem para mudar as coisas que posso e a sabedoria para discernir uma das outras...”
Anônimo
5.1. Introdução
Proteína é um vocábulo derivado de Proteus (grego) que significa primazia. Assim, as proteínas cujo nome significa “primeiro” ou “mais importante”, são de fato as macromoléculas mais importantes das células. Aproximadamente a metade do peso seco de uma célula animal típica é proteína.
Porque são as proteínas as principais?
As proteínas, assim como os hidratos de carbono e as gorduras, contêm carbono, hidrogênio e oxigênio, mas adicionalmente elas contêm cerca de 16% de nitrogênio, juntamente com o enxofre e algumas vezes outros elementos como fósforo, o ferro e o cobalto. Foi a primeira substância reconhecida em seres vivos. Proteínas são polímeros constituídos de aminoácidos. Há vinte tipos de aminoácidos na natureza. Esse número relativamente pequeno de aminoácidos constitui todas as proteínas existentes nos seres vivos. O que permite que as proteínas sejam diferentes umas das outras é a ordem dos aminoácidos e a freqüência de sua ocorrência. A função biológica da proteína é ditada pela seqüência dos aminoácidos. Assim, se determinado aminoácido é substituído por outro, a proteína pode perder sua atividade biológica.
Como todo aminoácido possui um radical amínico (NH2 ou NH3), essa relação do percentual de nitrogênio é importante e será utilizada em alguns métodos para determinar a qualidade da proteína:
100 g de proteína 16 g de Nitrogênio
X 01 g de Nitrogênio
X = 6,25 g de proteína.
5.2. Funções
Como vimos anteriormente, as moléculas de proteínas são polímeros cujas unidades estruturais são os aminoácidos.
Embora todas as proteínas sejam construídas com os mesmos 20 aminoácidos, são elas os compostos biológicos que possuem a maior diversidade de funções. Sua versatilidade funcional é talvez melhor exemplificada pelo fato de que cada uma das milhares de enzimas, catalisando uma reação biológica específica, é uma proteína específica. Assim, diferentes enzimas participam em reações diferentes como: a formação de uma ligação carbono-carbono, a hidrólise de um éster, a oxidação de um álcool, a hidroxilação de um anel aromático... Isso para mencionar apenas algumas poucas. Mas, a versatilidade das proteínas vai muito além de seu papel como catalisadores biológicos:
. As proteínas são os instrumentos através dos quais é expressa a informação genética. Assim como existem milhares de genes no núcleo celular, cada um especificando uma característica distintiva do organismo existe, correspondentemente, milhares de diferentes espécies de proteínas na célula, cada uma executando uma função específica determinada pelo seu gene;
. As proteínas podem servir como carregadoras, cada uma delas transportando uma substância específica como o oxigênio, um íon metal ou um metabólico através do corpo;
. Outras proteínas ancoradas em membranas biológicas são receptores para compostos específicos que funcionam na regulação celular, incluindo o transporte de moléculas para dentro e para fora da célula;
. Podem cumprir uma função energética;
. Alguns hormônios são proteínas e ajudam a regular uma variedade de processos celulares;
. As proteínas do sistema imune defendem o organismo contra infecções;
. As proteínas da coagulação sangüínea defendem o organismo contra perdas;
. Outras proteínas especializadas estão envolvidas em prover motilidade ao organismo;
. Algumas proteínas tem um papel estrutural;
. etc., etc., etc.
5.3. Aminoácidos
É extraordinário que todas as proteínas, em todas as espécies, independentemente da sua função ou atividade biológica, sejam construídas com o mesmo grupo de 20 aminoácidos primários. O que, então, confere a uma proteína atividade enzimática, a outra atividade hormonal, e função de anticorpo a outras? Como elas diferem quimicamente?
As proteínas diferem umas das outras porque cada uma delas tem uma seqüência distinta de unidade de aminoácidos. Os aminoácidos são o alfabeto da estrutura protéica, pois eles podem ser agrupados em um número quase infinito de diferentes proteínas.
. “Quantas seqüências de aminoácidos são possíveis? “
Existem milhares de proteínas diferentes em um organismo de cada espécie, e há, talvez, 10 milhões de espécies diferentes. Apenas 20 aminoácidos podem realmente ser reunidos nas seqüências diferentes
A matemática pode nos dizer:
. Considerando um dipeptídeo (estrutura formada pela ligação de dois aminoácidos distintos ou não) contendo dois aminoácidos diferentes, pode haver dois isômeros seqüenciais; um tripeptídeo com 3 aminoácidos diferentes A, B e C tem seis arranjos seqüenciais possíveis: ABC, ACB, BAC, CAB, CBA. A expressão geral para calcular o número de seqüências, possíveis de um conjunto de objetos é n!, onde n é o número de objetos. Para um peptídeo de quatro aminoácidos diferentes nós teremos 4! = 4x3x2x1 = 24 seqüências possíveis. Para polipeptídeo de 20 aminoácidos diferentes, cada um ocorrendo só uma vez, o número de seqüências é 20! = 20x19x18... o que chega ao surpreendente número próximo a 2x1018 .
Mas isso é apenas um peptídeo muito pequeno, com 20 resíduos de PM (Peso Molecular) próximo a 2.600... Para uma proteína de PM 34.000, contendo 12 diferentes aminoácidos, em números iguais, mais de 10.000.000 seqüências são possíveis. Se ainda admitirmos que essa proteína seja feita com 20 aminoácidos ocorrendo em números iguais, o número de seqüências possíveis será muitíssimo maior. Se existisse apenas uma molécula de cada isômero seqüencial possível desta proteína, o peso total excederia muito o peso da terra!
Vinte dos aminoácidos podem, portanto, ser arranjados em seqüências suficientes para suprir não apenas as milhares de proteínas em cada uma das espécies viventes, mas também para todas as espécies que já existiram no passado ou que existirão no futuro. Acredita-se que as espécies atuais representem apenas um milésimo de todas as que já existiram na terra. A lógica molecular de aminoácidos e proteínas é amplamente suficiente para a sempre divergente natureza da evolução biológica.” (LEHNINGER, 1984 pág. 91).
É por isso que as proteínas têm a primazia, como o próprio nome diz.
Assim, pois, os aminoácidos são as unidades fundamentais da estrutura protéica. Todos os aminoácidos contêm pelo menos um grupo amino (-NH2) na posição a e uma carboxila, e todas com exceção da glicina, contêm um átomo assimétrico.
Devido à presença do carbono assimétrico, os aminoácidos podem existir como isômeros. Os de ocorrência natural são quase todos L.
Em certos tipos de processamentos de proteínas, como aquecimento em meio alcalino, ou à temperatura muito elevada, pode ocorrer a isomerização dos aminoácidos, com transformação da forma L em D. Isso tem importância nutricional, pois, vários aminoácidos D não são aproveitados pelo organismo ou o são em menor velocidade, a D-metionina e a D-phe, por exemplo são aproveitadas pelo organismo do homem, mas de forma menos eficientemente que nas formas L.
Aminoácidos encontrados nas proteínas:
- Alanina - Ala
- Gicina - Gly
- Valina - Val
- Leucina - Leu
- Isoleucina Ile
- Prolina - Pro
- Cisteína - Cyz
- Tirosina - Tyr
- Aspararagina Asn
- Glutamina - Gln
- Ác. Aspartico Asp
- Ác. Glutâmico Glu
- Fenilalanina Phe
- Triptofano Trp
- Metionina Met
- Serina - Ser
- Treonina - Thr
- Lisina - Lys
- Arginina - Arg
- Histidina - Hys
Os aminoácidos se unem para formar proteínas por meio de ligações peptídicas:
 O H H
O H H
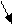 H2N-CH-C + N-CH-COOH à H2N-CH-C-N-CH-COOH
H2N-CH-C + N-CH-COOH à H2N-CH-C-N-CH-COOH
R1 OH H R2 R1 O R2
H2O
Aminoácidos essenciais:
A proteína da dieta é a fonte para os 20 aa comuns encontrados nas proteínas dos tecidos. Oito desses (Lys, Met, Thr, Trp, Phe, Val, Leu, Ile) são essenciais na dieta do homem adulto, porque seus esqueletos de carbono não podem ser sintetizados no corpo a velocidades adequadas. Um outro aa, a Hys, é necessário para as crianças e há trabalhos recentes que ele também seja essencial para adultos. Além disso, dois aminoácidos, a Cys e a Tyr são feitos a partir dos aminoácidos essenciais Met e Phe, respectivamente, e se presentes na dieta, são economizadores de seus aa de origem. (Ver no mapa metabólico).
Cisteína: As reações envolvidas na síntese de Cys ocorrem no fígado e são elas:
1. Perda de um grupo metil da metionina, transformando-a em homocisteína
2. Condensação da homocisteína com uma molécula de serina
3. Clivagem da cistationina
Tirosina: A biossíntese da Tyr em mamíferos ocorre por hidroxilação da fenilalanina. Muito das necessidades dietéticas de fenilalanina é, de fato devida a necessidade de Tyr. Se esta última é ingerida, o requerimento dietético para Phe é reduzido substancialmente.
Os restantes nove aminoácidos (Gly, Ala, Ser, Asp, Glu, Pro, Arg, Asn, Glu) são formados a partir de intermediários comuns no metabolismo e assim são não essenciais como constituintes dietéticos.
De acordo com os aminoácidos que possuem, as proteínas podem ser classificadas em:
Completas ou equilibradas. São primordialmente de origem animal (carnes, ovos, leite), correspondendo àquelas que contêm um perfil de aminoácidos equilibrado tanto quantitativa quanto qualitativamente;
Incompletas. São as que apresentam deficiências em um ou mais dos aminoácidos essenciais; esse aminoácido que está em falta ou em quantidades insuficientes é chamado fator limitante. As proteínas de origem vegetal pertencem a esta categoria;
Exceções: a gelatina e a globina do sangue embora de origem animal, são incompletas.
De uma forma geral o fator limitante principal (o que apresenta maior deficiência) nos cereais é a lisina. No arroz além da lisina, temos a treonina como fator limitante. No milho o triptofano. Assim, diz-se que a treonina no arroz e o triptofano no milho são fatores limitantes secundários.
- Estrutura das Proteínas
As proteínas têm diversos níveis de organização, a saber:
Estrutura Primária
A estrutura primária refere-se ao tipo e a seqüência dos aminoácidos na molécula protéica. Conhecer a estrutura primária de uma proteína é importante por algumas razões:
- é a seqüência de aa. de uma proteína que irá determinar as outras estruturas;
- conhecendo a estrutura primária poderemos fazer uma previsão do seu valor nutricional, como acabamos de ver;
- a estrutura primária nos informará a respeito da digestibilidade da proteína, pois as enzimas do trato digestivo são específicas para determinadas seqüências de aminoácidos.
Estrutura Secundária
A estrutura secundária é a conformação da proteína no espaço. Ela é formada por associação de membros próximos da cadeia polipeptídica e é mantida por pontes de hidrogênio e por pontes de enxofre. Ex.: proteínas fibrosas em forma de hélice.
Estrutura Terciária
A estrutura terciária é a forma como a estrutura secundária se arranja, se dobra e se enovela, formando as estruturas globulares rígidas.
O aquecimento dos alimentos, em geral, aumenta a digestibilidade das proteínas, porque destrói a conformação espacial, facilitando o ataque das enzimas do trato digestivo.
Esse processo de alteração da estrutura tridimensional de uma proteína é chamado de desnaturação. A desnaturação, na prática, pode ser reversível ou não.
Assim, tanto na culinária, como na indústria de alimentos a desnaturação é muito usada.
5.5 Classificação das Proteínas
As proteínas podem ser classificadas de diversos modos, obedecendo a critérios diferentes.
De acordo com a complexidade teríamos:
Proteínas simples:
As proteína simples são aquelas que, por hidrólise, fornecem apenas aminoácidos. As proteínas simples podem ser:
Proteínas fibrosas
Cadeias polipeptídicas que se organizam em um arranjo paralelo ao longo de um eixo, formando fibras ou filamentos. São pouco solúveis, de consistência rígida e têm normalmente função estrutural.
Ex.: colágeno, elastina e queratina.
O colágeno é a principal proteína do tecido conjuntivo. Ë insolúvel em água a frio e resistente às enzimas digestivas animais, porém, submetido à fervura em água, soluções de ácidos ou bases diluídas, transforma-se em gelatina. É essa transformação que faz o amaciante de carnes por cocção, pois 30% das proteínas totais dos mamíferos são constituídas de colágeno. Uma característica notável do colágeno é o seu elevado teor de hidroxiprolina, glicina e de prolina. O colágeno, porém, é pobre em aminoácidos de interesse nutricional (quase não tem triptofano), não sendo por isso capaz de manter o crescimento de animais jovens.
As elastinas estão presentes nas artérias, tendões e outros tecidos elásticos. Embora semelhantes ao colágeno em muitos aspectos, não podem ser convertidas em gelatina. As elastinas são parcialmente resistentes às enzimas digestivas e contêm pouca hidroxiprolina.
Queratinas são as proteínas dos cabelos, da lã, do casco dos animais, do couro, das penas, das unhas e dos chifres. Essas proteínas geralmente contêm grande quantidade de cistina, que através de pontes de dissulfeto (-S-S-) ajudam a manter a rigidez da estrutura e conferem baixa solubilidade. O cabelo humano contém cerca de 14 % de cistina. O elevado conteúdo de aa sulfurados torna essas proteínas interessantes nutricionalmente, e, por isso, diversos processos vêm sendo estudados para a solubilidade e aproveitamento de resíduos, como penas de aves para uso de rações para animais.
Proteínas globulares
Consistem em cadeias de polipeptídios enovelados em estruturas esféricas ou globulares. Em geral, têm função dinâmica na célula, os anticorpos, a maior parte das enzimas, alguns hormônios e muitas proteínas que exercem a função de transportadores, como a albumina do soro e a hemoglobina, são proteínas globulares.
As proteínas globulares costumam ser classificadas em albuminas, globulinas, glutelinas e prolaminas, com base na sua solubilidade.
As albuminas são facilmente solúveis em água e coaguláveis pelo calor. Formam um grupo grande de proteínas, das quais albumina do ovo, a do soro e do leite constituem exemplos típicos.
As globulinas insolúveis ou moderadamente solúveis em água, porém sua solubilidade é aumentada pela adição de sais neutros, como cloreto de sódio e são coaguláveis pelo calor. Ex.: imunoglobinas (do soro), globulinas do músculo e as globulinas das sementes das plantas.
As glutelinas são proteínas insolúveis em soluções salinas diluídas, mas solúveis em soluções de ácidos ou bases diluídas. São encontradas principalmente em cereais como, por exemplo, a glutelina do trigo e do milho.
As prolaminas são proteínas encontradas normalmente ao lado das glutelinas. São insolúveis em água ou solventes neutros, mas solúveis em solução de etanol a 50-80%. A associação das glutelinas com as prolaminas constitui a fração chamada glúten dos cereais, que é a responsável pelos processos de panificação e pelas características visco-elásticas da massa. Essas propriedades são devidas em grande parte pela formação de ligações -S-S- entre resíduos de cisteína.
As histonas são proteínas básicas, solúveis em água e que produzem sob hidrólise, grande quantidade de arginina ou lisina. As histonas encontram-se combinadas aos ácidos dentro das células. A globina do sangue é uma histona.
Proteínas conjugadas
São proteínas combinadas com outros grupos, que não são aminoácidos. A porção não aminoacidica da molécula chama-se grupo prostético.
As proteínas conjugadas são classificadas pela natureza química do grupo prostético:
Lipoproteínas
São complexos de lipídeos com proteínas. A porção lipídica é constituída de triglicerídeos, fosfolipídeos, colesterol ou derivados ligados firmemente à proteína de forma ainda não bem conhecida.
As lipoproteínas têm função estrutural quando associadas as membranas de organelas celulares. A associação com proteínas permite que sejam veiculadas substâncias como os lipídeos, que de outra forma estariam insolúveis. São moléculas ou “partículas” de elevado peso molecular e normalmente classificadas em quatro grupos de acordo com a sua densidade:
- os quilomicrons com densidade de 0,950 g/ml;
- as lipoproteínas de muito baixa densidade VLDL 0,950 a 1,000 g/ml;
- as lipoproteínas de densidade baixa LDL 1,006 a 1,063 g/ml;
- as lipoproteínas de alta densidade HDL 1,063 a 1,210 g/ml.
Quanto maior é a densidade, maior o conteúdo de proteínas; os quilomicrons, por exemplo, têm 2% de proteínas e as HDL cerca de 50 %.
Além das lipoproteínas séricas, são exemplos importantes as da gema do ovo: lipovitelinas e lipovitelinina, que encontram função em tecnologia de alimentos como emulsificantes.
Glicoproteínas
São proteínas ligadas covalentemente a moléculas de glicídios. A porção glicídica encontra-se ligada à molécula protéica através de ligações OH da serina e treonina ou de grupos NH2 dos resíduos de asparagina e glutamina. A introdução de glicídios aumenta a solubilidade da proteína, que é capaz de formar soluções altamente viscosas. São exemplos importantes de fitoemaglutininas do feijão que, quando não desativadas causam problemas nutricionais e a ovomucina que é um fator responsável pela alta viscosidade da clara do ovo, entre outras.
Metaloproteínas
São complexos de metais com proteínas, o metal pode estar fortemente ligado, como no caso da hemoglobina e da mioglobina onde o átomo de ferro está incluído no núcleo porfirínico ou ligado mais fracamente e facilmente removível. Nesse segundo caso incluem-se a ovoalbumina, proteína do ovo capaz de ligar Fe, Cu, Zn e a ferritina do fígado que chega a conter 20% de ferro. Muitas dessas ligações permitem que os metais, de outras formas insolúveis, sejam “solubilizados” e transportados nos pH’s fisiológicos dos fluidos orgânicos.
Fosfoproteínas
São proteínas que possuem grupamento de fósforo na molécula, ligados normalmente na forma de éster a grupos OH da serina ou da treonina. São exemplos: a caseína do leite e a vitelina da clara do ovo. A caseína do leite na forma micelar, cuja estabilidade é mantida, em grande parte, à custa desses grupos de fosfatos ligados ao cálcio, forma uma estrutura estável no pH natural desses fluidos, precipitando pelo aquecimento. É interessante comentar que a presença de grupos fosfatos dificulta a ação das enzimas digestivas, na sua proximidade, resultando da hidrólise parcial de fosfopeptídeos que podem ter importante função na absorção de cálcio.
Nucleoproteínas
São complexos de proteínas básicas com ácidos nucléicos encontrados no núcleo celular. As histonas e protaminas são nucleoproteínas.
5.6 Digestão e Absorção das Proteínas
Com algumas exceções, as proteínas não entram diretamente na circulação sangüínea através do trato gastrintestinal. Pequenas quantidades podem ser absorvidas intactas e, em alguns casos, esses materiais dão origem a reações alérgicas em certas pessoas. Em crianças recém-nascidas, a absorção de anticorpos do leite materno é um importante mecanismo de defesa contra infecção, uma vez que o sistema imune é pobremente desenvolvido nos primeiros dias de vida.
Para a maioria das vezes, porém, a proteína da dieta precisa ser hidrolisada em seus aminoácidos constituintes, antes que a absorção possa ocorrer. Essa clivagem das proteínas envolve a quebra de ligações peptídicas por proteases específicas, que agem em grandes polipeptídios ou por peptidases que agem em peptídeos menores, oligopeptídeos.
A digestão das proteínas da dieta é um processo complexo que ocorre em etapas. Os principais locais da digestão são: estômago, lúmen do intestino delgado e células da mucosa do intestino delgado.
A saliva não contém enzimas proteolíticas, sendo a ação da boca apenas mecânica. A hidrólise das proteínas começa no estômago.
Quando o alimento deixa o esôfago, ele se deposita temporariamente no estômago. A distensão do estômago, causada pela ingestão de alimentos, provoca a liberação do hormônio gastrina da mucosa gástrica, que por sua vez estimula a liberação de ácido clorídrico. Este tem duas funções importantes:
1) desnaturação da proteína para facilitar sua degradação e
2) conversão do pepsinogênio em pepsina. O processo de ativação é auto-catalítico, isto é, depois da conversão inicial do pepsinogênio à pepsina, ela mesma é capaz de ativar o pepsinogênio.
As enzimas proteolíticas da trato digestivo são produzidas na forma de zimogênio inativos, para proteger as células secretoras de uma autodestruição.
A pepsina age nas proteínas da dieta seletivamente, atacando somente grupos amino dos peptídeos que tenham anéis aromáticos como cadeias laterais e, portanto, podem agir em vários pontos entre as cadeias polipeptídicas. Diferentemente das demais enzimas proteolíticas, a pepsina é capaz de digerir o colágeno, o tecido conectivo da carne.
As outras enzimas proteolíticas presentes na secreção gástrica são a gelatinase que liqüefaz a gelatina e a renina que, na presença de íon cálcio, promovem a coagulação da caseína, transformando-a em paracaseína, e assim retarda a passagem do leite pelo estômago. A renina existe em bezerros, não sabendo, porém, da sua existência no homem.
Todavia, no processo total da digestão das proteínas, a contribuição do estômago é pequena.
Do estômago a proteína parcialmente digerida se dirige ao duodeno. As proteínas que deixam o estômago para o duodeno são agora uma mistura de proteínas não digeridas, polipeptídeos e cerca de 15% já como aminoácidos. A pepsina, cujo pH ótimo está próximo de 1,8, tem sua ação bloqueada, pois, o pH duodenal passa a ser cerca de 6,5 , favorável à ação de outras proteases.
Esses produtos da digestão estomacal estimulam a secreção pela mucosa gástrica, de secretina e de colecistocinina-pancreozimina, hormônio que respectivamente aumentam o volume e a concentração enzimática de suco pancreático.
Quando o quino atinge o intestino, ele causa a liberação pela mucosa intestinal da enteroquinase, uma enzima que transforma o tripsinogênio pancreático em tripsina ativa. A tripsina, por sua vez, ativa outras enzimas proteolíticas.
Os zimogênios do suco pancreático são tripsinogênio, quimotrisinogênio e procarboxipeptídase. A ativação dos zimogênios pela tripsina é a clivagem de uma ligação peptídica adjacente a uma arginina ou lisina, que estejam no começo da cadeia do zimogênio.
As enzimas proteolíticas pancreáticas são classificadas em endopeptidase: tripsina e quimotripsina, carboxipeptidase: exopeptidase.
Essas enzimas independem da ação da pepsina para agirem. As endopetidases quebram ligações peptídicas na porção interna da molécula. A tripsina age em ligações onde um aminoácido dibásico contribui com a carboxila (Phe, Trp, Tyr). A exopeptidase libera aminoácidos livres. Ela age no aminoácido que tem a carboxila terminal, daí o nome carboxipeptidase.
A quantidade de enzimas secretadas pelo pâncreas é regulada pelo teor de proteína existente na luz intestinal. A tripsina vai se ligando à proteína dietética até que esteja em excesso, quando isso acontece, a tripsina livre no intestino envia um sinal ao pâncreas para reduzir a síntese de tripsinogênio.
As aminopeptidases junto com as dipeptidases são produzidas nas microvilosidades da mucosa intestinal e completam a digestão dos peptídeos até os aminoácidos. Nesse caso, a digestão se dá nas membranas das células da mucosa intestinal.
Uma quantidade apreciável de proteínas intactas entra no intestino todos os dias proveniente das secreções intestinais e da descamação do epitélio e é digerida juntamente com as proteínas da dieta. Portanto, a digestão gástrica não é essencial para a utilização das proteínas no organismo.
Para uma ingestão de 90 100g de proteínas da dieta, somam-se 60 a 70g de proteínas endógenas. Como as perdas fecais são equivalentes a 10g /dia, a quantidade total de proteína a ser absorvida fica em trono de 160g.
A digestibilidade das proteínas alimentares depende da estrutura da proteína, da severidade do processamento térmico e de fatores não protéicos do alimento, por exemplo, interação com fibras.
Normalmente as proteínas animais têm grande digestibilidade, da ordem de 90%. As proteínas vegetais têm digestibilidade mais reduzida.
Certas substâncias, como os inibidores de tripsina encontrados, por exemplo, em feijões e na soja crus, inibem a tripsina intestinal e estimulam, em conseqüência, a secreção de mais proteínas pelo pâncreas, produzindo distúrbios que resultam até a redução no crescimento. Esses fatores antinutricionais devem ser desativados termicamente e a sua presença controlada, principalmente em produtos industrializados.
O processo digestivo no lúmen intestinal produz uma mistura de aminoácido e oligopeptídeos que pode ser muito complexa, como se pode ver pelas muitas probabilidades de seqüências de aminoácidos que ocorrem nas proteínas. Acredita-se que a degradação posterior dos oligopeptídeos, dipeptídeos e aminoácidos resulte da ação das peptidases intestinais localizadas na borda em escova. Embora só sejam encontrados aminoácido livres no sangue da veia porta após a ingestão protéica, uma proporção significante de proteína deixa o lúmen como peptídeos pequenos que são então hidrolisados pelas peptidases da mucosa, ou na borda em escova, ou dentro da célula.
Absorção de Proteínas
Quase todas as proteínas da dieta são absorvidas na forma de aminoácidos. A absorção intestinal é a predominante, mas uma pequena parte pode ser efetuada pelas células do estômago e do cólon.
Há diferenças de velocidade de absorção intestinal das formas isométricas dos aminoácidos. O isômero natural L é ativamente transportado através da mucosa, esta transferência da mucosa para a serosa envolve a participação da vitamina B6 (piridoxal-fosfato) . Os isômeros D são transferidos por difusão simples. O sistema ativo de absorção envolve a participação de energia e de carregadores. São conhecidos quatro sistema de carregadores para o transporte de aminoácidos através da membrana:
1) sistema para transporte de aa neutros ;
2) sistema para transporte de aa básicos (Lys, Arg, Hys);
3) sistema para transporte de aa ácidos (Asp, Glu);
4) sistema para transporte de prolina e hidroxipolina.
O transporte de aa ocorre somente na presença simultânea do transporte de sódio. Os sistemas carregadores estão localizados na borda em escova da célula epitelial. A teoria mais aceita para o transporte de aa através da membrana postula que o carregador possua sítio de ligação para a molécula de aa e par ao íon sódio. Quando os dois sítios estão carregados , o carregador dirige-se para o interior da célula movido pelo gradiente de sódio, e transportando consigo o aa, o qual será captado no espaço intracelular.
O aumento da concentração intracelular do aminoácido irá gerar o gradiente de concentração do mesmo em relação ao sangue , resultando na difusão de mesmo para o sistema porta.
Quando os aminoácidos livres atravessam a célula da mucosa, alguns deles sofrem alterações. O ácido glutâmico e o ácido aspártico são transaminados, com formação de alanina que vai para o fígado através da circulação portal. Também a glutamina que vem do sangue , dos tecidos periféricos até o intestino sofre essa transaminação e, portanto, a mucosa do intestino é uma fonte significante de alanina para o fígado.
Como foi dito, pequenas quantidades de proteínas intactas podem ser absorvidas. Tem sido sugerido que essa absorção anormal pode ser conseqüência de alterações transitórias do epitélio intestinal. A presença dessas proteínas naturais , de molécula relativamente grande, no sangue, estimulará a resposta imunológica, tornando o indivíduo sensível àquele tipo de proteína. Se ocorrer nova ingestão daquela proteína, o indivíduo poderá apresentar reações de hipersensibilidade.
Sistema Circulatório Porta
O sistema circulatório porta é composto de veias que, partindo dos intestinos e do baço, chegam até o fígado e daí, às veias cavas. A função desse sistema é passar o sangue dos intestinos através do fígado antes de sua entrada na circulação geral. Ao passar através dos diminutos seios hepáticos o sangue entra em contato com células fagocitárias retículo endoteliais especiais, denominadas células de Kupffer , que são capazes de remover os fragmentos anormais. Por conseguinte essas células depuram o sangue intestinal antes de sua entrada na circulação geral. Isso é muito importante, pois a cada minuto uma pequena quantidade de trilhões de bactérias do trato intestinal passa pelo sangue da veia porta. As células de Kupffer são tão eficientes na remoção delas que, provavelmente, nenhuma entre as milhares que chegam ao fígado alcança a circulação geral.
O sistema porta também permite a remoção pelo fígado de varas substância nutritivas, absorvidas do sangue intestinal antes de alcançarem a circulação geral. Por exemplo, as células hepáticas removem normalmente cerca de 2/3 da glicose absorvida pelo sangue porta dos intestinos e talvez até metade das proteínas antes do sangue alcançar a circulação geral.
5.7 Metabolismo das Proteínas e Aminoácidos
Os aminoácidos absorvidos no intestino são levados pela circulação êntero-hepática até o fígado. Após uma refeição protéica, o teor de aminoácidos livres no sistema porta se eleva muito, porém, o sangue da circulação sistêmica, que sai do fígado, tem concentrações menores e um perfil diferente de aminoácidos livres, fato que indica o papel regulador do fígado.
Como um grupo, os aminoácidos essenciais são mais bem absorvidos que os não essenciais.
Ao conjunto dos aminoácidos presentes na circulação geral, quer sejam oriundos da dieta, da quebra de proteínas tissulares ou aminoácidos não essenciais no corpo, dá-se o nome de pool circulante.
Os aminoácidos do sangue e do líquido intersticial formam um pool de aminoácidos extracelular disponível a todas as células para a síntese de proteínas e para outras necessidades especiais. O fluxo de aminoácidos da absorção intestinal para o sangue é equilibrado pela rápida remoção pelos tecidos, sobretudo pelo fígado, como foi dito. O pool intracelular é muito maior do que o pool extracelular, que serve principalmente como função de transporte.
A não ser por uma flutuação observada num período de 24 horas, os níveis médios de cada aminoácido no plasma mantêm-se relativamente constantes sob condições normais.
Praticamente não há armazenamento de aminoácidos no corpo. Eles são constantemente utilizados para formar e reformar outros componentes, pela quebra e ingestão de proteínas , com a excreção dos excessos. Qualquer “armazenamento” dá-se na forma de proteínas. Entretanto, há um limite superior, após o qual os aminoácidos são degradados e utilizados como energia ou armazenados como gordura. Como acontece com as gorduras e os carboidratos, existe um estado de equilíbrio dinâmico para os aminoácidos, quebra e troca constantes. Os tecidos de substituição de proteínas mais ativos são as proteínas plasmáticas, a mucosa intestinal, o pâncreas, o fígado e os rins, enquanto os músculos, a pele e o cérebro são os menos ativos.
À velocidade de renovação das proteínas, dá-se o nome de “turnover”.
A renovação total de uma proteína em um dia representa uma demanda muito maior de aminoácidos do que a dada pela dieta. O equilíbrio é mantido pela reciclagem dos aminoácidos endógenos, pela quebra das proteínas do organismo e pela síntese de aminoácidos não essenciais, como vimos.
O estado dinâmico das proteínas corporais.
Embora o corpo de um homem adulto dê a aparência de ser estático na forma durante nossas observações do dia a dia, isto na verdade é uma ilusão. Mesmo quando em repouso, as células e tecidos estão sofrendo contínuas trocas de material e energia com suas circunvizinhanças. As células nervosa e musculares requerem energia para transportar íons e metabólitos e, assim, manter a vida. Uma parte substancial do material trocado com o ambiente é relacionada com o requerimento basal de energia. Além disso, a maquinaria do metabolismo, ou seja, as enzimas , os elementos formados nas células e os elementos estruturais dos tecidos, todos participam em uma troca de material com o mundo exterior. Esse conceito implica em que todos os elementos das células do corpo estão sofrendo eterno “turnover” - um processo de degradação, associado com uma ressíntese, para produzir um estado estacionário dinâmico – “steady-state”, de onde a constante e equivalente saída e chegada de moléculas em um determinado instante do tempo produz a ilusão de que o processo está numa posição de equilíbrio. É essencial entender a diferença entre – “steady-state” e estado de equilíbrio. De fato, é contraditório falar em estado de equilíbrio em relação à vida. Um ser vivo só atinge o estado de equilíbrio quando morre.
O “steady-state” do corpo é exemplificado pelo turnover diário das proteínas corporais e seus aminoácidos constituintes.
Aminoácidos no metabolismo intermediário
Quando a ingestão protéica é inadequada, em termos quer da quantidade total , quer da proporção de aminoácidos essenciais requeridos para a síntese da proteína, ou se há um déficit no fornecimento energético, o catabolismo dos aminoácidos excede sua incorporação nas proteínas teciduais. O catabolismo dos aminoácidos também é um meio de utilizar a energia de aminoácidos extras ingeridos numa dieta com alto teor de proteína.
Diante da variedade diferente de aminoácidos e da diversidade de suas estruturas, é fácil constatar a multiplicidade das vias metabólicas envolvidas em sua quebra, assim como na síntese de aminoácidos não essenciais. Não é nosso objetivo nesse momento, estudar o metabolismo de cada aminoácido individualmente. Ao contrário, vamos cuidar daquelas reações comuns à maioria dos aminoácidos e que são essenciais ao metabolismo protéico.
O catabolismo de aminoácidos é dirigido para a separação dos grupos amino do esqueleto de carbono e o subseqüente destino desses dois componentes.
Destino do esqueleto de carbono dos aminoácidos
Dependendo do estado metabólico do corpo, eles podem ser diretamente oxidados a CO2 e H2O com a produção de ATP ou podem ser primeiramente convertidos em glicose ou ácidos graxos para uso posterior ou armazenamento, quando um excesso de calorias é ingerido. O fator importante é que, desde que o agrupamento amino seja removido, os compostos de carbono resultantes entram em um “pool” comum de intermediários metabólicos, manejados posteriormente como produtos de catabolismo de glucídios ou lipídeos.
Chamam-se glicogênicos aqueles aminoácidos que podem contribuir para a síntese de glicose, por causa da natureza dos compostos de carbono que eles têm (piruvirato ou intermediários do ciclo de Krebs que podem ser convertidos em glicose).
E cetogênicos são os aminoácidos cujo catabolismo leva a acetil-CoA e/ou a acetoacetil-CoA, que são os precursores dos corpos cetônicos e não podem fornecer glicídios a síntese da glicose.
A divisão entre os aminoácidos glicogênicos e cetogênicos não é tão rígida, pois dois aminoácidos (Phe e Tyr) são tanto cetogênicos quanto glicogênicos. Alguns dos aminoácidos que podem ser convertidos em piruvirato (Ala, Cys, Ser) podem também formar o acetoacelato via acetil-CoA.
Síntese da uréia
A amônia formada pela desaminação oxidativa dos aminoácidos é rapidamente removida pela conversão à uréia. Somente o fígado é capaz de sintetizar uréia. O nitrogênio é canalizado para ciclo por meio do carbamil-fosfato e do aspartato. Há necessidade de energia para o funcionamento do ciclo. Pode também servir como o mecanismo para a síntese do aminoácido arginina.
Pode-se notar que a formação do carbamil-fosfato utiliza não só a amônia, mas também CO2 , que é outro produto de degradação do metabolismo.
Síntese protéica
O uso fundamental e mais interessante dos aminoácidos é como blocos para a construção das proteínas corpóreas. Cada célula no corpo tem a capacidade de sintetizar um número enorme de proteínas específicas.
Todos os aminoácidos essenciais devem estar disponíveis ao mesmo tempo para a síntese protéica. A síntese de uma proteína não é um processo feito por etapas. Os peptídeos completos são preparados em um curto período de tempo e não há condições de armazenamento de seções incompletas. Os aminoácidos não essenciais devem ser formados como eles mesmo ou deve haver precursores adequados de modo que eles possam ser sintetizados.
A síntese das proteínas características da cada célula é controlada por material genético, ácido desoxirribonucleuico (DNA) do núcleo . O DNA é usado como molde para a transcrição ou síntese de ácido ribonucleico (RNA), dos quais existem diversas formas.
Não é objetivo deste curso entrar em detalhes sobre a síntese protéica.
5.8 Avaliação da qualidade Nutricional das Proteínas
Todos os métodos para medir a qualidade de uma proteína procuram quantificar quão boa ela é para fins de síntese protéica. Ou seja, a qualidade nutricional de uma proteína está ligada à sua capacidade de satisfazer as necessidades orgânicas de crescimento e manutenção.
Os métodos para avaliar uma proteína podem ser químicos, biológicos e microbiológicos.
Métodos químicos
Baseiam-se, essencialmente, na análise dos aminoácidos da proteína em estudo e na comparação do perfil dos aminoácidos essenciais, assim obtidos, com o de uma proteína padrão.
Em 1955, um Comitê de Peritos da FAO elaborou um padrão baseado numa proteína teórica, constituída por uma mistura de aminoácidos essenciais e não essenciais, em proporções que, à luz dos conhecimentos existentes até então, pareciam ótimas. Assumiu-se que esta proteína teórica teria uma utilização de 100%, sendo ela representada como um padrão provisório, sujeito a futuras revisões. Pode-se observar que o padrão FAO - 55 consta de dez itens:
Os oito aminoácidos essenciais, a tirosina e o grupo dos sulfurados totais considerados em conjunto (STOT).
Escore
Para se avaliar a qualidade de uma proteína X, confronta-se sua composição aminoacídica com a do padrão, observa-se qual dos aminoácidos de X está mais deficiente com relação ao valor que aparece para o mesmo item no padrão e expressa-se o resultado em percentual.
O aminoácido que se apresentar em menor quantidade é o primeiro limitante. Pode-se definir primeiro limitante, segundo limitante, terceiro limitante etc. O mais deficitário será o primeiro, o segundo será o mais deficitário depois do primeiro e assim sucessivamente.
O percentual mais baixo define o grau de limitação aminoacídica e recebe o nome de escore.
No caso da proteína do leite de vaca, por exemplo, o único limitante é o item dos sulfurados totais, que lhe confere um escore igual a 78%. Já o gluten de trigo tem um primeiro limitante, a lisina, que determina um escore de 40, um segundo limitante, a metionina e um terceiro, o triptofano, que limitam em 69 e 67%, respectivamente.
Na prática, quando se fala em escore, estamos nos referindo ao percentual mais baixo, determinado pelo amioácido que apresenta maior déficit relativo.
O exemplo apresentado do gluten de trigo em relação ao leite e ao padrão FAO-55, tem grande alcance prático, pois, nas classes de baixa renda, muitas vezes as crianças são alimentadas com água de fubá, ou de algum outro cereal, após o desmame, sem dar leite. Essas proteínas de cereais deixam muito a desejar, a não ser que sejam misturadas com o leite.
Posteriormente ao surgimento do padrão FO-55, foram propostos outros padrões: proteína do leite humano, do leite de vaca, do ovo integral de galinha, e, em 1971 a FAO lançou outro padrão teórico baseado nas necessidades do pré-escolar.
Comparando-se uma proteína problema com esses diversos padrões pode-se verificar que o escore varia em função do padrão usado, mas em todos os casos a lisina é o aminoácido limitante. Na prática pode-se usar qualquer padrão, mas é importante que se defina qual deles foi usado na análise de uma determinada proteína.
Os métodos químicos em geral oferecem vantagens e desvantagens.
Vantagens: simples e de baixo custo, especialmente se os dados são obtidos em tabelas, permite identificação dos fatores limitantes com facilidade e permite previsão do valor nutricional ou efeito complementar de misturas.
Desvantagens: erros na análise de aminoácidos, problema de baixa digestibilidade, não considerar um possível excesso de aminoácidos ou a presença de fatores tóxicos que só é detectada em testes com animais. Além disso, pode resultar em valor zero se a proteína for desprovida de um aminoácido essencial, o que não corresponde à realidade.
E já que a Nutrição trata de seres vivos , mais interessante do que os dados exclusivamente químicos são os resultados da experimentação com animais. Frente a eles o escore geralmente tem um valor preditivo.
Métodos biológicos
Os métodos biológicos utilizados para avaliação do valor nutritivo de uma proteína baseiam-se na resposta de um organismo à ingestão de uma proteína em estudo. A utilização biológica de uma proteína é normalmente obtida por experimentos com animais, realizados por diversas técnicas. Esses métodos têm valor prático, devendo-se, como em outros casos, Ter em mente as suas limitações.
De uma forma geral usam-se ratos jovens (em fase de crescimento) que, por tempos variáveis, conforme a técnica, são alimentados com rações balanceadas em relação a todos os nutrientes e incluindo a proteína de boa qualidade (caseína ou ovoalbumina), sendo os resultados expressos comparativamente. Os parâmetros usados para se obter o valor biológico são usualmente o crescimento ou alterações de nitrogênio na carcaça do animal.
Método do coeficiente de utilização protéica (CUP, CEP, PER – Protein Efficiency Ratio)
É uma medida bastante simples, que consiste em controlar o crescimento de animais jovens, alimentados com proteína problema, e relacionar a quantidade de peso ganho como a da proteína ingerida.
Embora o método tenha designações em português (CUP – CEP), a abreviação em inglês (PER) é mais usada por se internacional.
PER = g de peso ganho
g de proteína ingerida
O método original é de Osborne e Mendel (1919), usado até hoje, com ligeiras modificações. Os autores recomendam administrar cada proteína em uma concentração ótima na dieta, mas como essa concentração varia com a qualidade da proteína, convencionou-se internacionalmente usar nas experiências uma concentração de 10% de proteína.
A experiência é realizada geralmente com ratos, de mais ou menos 20 dias de idade. Os animais são mantidos em laboratórios em gaiolas individuais e a experiência dura 4 semanas.
A maior parte de erro no método está no uso do peso ganho como único critério do valor da proteína. Nem sempre o peso ganho é um reflexo fiel da proteína incorporada ao organismo: algumas dietas podem provocar retenção de água e ou depósitos exagerados de lipídios.
Por outro lado, algumas proteínas administradas a 10% podem não produzir crescimento e até mesmo provocar um decréscimo do peso. Nesses casos o numerador será zero ou negativo e, depois de quatro semanas de experiência, não se chega a resultado algum.
Apesar disso o método tem também vantagens como ser de fácil aplicação, permitir cálculos estatísticos (gaiolas individuais) e ser aplicável a qualquer organismo em crescimento, inclusive crianças.
Fonte do documento:
http://www.ufjf.br/renato_nunes/files/2013/01/Cap%C3%ADtulo-V-Prote%C3%ADnas.doc
Site para visitar: http://www.ufjf.br
Autor do texto: não especificado no documento de origem ou indicadas no texto
Google Palavras-chave: Proteinas e aminoácidos bioquimica resumo Tipo de Arquivo: doc
Se você é o autor do texto acima e concorda em não partilhar o seu conhecimento para o ensino, pesquisa, bolsas de estudo (para uso justo, como mostrado acima, nos Estados Unidos copyrigh baixa "for fair use as indicated in the United States copyrigh low"), envie um e-mail conosco e nós vamos remover o texto rapidamente.
Proteinas e aminoácidos bioquimica resumo
![]()
Se você quer encontrar rapidamente as páginas relacionadas a um tópico específico, como xx usando o seguinte motor de busca:
Visite a página principal
Proteinas e aminoácidos bioquimica resumo
Por favor, visite índice inicial de todos os temas, graças
Termos de uso ea política de privacidade e condições de utilização
