Amminoacidi o aminoacidi
Amminoacidi o aminoacidi
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
|
GLI AMINOACIDI |
I "MATTONI" delle proteine |
CHE COSA SONO?
Autore: non indicato nel documento |
Aminoacidi, integrazione a fini agonistici.
I mattoni delle proteine come propellente per migliorare le gesta sportive?
Antonio Bruno, 16 ottobre 2008
Non più tardi di qualche sera addietro mi è capitato essere ascoltatore di una chiacchierata post allenamento. La tesi che veniva esposta per sommi capi sosteneva la validità dell'assunzione di aminoacidi a livello di integrazione in particolar modo per podisti molto dediti alla corsa. Nel mentre ascoltavo mi rivenivano in mente le nozioni, poche a dire il vero, assimilate in anni di fervente studio su testi di biochimica, scienza dell'alimentazione e quant'altro, unitamente alla considerazione di avere per quindici degli ormai molti anni della mia vita, praticato con costanza quotidiana, meticolosità nozionistica e tecnica, attività di culturismo, ottenendo risultati a livello di integrità fisica, crescita muscolare e notevolissima capacità contrattile a livello di forza, sollevare 150-200 chili era per me pratica consueta. Ma io non ho mai assunto sostanze integratorie, si..... è pratica abituale per molti di quelli che entrano nelle palestre, ma non hanno volontà di lavorare, non aspettano i tempi del corpo umano, ma non io. Eppure sono passato dal mio gracile fisico di 48 chilogrammi ad uno molto più robusto e performante di 84, senza integrare. Qui ora si sta trattando non di una pratica volta alla costruzione, bensì al raggiungimento di una prestazione sportiva migliore. Per comprendere meglio il dilemma che mi avvolgeva, va considerato cosa sono gli aminoacidi. Gli aminoacidi sono i mattoncini delle proteine, a loro volta essenziali per la struttura muscolare. I vari cibi ingeriti con una dieta equilibrata contengono tutti gli aminoacidi necessari a ritenere raggiunto il fabbisogno. A differenza di un sedentario, uno sportivo ha una necessità maggiore ma anche diversificata di aminoacidi, particolarmente di tre a catena ramificata, leucina, isoleucina, valina. Questi ultimi hanno un ruolo rilevante nella sintesi proteica e nel processo da cui si ricava energia dalle proteine. Il discorso che viene proposto come distillato di queste nozioni è che l'attività podistica protratta nel tempo ha come conseguenza un catabolismo muscolare, derivante dai microtraumi e dall'utilizzo delle proteine dei muscoli. Consumo che si diversifica da individuo ad individuo e che raggiunge il suo apice nella maratona, e che può essere quantificato mediamente in un dieci per cento, all'interno della maratona un soggetto di 70 kg di peso corporeo consumerà 3.000 kcal, di queste 300 kcal ricavate da fonti proteiche. Studi effettuati affermano che solo con un'attività prolungata quantomeno per una cinquantina di minuti vi possa essere bisogno di un'integrazione. Si deve tenere presente che con un'alimentazione di tipo "italiana" o a "zona, sicuramente non mediterranea, il fabbisogno di integrazione con aminoacidi ramificati non è giustificato per distanze inferiori ai 20 km. Inoltre è bene tenere presente che l'integrazione deve assolutamente rimanere tale, mai sostitutire l'alimentazione. Alimentazione che da sola riesce a fornire il giusto apporto proteico per atleti che si allenano tre volte la settimana, il giorno di riposo è sufficiente ad un reintegro completo, a tal proposito si consideri che in 250 gr. di carne proveniente da pollame, sono contenuti 10 gr. di aminoacidi ramificati, quantità più che sufficiente per atleti che si alimentano bene e non desiderano torturarsi in maratone o affini. Se si può riconoscere una qualcerta importanza in fase di recupero agli aminoacidi, va considerato che non hanno nessun valore nel miglioramento della prestazione sportiva. Lo stimolo che attiva la fase anabolica viene indotto nell'organismo sottoposto ad uno sforzo massimale oppure quando vi è la presenza di sostanze ormonali, quest'ultima è una condizione da evitare in quanto rappresenta doping, senza scartare gli inevitabili danni cagionati alla salute. Va considerato che molti studi effettuati sugli effetti benefici degli aminoacidi, sono stati presi su di un campione ristretto di anziani o sedentari ai quali la somministrazione di codesti aminoacidi ha indotto degli effetti benefici ma solo perché in condizioni di malattia preesistente, raggiunto un determinato livello di controllo l'organismo non reagisce più positivamente all'integrazione, semplicemente ne ignora il segnale indotto dalla sostanza. Per questo, al di là dei messaggi propagandistici spacciati per veritieri dalle case produttrici di integratori, si può asserire una sola verità, come nostra abitudine controcorrente e frutto di accurate indagini. L'assunzione di aminoacidi, tirosina, glutamina, licina, arginina e via discorrendo, non aumenta i livelli dell'ormone della crescita, non aumenta la potenza aerobica e non consente miglioramenti delle prestazioni sportive ai livelli massimali. Vanno poi presi in considerazione gli effetti provocati a reni e fegato dall'assunzione di tali sostanze di sintesi, in definitiva, credo sia sempre valida la mia personalissima teoria che vede nell'acqua (H20) il vero ed universale integratore di sali minerali e nella pasta e nella carne i supermercati di zuccheri e proteine. Allenatevi gente, unica via al miglioramento.
Autore: Antonio Bruno
Fonte: http://www.mondocorsa.com/Documenti/Aminoacidi.doc
Amminoacidi o aminoacidi
Citazione da :
AMINOACIDI E PROTEINE del Prof. Paolo Rosso
Introduzione
La fondamentale importanza delle proteine non è in discussione, attraverso queste molecole le cellule svolgono tutte le proprie funzioni. Le proteine sono molecole di grandi dimensioni e di elevato peso molecolare, la struttura è però molto simile sono venti aminoacidi che combinandosi in maniera differente modificano il significato della molecola. Le proteine svolgono numerose funzioni ad esempio enzimi che svolgono funzioni non importanti ma fondamentali per la vita e l’equilibrio della cellula stessa. Gli enzimi sono catalizzatori biologici, ovvero facilitano le reazioni abbassando l’energia di attivazione e aumentando la velocità di reazione. Le proteine sono dei mediatori chimici, ovvero modulano i segnali che le cellule si trasmettono, gli anticorpi che regolano la reazione dell’organismo quando entrano sostanze estranee, le proteine formano la struttura degli organi, della membrana cellulare, sono dei mezzi di trasporto di molecole all’interno e all’esterno della cellula. Molte proteine svolgono un azione contrattile e quindi favoriscono il movimento degli organismi inferiori. Costituiscono materiali di deposito servono a nutrire gli embrioni animali e vegetali, ormoni svolgono un azione importante per l’organismo tipo la regolazione del glucosio.
Chimica degli aminoacidi
Sono in numero di 20 tutti possiedono l gruppo amminico e acido. Si suddividono in aminoacidi non polari, polari, acidi e basici. Si suddividono ancora in aminoacidi essenziali e non essenziali. Gli aminoacidi presenti nelle proteine appartengono alla serie L infatti molti aminoacidi presentano l’ atomo di carbonio alfa asimmetrico, si parla della isomeria ottica e di tutto quello che si è detto per gli zuccheri. Le due forme speculari vengono indicate come isomero D e L . Vi sono anche aminoacidi diversi ovvero la 6 N metillisina, la 4 idrossiprolina, la 5 idrossilisina.
La presenza di gruppi acidi e basici contemporaneamente nella molecola causa fenomeni particolari, possono polarizzarsi entrambi i gruppi oppure solo uno dei due. Il grado di ionizzazione dipende dal pH e possono essere dipoli oppure no. Il valore di pH dove si forma il dipolo viene chiamato pI punto isoelettrico. I gruppi funzionali sono deboli il calcolo del pI è dato dalla somma dei due valori di pK diviso per due.
PI = pK1 + pK2 / 2
Il grado di ionizzazione dei gruppi acidi e basici è legato al pH della soluzione con la seguente formula:
pH = pKa + log conc base coniugata/ conc acido coniugato
Reazioni degli aminoacidi
Le reazioni riguardano i gruppi acidi e basici. Si possono avere le seguenti reazioni:
- reazione con alcoli
|
|
- reazione con alogenuri alchilici,
|
|
- reazione con nitrito di sodio
|
|
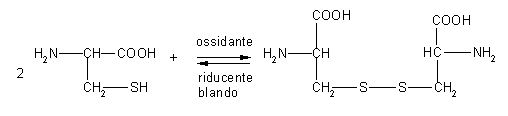
- reazione con ossidanti blandi
|
|
- con ninidrina è una reazione di riconoscimento, reazione molto sensibile, bastano solo pochi mg di aminoacido per dare la reazione. La colorazione è caratteristica per gli aminoacidi ed è di color marrone. Con il reattivo di Fehling diluito al 0,5% di solfato di rame penta idrato e una soluzione al 2% di idrossido di sodio, non reagiscono gli zuccheri ma bensì le proteine.
|
|
Peptidi
Una delle importanti caratteristiche degli aminoacidi è la reazione tra il gruppo acido e amminico di due differenti aminoacidi, per formare il legame ammidico. Questo dimero che si viene a formare si chiama dipeptide. Il gruppo amminico ed il gruppo carbossilico sono i due terminali. La nomenclatura dei dipeptidi è quella di mettere il nome del primo aminoacido seguito dal nome del secondo aminoacido esempio valilvalina oppure cisteilcisteina. Dal modello spaziale di questi composti si può notare che il legame peptidico è una struttura planare, gli snodi ruotano liberamente intorno ai carboni ibridati sp3. Vengono così a crearsi delle strutture tridimensionali dove i piano vengono ad essere traslati rispetto al legame.
 |
|
Proprietà acido base
Tutti gli aminoacidi abbiamo detto hanno il gruppo acido e basico che sono deboli ovvero poco dissociati. Questi gruppi concorrono alla formazioni di gruppi ionizzati dove una volta è presente la carica positiva altre volte la carica negativa. Vi è un valore di pH dove sono presenti entrambi le cariche quel valore viene detto punto isoelettrico. La ionizzazione degli aminoacidi dipende dal valore del pH, su questa caratteristica sono basate le analisi di separazione degli aminoacidi.
Struttura delle proteine
Le proteine sono dei polimeri naturali, formati dalle unità elementari che sono gli aminoacidi, legati con legami peptidici. La proteina viene ad assumere una struttura tridimensionale che è una sua caratteristica, non solo estetica ma bensì funzionale. Una temperatura troppo elevata, un pH troppo alto, la presenza di sali può determinare nella proteina una perdita della struttura tridimensionale. Il processo a cui va incontro la proteina si chiama di denaturazione. Molte volte questo processo è irreversibile, ma per taluni polimeri questo processo è reversibile. La reazione inversa si chiama di rinaturazione. Quando si lavora con una molecola proteica si deve lavorare sempre lontano dalle condizioni di denaturazione perché la molecola perde le sue proprietà.
Le proteine presentano quattro gradi di struttura.
- struttura primaria è l’ordine con cui gli aminoacidi si susseguono ovvero la sequenza aminoacidica. Quindi i milioni di proteine sono formate sempre dai venti aminoacidi, però l’ordine di successione è diverso per cui la struttura primaria è diversa.
- la struttura secondaria è data dai legami ad idrogeno e dalle forze di attrazione elettrostatica. In questo modo tratti della proteina tendono ad avvicinarsi conferendo al polimero una forma particolare. I legami ad idrogeno avvengono tra il gruppo carbossile e amminico. Si possono individuare due tipi di struttura secondaria una detta ad alfa elica e l’altra a foglietto beta. La prima struttura consiste in un ripiegamento elicoidale della struttura che si presentano come spiralizzato intorno ad un asse centrale, i legami ad idrogeno avvengono sui gruppi non lineari ma sfalsati di un piano. L’alfa elica è sempre destrogira, anche se c’è un elica levogira. Per avere questa struttura essendo i gruppi aminoacidi vicini, l’ingombro sterico gioca un ruolo importante; infatti la presenza di prolina impedisce la formazione della struttura secondaria. Per questo motivo abbiamo proteine che hanno struttura differente in funzione del tipo di aminoacidi presente. La struttura a foglietto beta si presenta come un ripiegamento più ordinato a zig zag i gruppi alchilici risultano proiettati sopra o sotto il piano della molecola. Più strutture di questo tipo si possono aggregare parallelamente formando una super struttura secondaria. Possiamo avere anche una struttura a ripiegamento beta, dove le interazione tra il gruppo acido e basico avviene ogni tre aminoacidi.
- la struttura terziaria è dovuta a residui lontani a ritrovarsi avvicinati e quindi legarsi mediante legami ad idrogeno o forze di attrazione elettrostatica. I gruppi idrofobici della molecola vengono segregati all’interno della struttura. Si possono formare legami zolfo zolfo tra i residui di cisterna.
- struttura quaternaria molte proteine sono formate da subunità, catene proteiche a forma globulare ovvero ripiegate in se. In questo caso abbiamo delle vere e proprie macro condensazioni e la struttura che si forma viene detta quaternaria. L’emoglobina è un esempio di struttura quaternaria. Si parlerà di siti allosterici che in funzione del loro compito saranno siti attivatori e inibitori allosterici.
I legami che intervengono nelle strutture delle proteine sono di natura:
- legami covalenti legami ammidici, ponti di solfuro, responsabili della struttura primaria e terziaria
- legami a idrogeno responsabile della struttura secondaria, terziaria e quaternaria
- interazioni ioniche possono essere repulsive o attrattive responsabile della struttura terziaria e quaternaria
- interazione idrofobiche responsabile della struttura secondaria.
Classificazione delle proteine:
Classificazione in funzione alla loro attività biologica
- Enzimi si tratta di una vasta classe di proteine che agiscono come dei catalizzatori
- Proteine di riserva sono proteine che servono a nutrire gli embrioni
- Proteine di trasporto sono dei vettori ad esempio l’emoglobina
- Proteine protettive come gli anticorpi molecole che sono in grado di proteggere l’organismo dall’invasione di determinate molecole
- Tossine proteine che vengono sintetizzate da sostanze estranee, ed hanno una elevata tossicità per l’organismo che ne viene colpito.
- Proteine regolatrici regolano le varie attività cellulari.
- Proteine strutturali servono per formare tessuti di sostegno
Classificazione in funzione alle loro proprietà
- Proteine semplici per idrolisi danno luogo agli aminoacidi tipo le albumine globulina, prolamine, proteine basiche.
- Proteine coniugate sono legate a gruppi di natura non proteica chiamato gruppo prostatico.
- Proteine derivate da prodotti dell’idrolisi acida, basica, enzimatica.
Separazione degli aminoacidi e delle proteine con elettroforesi:
Si possono utilizzare come fonte proteica il bianco d’uovo, oppure vegetali, oppure animali, disgregare le proteine in ambiente basico con una concentrazione 5 N, per un tempo di 5 - 6 ore, neutralizzare con acido cloridrico, aggiungere al preparato carbone vegetale, filtrare e concentrare sino a 50 ml. La soluzione che si ottiene contiene aminoacidi derivati dalle proteine. Si prepara lo strumento per l’ elettroforesi, le soluzioni tampone a pH =6,1 e pH = 8,5, si preparano le strisce di carta da filtro, quindi si depongono una serie di aminoacidi di riferimento e si procede all’elettroforesi con 350 V per circa 1 ora. Alla fine della corsa si asciugano i fogli di carta in stufa a 100°C, quindi si spruzzano le lastrine con ninidrina il tutto in stufa a 100°C per asciugare le lastrine. Si formano delle macchie di colore marrone, si calcolano gli Rf, una seconda analisi mette invece le proteine che sono state idrolizzate, stessa corsa si calcolano gli Rf e si confrontano con gli aminoacidi noti; si passa quindi alla valutazione quantitativa del tipo di aminoacidi presenti nella proteina.
Separazione degli aminoacidi utilizzando cromatografia su carta
Si possono separare una miscela di aminoacidi utilizzando la cromatografia su carta. Si preparano le strisce di carta specifica per la cromatografia, si procede alla semina degli aminoacidi di riferimento, si prepara la miscela eluente formata da alcol butilico, acido acetico glaciale, acqua in rapporto 6:2:3. Si esegue la corsa, alla fine si mette la strisca in stufa ad asciugare, si spruzza una soluzione di ninidrina, il tutto in stufa ad asciugare e si calcolano gli Rf degli aminoacidi noti. Si passa alla semina delle proteine dissociate ad esempio quelle dell’analisi precedente, si calcolano gli Rf e si confrontano con gli aminoacidi noti. Si calcola la quantità di aminoacidi presente nella proteina naturale.
Separazione degli aminoacidi utilizzando cromatografia su strato sottile
Stessa procedura della precedente ma si utilizza la TLC. La miscela eluente è formata da alcol butilico, acido acetico glaciale e acqua in rapporto 4:1:1, il reattivo è una soluzione di ninidrina.
Da queste tre metodiche si possono trarre le seguenti considerazioni: che differenza esiste tra le metodiche eseguite, quale sensibilità hanno i tre metodi di analisi, quale è il tempo di analisi. Cercare quindi di capire quando utilizzare una metodica rispetto ad un'altra.
Autore: Prof. Paolo Rosso
Fonte: http://www.itisvc.it/lezionionline/leziochimica/lezioni/aminoprot.doc
Amminoacidi o aminoacidi
Visita la nostra pagina principale
Amminoacidi o aminoacidi
Termini d' uso e privacy