Chimica
Chimica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Chimica
Storia della Chimica
Antichità
Le prime esperienze nell’ambito della chimica risalgono ai tempi delle civiltà della Mesopotamia, dell’Egitto e della Cina. Inizialmente si diffusero rudimentali tecniche di lavorazione di metalli, come l’oro e il rame, che si rinvengono in natura allo stato elementare, ma ben presto furono messi a punto i primi processi di estrazione dei metalli dai loro minerali (in genere ossidi e solfuri), mediante riduzione con legno o carbone. L’uso successivo di rame, bronzo e ferro ha dato il nome alle corrispondenti età archeologiche. Altre attività produttive note fin dall’antichità sono quelle dei coloranti, della terracotta, dello smalto e del vetro; accanto a queste, i sacerdoti svilupparono anche le prime teorie, spesso coinvolgenti la magia, per interpretare le trasformazioni della materia osservate.
La filosofia naturale greca
Fin dai tempi di Talete (600 a.C.), i filosofi greci iniziarono a speculare sulla natura della materia. Talete stesso ipotizzò che tutta la materia traesse origine dall’acqua, che poteva solidificare trasformandosi in terra ed evaporare diventando aria. I suoi successori svilupparono questa teoria, individuando i quattro elementi di cui ritenevano fosse costituita la materia: la terra, l’acqua, il fuoco e l’aria. Nell’ambito della teoria atomistica, Democrito sostenne che questi elementi fossero composti da atomi, cioè da microscopiche particelle che si muovevano nel vuoto. Al contrario Aristotele, negando l’esistenza del vuoto, attribuiva agli elementi primordiali una natura materiale. L’ipotesi di Democrito, che perse ben presto d’importanza tra i greci, non fu completamente dimenticata e la sua riscoperta, avvenuta durante il Rinascimento, costituì la base per la moderna teoria atomica.
Il pensiero di Aristotele dominò la filosofia naturale per quasi due millenni, a partire dalla sua morte avvenuta nel 323 a.C. Egli credeva che in natura esistessero quattro qualità: il caldo, il freddo, l’umido e il secco, e che ciascuno dei quattro elementi fosse dominato da una coppia di qualità: così il fuoco era caldo e secco, l’aria era calda e umida, la terra era fredda e secca e l’acqua era fredda e umida; inoltre i quattro elementi, combinandosi secondo diversi rapporti, costituivano tutte le sostanze presenti in natura. Poiché si immaginava che fosse possibile modificare la quantità di ciascuna qualità costituente gli elementi, si prevedeva che gli elementi stessi potessero trasformarsi l’uno nell’altro e perciò che fosse anche possibile trasformare una sostanza in un’altra.
L’alchimia
Le teorie di Aristotele vennero ampiamente accettate e si diffusero in particolar modo ad Alessandria d’Egitto, divenuta dopo il 300 a.C. il principale centro di elaborazione del sapere del mondo antico. Estendendo il concetto di trasformazione, gli studiosi pensarono che i metalli subissero in natura un graduale processo di perfezionamento, trasformandosi gradatamente in oro. Sulla base di questa ipotesi, essi immaginarono di poter riprodurre lo stesso processo nei loro laboratori, in modo da trasformare artificialmente i metalli più comuni in oro. A partire dal 100 d.C. questa idea dominò anche il pensiero filosofico e vennero scritti molti trattati di alchimia, alcuni dei quali, andando ben oltre la pura speculazione filosofica, si rivelarono di interesse scientifico.
La tarda antichità
Dopo il declino dell’impero romano, i trattati greci vennero dimenticati sia in Europa sia nella regione orientale del Mediterraneo. Nel VI secolo la setta cristiana dei nestoriani estese la sua influenza sull’Asia Minore e fondò un’importante scuola a Edessa, in Mesopotamia. Per fornire agli studenti validi libri di testo vennero tradotte in siriaco gran parte delle opere greche di medicina e filosofia. Nel corso del VII e dell’VIII secolo i conquistatori arabi imposero la cultura islamica a buona parte dell’Asia Minore, del Nord Africa e della Spagna. Il califfo di Baghdad, patrono delle scienze e delle arti, promosse la traduzione dei testi siriaci in arabo e, con la diffusione delle opere greche, rifiorì la pratica dell’alchimia. Gli alchimisti arabi, venuti a contatto anche con la cultura cinese, elaborarono un concetto dell’oro che comprendeva sia l’idea greca di perfezione sia quella orientale di farmaco. Lentamente si diffuse l’ipotesi sull’esistenza di uno specifico agente di trasformazione, la “pietra filosofale” (in arabo al-kimia), che divenne l’obiettivo delle ricerche degli alchimisti. Questi antichi esperimenti stimolarono lo studio di nuovi composti chimici; vennero scoperti gli idrossidi alcalini (Metalli alcalini) e i sali d’ammonio (Vedi Ammoniaca) e vennero perfezionati gli apparati per la distillazione. Allo stesso tempo, sentendo la necessità di procedere in modo più rigoroso, nelle ricette comparvero le prime indicazioni quantitative.
Il tardo Medioevo
Nell’XI secolo si ebbe in Europa un grande risveglio culturale grazie al contatto con la civiltà araba; in questo modo la scienza greca, passata attraverso i testi siriaci e arabi, venne tradotta e diffusa in latino. I trattati di alchimia destarono un grande interesse; esistevano manoscritti di due diversi tipi: alcuni avevano contenuti puramente pratici, altri erano di carattere speculativo e si basavano sui presupposti teorici dell’alchimia. Grazie allo sviluppo dell’artigianato del vetro, soprattutto a Venezia, vennero costruiti strumenti per la distillazione migliori di quelli posseduti dagli arabi; ciò permise di condensare prodotti volatili e di isolare per la prima volta gli alcoli e gli acidi minerali: l’acido nitrico, l’acido cloridrico, l’acido solforico e l’acqua regia, una miscela di acido nitrico e acido cloridrico. Dalla Cina giunse in Europa la notizia della scoperta dei nitrati e della polvere da sparo, che i cinesi usavano per produrre fuochi d'artificio e che nei paesi europei venne usata quasi immediatamente per costruire armi da fuoco. Alla fine del XIII secolo si era ormai sviluppata una vera e propria scienza chimica a servizio della tecnologia.
Dal punto di vista teorico, gli arabi avevano accolto le speculazioni di Aristotele rendendole più specifiche. Ad esempio, essi ritenevano che i metalli fossero composti da zolfo e mercurio, ma con questi due termini non intendevano indicare i due elementi, che conoscevano perfettamente, bensì le loro “essenze”. Il principio mercuriale conferiva al metallo la fluidità, mentre il principio sulfureo rendeva le sostanze combustibili e soggette alla corrosione.
Il Rinascimento
Durante il XIII e il XIV secolo l’influenza del pensiero aristotelico su tutte le branche della scienza andò diminuendo. Gli innumerevoli esperimenti e la prolungata osservazione della materia destarono i primi dubbi sulle spiegazioni semplicistiche del filosofo greco, dubbi che si diffusero velocemente grazie all’invenzione della stampa a caratteri mobili nel 1450. Dopo il 1500 la stampa permise una maggiore diffusione dei nuovi trattati sull’alchimia e sulle nuove tecnologie; il risultato di questa più ampia divulgazione di notizie fu evidente nel XVI secolo.
La nascita dei metodi quantitativi
Fra i trattati più diffusi in questo periodo, quelli di argomento mineralogico e metallurgico giocarono un ruolo di estrema importanza. Un ampio spazio veniva infatti dedicato alle tecniche di analisi delle rocce per valutarne il contenuto in metallo e ciò richiese l’uso di nuovi strumenti, come le bilance di precisione, e lo sviluppo di metodi quantitativi (Analisi chimiche). Anche gli studiosi di medicina cominciarono a sentire la necessità di conoscere con maggiore precisione i dosaggi dei farmaci da somministrare, perciò furono messi a punto i primi metodi chimici per la preparazione dei medicinali.
Studi mineralogici e di medicina vennero trattati unitamente nelle opere dello scienziato svizzero Theophrastus von Hohenheim, noto con il nome di Paracelso. Nato in una regione mineraria, questi si dedicò ben presto allo studio dei metalli e, in contrasto con la scienza del tempo, introdusse la iatrochimica, una nuova disciplina basata sull’uso di farmaci preparati chimicamente, ponendo le basi per la moderna farmacologia. Paracelso scoprì molti composti, realizzò nuove reazioni chimiche e modificò la teoria sulla composizione dei metalli, ipotizzando che fossero costituiti, oltre che dallo zolfo e dal mercurio, anche da un sale. A questo proposito sosteneva che durante la combustione del legno, la sua componente sulfurea bruciava, quella mercuriale vaporizzava e quella salina andava a costituire il residuo di cenere. I seguaci della iatrochimica di Paracelso ne mitigarono le teorie più estreme e raccolsero le ricette del maestro per la preparazione dei farmaci. Nel XVI secolo Andreas Libavius pubblicò il trattato Alchemia, considerato il primo effettivo libro di testo di chimica, che conteneva una esposizione razionalizzata e sistematica delle conoscenze iatrochimiche del tempo.
Nella prima metà del XVII secolo alcuni scienziati cominciarono a studiare le reazioni chimiche sperimentalmente, senza alcuno scopo tecnologico. Jan Baptista van Helmont, un medico convertitosi alla chimica, utilizzò la bilancia analitica in un importante esperimento volto a dimostrare che una ben precisa quantità di sabbia (silice) poteva essere fusa con un eccesso di alcali formando vetro solubile e che questa sostanza, trattata con acidi, avrebbe rigenerato la sabbia nell’esatta quantità iniziale. Venivano in questo modo gettate le basi del principio di conservazione della massa. Van Helmont dimostrò anche che in molte reazioni si liberava un “fluido aereo”, che chiamò gas, intuendo l’esistenza di un nuovo stato d’aggregazione della materia, quello aeriforme.
La teoria atomica
Durante gli esperimenti condotti nel XVI secolo si scoprì come ottenere il vuoto, cosa che Aristotele aveva considerato impossibile. Questo risultato richiamò l’attenzione sull’antica teoria di Democrito, secondo la quale la materia era costituita da atomi che si muovevano nel vuoto. Il filosofo e matematico francese René Descartes, conosciuto con il nome di Cartesio, sviluppò una teoria compiuta che spiegava i fenomeni naturali in base alla dimensione, alla forma e al moto degli atomi. Grazie agli esperimenti condotti dal chimico e fisico britannico Robert Boyle, autore della legge fondamentale che esprime la relazione inversa tra pressione e volume di un gas, cominciò a svilupparsi anche la teoria cinetica.
La teoria del flogisto
Nella seconda metà del XVII secolo il medico, economista e chimico tedesco Johann Joachim Becher, basandosi sulle teorie di Paracelso, compì le prime osservazioni che portarono all’elaborazione di una nuova teoria chimica: la teoria del flogisto. Secondo questa teoria, sviluppata da Becher e dal suo discepolo Georg Ernst Stahl, tutte le sostanze contengono un costituente particolare, detto flogisto (dal termine greco che significa “infiammabile”), che viene liberato durante la combustione. Anche l’ossidazione dei metalli veniva considerata una combustione e perciò era interpretata come rilascio di flogisto da parte del materiale; scaldando l’ossido del metallo in presenza di carbone, questo recuperava il flogisto, ricostituendo il metallo. Questa teoria, per quanto errata, costituisce il primo tentativo di interpretazione razionale dei processi ossidoriduttivi.
La chimica nel XVIII secolo
Grazie al grande numero di reazioni chimiche ormai conosciute, gli studiosi si resero conto che esistevano delle “affinità” tra le diverse sostanze, cioè che certi materiali reagivano più facilmente con alcuni composti piuttosto che con altri. Queste osservazioni vennero raccolte in tabelle che permettevano di prevedere l’esito di una reazione in base all’affinità dei reagenti, prima ancora di effettuare l’esperimento in laboratorio. Nel corso del XVIII secolo, facendo uso di queste conoscenze, vennero isolati molti metalli, di cui furono studiati i derivati. Contemporaneamente ciò stimolò lo sviluppo di nuovi metodi per le analisi qualitative e quantitative, ponendo i presupposti per lo sviluppo della moderna chimica analitica.
Anche lo studio dei gas fu affrontato in modo più rigoroso dopo l’invenzione, da parte del fisiologo britannico Stephen Hales, di uno strumento che permetteva di raccogliere i gas sviluppati durante una reazione chimica in un contenitore chiuso, in assenza di aria.
Un’importante risultato nell’ambito dellla ricerca sui gas venne ottenuto nel 1756 per merito dello scienziato britannico Joseph Black. Studiando la reazione di decomposizione del carbonato di magnesio, egli osservò che il riscaldamento di questo composto sviluppava rilevanti quantità di gas, lasciando un residuo che chiamò magnesia calcinata (ossido di magnesio); dalla reazione di questa sostanza con carbonato di sodio si otteneva il sale di partenza. Black chiamò il gas che si sviluppava (il composto oggi noto come diossido di carbonio) “aria fissa”, perché era come “intrappolata” all’interno del carbonato. In questo modo veniva per la prima volta dimostrato che i gas erano sostanze in grado di prendere parte a reazioni chimiche.
Una secondo passo verso lo sviluppo della chimica moderna si ebbe con la scoperta dell’idrogeno, inizialmente chiamato “aria infiammabile”, da parte del chimico Henry Cavendish. Questi introdusse inoltre delle nuove tecniche per isolare i gas che si liberavano durante le reazioni chimiche, e ciò permise al chimico e teologo Joseph Priestley di scoprire nuovi elementi gassosi, tra i quali l’ossigeno. Priestley intuì che questa sostanza era il costituente dell’aria coinvolto nei processi di combustione e di respirazione; tuttavia, convinto che le sostanze bruciassero meno rapidamente in presenza di ossigeno piuttosto che di aria, ritenne questo gas povero di flogisto dandogli il nome di “aria deflogisticata”.
L’esatto ruolo dell’ossigeno nelle reazioni di combustione venne definito dal chimico francese Lavoisier che diede all’elemento il nome attuale.
Lavoisier, Antoine-Laurent (Parigi 1743-1794), chimico francese. Studiò presso il Collège Mazarin; eletto membro dell'Accademia delle Scienze nel 1768, rivestì numerose cariche pubbliche; diresse l'arsenale di Parigi e fu al vertice della Tesoreria di stato. Tentò di riformare il sistema monetario e fiscale francese e di apportare modifiche ai metodi di coltivazione. In qualità di "fermier général" (esattore generale delle imposte) fu arrestato, processato dal tribunale rivoluzionario e ghigliottinato l'8 maggio 1794 (vedi Rivoluzione francese).
Gli esperimenti di Lavoisier furono tra i primi veri e propri esperimenti di chimica quantitativa mai effettuati: egli dimostrò che, sebbene la materia muti di stato nel corso di una reazione chimica, la quantità di sostanza rimane la medesima sia all'inizio che al termine di qualsiasi reazione, offrendo così la prova del principio di conservazione della materia. Lavoisier studiò anche la composizione dell'acqua e battezzò i componenti dell'acqua "ossigeno" e "idrogeno". Alcuni tra i suoi principali esperimenti ebbero per oggetto la natura della combustione. Grazie a questi esperimenti egli spiegò che la combustione coinvolge la reazione di una sostanza con l'ossigeno e spiegò inoltre il ruolo svolto dall'ossigeno nella respirazione degli animali e delle piante. La spiegazione fornita da Lavoisier sul processo di combustione sostituì la teoria, secondo cui i materiali, bruciando, rilasciano una sostanza detta "flogisto".
Insieme al chimico Claude-Louis Berthollet e ad altri, introdusse nella sua opera Metodo di nomenclatura chimica (1787) una nomenclatura che è alla base di quella moderna; nel Trattato sugli elementi chimici (1789) Lavoisier spiegò il concetto in base al quale un elemento, inteso come sostanza semplice, non può essere scomposto conformemente ad alcun metodo noto di analisi chimica; inoltre sviluppò una teoria concernente la formazione dei composti chimici dagli elementi. Fu anche autore di: Sulla combustione (1777) e Considerazioni sulla natura degli acidi (1778).
La nascita della chimica moderna
Con una serie di esperimenti Lavoisier dimostrò che l’aria contiene il 20% di ossigeno e che la combustione è dovuta alla reazione di questo elemento con la sostanza combustibile, negando quindi l’esistenza del flogisto. Lavoisier diede inoltre la prima definizione di elemento chimico (una sostanza che non può essere ulteriormente decomposta) e diede una prima versione della legge di conservazione della massa. A seguito delle sue scoperte sulla combustione, riformò la nomenclatura chimica, ai tempi ancora basata sugli antichi termini alchimistici, introducendo le denominazioni sistematiche ancora oggi in uso. Dopo il suo assassinio, avvenuto nel 1794 per mano dei giacobini, i suoi discepoli proseguirono la fondamentale opera del maestro, ponendo le basi della chimica moderna. Poco più tardi, il chimico svedese Jöns Jakob Berzelius propose di indicare gli elementi con le prime lettere dei loro nomi latini, sistema adottato tuttora.
La chimica del XIX e del XX secolo
Gli sviluppi della chimica analitica permisero al chimico francese Joseph-Louis Proust di dimostrare che gli elementi sono presenti in ogni composto secondo un rapporto definito e costante. Nello stesso periodo il chimico e fisico francese Joseph-Louis Gay-Lussac scoprì che i rapporti dei volumi con cui i gas reagiscono sono numeri interi e, generalmente, piccoli (legge delle combinazioni gassose). Mancava tuttavia una giustificazione teorica di queste osservazioni. Nel 1803 lo scienziato britannico John Dalton propose una teoria atomica secondo la quale ogni elemento era costituito da atomi di massa e dimensioni ben precise. Basandosi solo sulla legge delle proporzioni definite e costanti, Dalton non poteva definire le formule dei composti in modo assoluto, perciò assegnò arbitrariamente peso atomico unitario all’idrogeno e calcolò il peso atomico relativo dell’ossigeno dai rapporti di combinazione, assumendo per l’acqua la formula HO; applicando la stessa procedura ad altri composti ottenne i pesi atomici relativi di tutti gli elementi allora noti. Dalla teoria atomica, egli dedusse la legge delle proporzioni multiple: se due elementi diversi formano più di un composto, le quantità in peso del primo elemento che si combinano con una quantità fissa del secondo stanno tra loro come numeri interi. Questa previsione venne ben presto avvalorata dai risultati sperimentali.
Teoria molecolare
La teoria di Dalton mancava di un’effettiva distinzione tra atomo e molecola, non prendeva in considerazione le osservazioni di Gay-Lussac sulle combinazioni gassose e, se si assumeva per l’acqua la formula HO, portava a conclusioni in contrasto con i dati sperimentali; infatti il vapore acqueo avrebbe dovuto possedere una densità superiore a quella dell’ossigeno, di formula O, mentre ciò non trovava riscontro nell’osservazione.
La giusta interpretazione venne data nel 1811 dal fisico italiano Amedeo Avogadro, il quale formulò la legge secondo cui volumi uguali di gas diversi, nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di particelle. Quindi, avendo osservato che un certo volume di ossigeno reagiva con un volume doppio di idrogeno per formare l’acqua e avendo raffrontato le densità dei due gas, sostenne che la formula dell’acqua doveva essere H2O. Queste conclusioni rendevano conto di tutti i dati sperimentali ed erano in accordo con la legge della combinazione dei gas. Avogadro aveva quindi intuito correttamente l’esistenza delle molecole ma, i suoi risultati non trovarono il credito che meritavano. Solo molti anni dopo, nel 1860, l’ipotesi di Avogadro venne ripresa dal chimico italiano Stanislao Cannizzaro, divenendo la base della chimica.
Contemporaneamente altri campi della chimica venivano investigati; la scoperta nel 1800 della pila a opera dello scienziato italiano Alessandro Volta e lo studio dell’elettrochimica portarono a ritenere che le forze che tengono uniti gli elementi nei composti fossero di natura elettrostatica. In particolar modo lo scienziato svedese Jöns Jacob Berzelius sviluppò una teoria secondo cui tutti gli elementi contengono particelle positive e negative, ma in alcuni di essi prevalgono le prime, in altri le seconde; perciò gli elementi con cariche opposte si attraggono e sono quindi uniti da forze elettrostatiche. La teoria di Berzelius si rivelò valida per la chimica inorganica; infatti le sostanze fino ad allora studiate erano composti ionici e il legame tra gli ioni (e non tra gli atomi, come questo scienziato pensava) è effettivamente basato sull’attrazione tra cariche opposte.
Nuovi campi della chimica
I principali sviluppi del XIX secolo si ebbero nel campo della chimica organica (detta chimica del carbonio). La nascita del concetto di valenza, la scoperta del carbonio tetraedrico a opera di van't Hoff e la descrizione della struttura del benzene per merito di Kekule permisero di comprendere il legame chimico anche nelle molecole organiche e diedero un forte impulso alla sintesi di nuovi composti. È in questo periodo che, soprattutto in Germania, vennero fondate le più importanti industrie chimiche moderne.
Anche la chimica inorganica richiedeva una razionalizzazione; il chimico russo Dmitrij Ivanovic Mendeleev, nel 1869, e il chimico tedesco Julius Lothar Meyer, nel 1870, formularono separatamente una tavola periodica in cui classificarono tutti gli elementi noti in base alle somiglianze di comportamento osservate e alla graduale variazione di proprietà nei gruppi di elementi successivi. Sulla base di questa tavola e della legge della periodicità osservata, Mendeleev riuscì a prevedere l’esistenza di alcuni elementi ancora ignoti, indicando con una certa precisione le loro proprietà.
I risultati raggiunti nel campo della fisica indussero alcuni scienziati ad applicare modelli matematici alla chimica. Lo studio delle velocità di reazione portò alle teorie cinetiche, soprattutto a opera del chimico svedese Svante August Arrhenius, e la termodinamica trovò varie applicazioni. L’analisi degli spettri di assorbimento e di emissione venne approfondito, portando allo sviluppo della spettroscopia. Vennero inoltre condotte le prime ricerche sui colloidi e sulla fotochimica. Verso la fine del XIX secolo era ormai nata la chimica fisica.
Quando sembrava che tutte le branche della chimica fossero già state studiate, la scoperta della radioattività aprì un nuovo campo di interesse. Vennero usati metodi chimici per separare i nuovi elementi, come il radio e l’uranio, e per sintetizzare e isolare gli elementi transuranici. Il nuovo modello di struttura atomica elaborato dai fisici fornì una spiegazione alla vecchia idea di affinità tra gli elementi e alla relazione tra composti polari e non polari.
All’inizio del XX secolo nacque un’altra importante disciplina, la biochimica. Dalla semplice analisi dei fluidi corporei si passò ben presto allo studio della funzione e della natura delle cellule più complesse. I biochimici degli anni Cinquanta compresero la struttura del DNA e la funzione dei geni, dando origine a una nuova scienza, la biologia molecolare.
Recenti sviluppi della chimica
La chimica ha avuto un’enorme influenza sulla vita. All’inizio le tecnologie chimiche venivano impiegate per isolare prodotti naturali e trovarne nuove applicazioni. Nel XIX secolo vennero invece sintetizzate sostanze completamente nuove, migliori o più economiche di quelle naturali. Gli studi nel campo della scienza dei materiali hanno portato alla scoperta di nuove sostanze, quali gli ossidi ceramici superconduttori, i polimeri luminescenti e la serie di composti derivati dai fullereni.
Al tempo stesso alcuni scienziati che si occupavano di discipline sviluppatesi separatamente, come la fisica, la biologia e la geologia, cominciarono a interessarsi alla chimica. Il risultato fu la nascita di studi interdisciplinari come la geochimica o la biochimica.
L’uso di sofisticati strumenti e lo sviluppo delle biotecnologie hanno permesso di intraprendere il Progetto Genoma Umano, una ricerca scientifica su scala internazionale che si pone l’obiettivo di arrivare a specificare l’intero patrimonio genetico dell’uomo.
Chimica nucleare
Atomo, elemento e composto
L’Atomo è la più piccola porzione di materia che può definire un elemento e che ne possiede le proprietà chimiche. La parola "atomo", che deriva dal greco átomos, "indivisibile", veniva usata dagli antichi filosofi per definire le entità elementari, indistruttibili e indivisibili, che costituivano la materia.
E’ un elemento ogni sostanza che non può essere scomposto in sostanze più semplici per mezzo di operazioni chimiche, è quindi una quantità di materia fatta da atomi tutti uguali
Per molecola si intende invece la più piccola particella di una sostanza, formata dall’unione di due o più atomi.
Le molecole degli elementi sono formate da due o più atomi uguali, cioè sono biatomiche o poliatomiche; le molecole dei composti sono formate da due o più atomi diversi.
Nuclidi o nucleoni
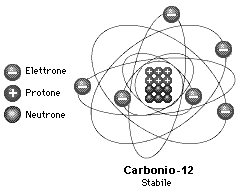 23Na e 24Na. Un nucleo caratterizzato da un numero definito di neutroni e di protoni viene detto nuclide.
23Na e 24Na. Un nucleo caratterizzato da un numero definito di neutroni e di protoni viene detto nuclide.
Gli isotopi sono due o più atomi aventi lo stesso numero atomico, ma diverso numero di massa. ( isobari con Z variabile) Il numero atomico è dato dal numero di protoni contenuti nel nucleo, mentre il numero di massa è la somma totale di protoni e neutroni; di conseguenza gli isotopi di un elemento hanno lo stesso numero di protoni ma contengono un diverso numero di neutroni. Essi occupano la stessa posizione nella tavola periodica, contengono un ugual numero di elettroni e hanno nuclei con uguale carica elettrica.
Il peso di un nucleone equivale a 1 Dalton (u), 1/1836 Dalton è il peso di un elettrone
La massa di un atomo espressa in termini dell'unità di massa atomica (amu). Questa unità è definita come 0 della massa dell'atomo di carbonio più abbondante, l'isotopo carbonio-12. La massa atomica degli atomi presenti in natura varia da un valore di circa 1 per l'idrogeno fino a circa 238 per uno degli isotopi dell'uranio. Massa di una molecola espressa in unità di massa atomica (1 amu è definito come 0 della massa del carbonio-12, ed equivale a 1,66033 × 10-24 g).
Il peso molecolare di un composto può essere calcolato come la somma dei pesi atomici di tutti gli atomi che lo costituiscono.
Schema dei periodi
 Secondo il modello quanto-meccanico, l’elettrone non viene descritto come se si venisse su un’orbita precisa; si dice invece che l’elettrone occupa uno spazio tridimensionale detto orbitale. L’orbitale rappresenta l’espressione matematica che descrive lo stato energetico della nube elettronica ed è materialmente la regione di spazio intorno al nucleo in cui la probabilità di trovare un elettrone è attorno al 95%.
Secondo il modello quanto-meccanico, l’elettrone non viene descritto come se si venisse su un’orbita precisa; si dice invece che l’elettrone occupa uno spazio tridimensionale detto orbitale. L’orbitale rappresenta l’espressione matematica che descrive lo stato energetico della nube elettronica ed è materialmente la regione di spazio intorno al nucleo in cui la probabilità di trovare un elettrone è attorno al 95%.
Un orbitale esiste se è percorso da almeno un elettrone, e secondo il principio di esclusione di Pauli in ciascun orbitale possono al massimo essere presenti due elettroni con spin opposto.
Esistono 1 orbitale sferico S, 3 orbitali P, 5 orbitali D e 7 orbitali F con 6 o 8 lobi (confronta con la figura a lato). Gli orbitali D sono troppo grandi e passano perciò al livello successivo, gli orbitali F passano due livelli successivi.
Strato |
Livello |
|
|
|
|
Elettroni |
Numero atomico |
|
K |
1° Liv. |
S |
|
|
|
2 |
2 |
s |
L |
2° Liv. |
S |
|
|
PPP |
8 |
10 |
sp |
M |
3° Liv. |
S |
|
|
PPP |
8 |
18 |
sp |
N |
4° Liv. |
S |
|
3 DDDDD |
PPP |
18 |
36 |
s(3d)p |
O |
5° Liv. |
S |
|
4 DDDDD |
PPP |
18 |
54 |
s(4d)p |
P |
6° Liv. |
S |
4 FFFFFFF |
5 DDDDD |
PPP |
32 |
86 |
s(4f)(5d)p |
Q |
7° Liv. |
S |
5 FFFFFFF |
6 DDDDD |
PPP |
32 |
118 |
s(5f)(6d)p |
Legami chimici
Il legame
Gli atomi isolati degli elementi, esclusi i gas nobili, sono, in varia misura, energicamente instabili perché i loro livelli di valenza sono incompleti, cioè non contengono il massimo numero possibile di elettroni. Il solo modo per stabilizzarsi è quello di unirsi con altri atomi con cui realizzare opportuni scambi di elettroni di valenza, in modo che ciascun atomo contraente possa assicurarsi un assetto elettronico uguale a quello di un gas nobile contiguo nel sistema periodico.
Prendono, dunque, il nome di legami chimici le unioni tra atomi in cui intervengono forze attrattive di natura elettrica tra nuclei ed elettroni di valenza.
Il legame chimico si forma in seguito alle forti interazioni tra atomi ed è responsabile della formazione delle molecole. Quando due o più atomi vengono posti a breve distanza, si manifesta una forza attrattiva tra gli elettroni dei singoli atomi e i nuclei vicini; se questa forza è sufficientemente intensa da mantenere uniti gli atomi, si forma un legame chimico. Tutti i legami chimici derivano dallo scambio o dalla condivisione di elettroni da parte di almeno due atomi.
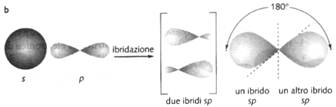
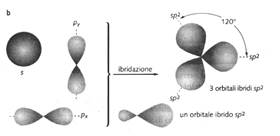
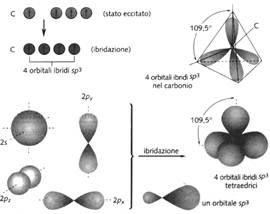
Ibridizzazione
Tipi di legami
Il legami atomici sono:
Il legame covalente omeopolare si forma in seguito alla condivisione di almeno due elettroni da parte di una coppia di atomi uguali (come N2 o O2); in questo caso gli elettroni di legame sono distribuiti in ugual misura sui due atomi. Se gli atomi formanti la molecola sono di tipo differente (come nell'ossido di azoto, NO), il legame si dice covalente eteropolare; gli elettroni di legame sono più vicini all'atomo più elettronegativo, così da generare un polo di carica debolmente positiva e uno di carica debolmente negativa. Sostanze di questo tipo non conducono l'elettricità, non hanno lucentezza, duttilità, né malleabilità.
1° gruppo |
2° gruppo |
3° gruppo |
4° gruppo |
5° gruppo |
6° gruppo |
7° gruppo |
|
Per essere accettori |
Per essere donatori |
Non può fare legami dativi |
Ibrida e fa due legami covalenti |
Ibrida e fa 3 legami covalenti |
Ibrida e fa 4 legami covalenti |
Non possono ibridare perché non ci sono orbitali vuoti |
|
Ossigeno elem.VI |
|
||
|
|
|
|
1 legame dativo |
2 legami dativi |
3 orbitali dativi |
|
con un legame dativo si arrivi a un ottetto |
deve aver già raggiunto l'ottetto |
|
|
|
|
|
|
|
|
Idrogeno H+ |
5°, 6°, 7° gruppo |
|
|
|
|
|
|
|
|
con un orbitale vuoto |
deve aver un doppietto libero |
Nel caso del legame dativo, i due elettroni di legame provengono da un unico atomo: un atomo, definito "donatore", cede il proprio elettrone a un altro atomo, chiamato "accettore".
Nei legami covalenti omeopolari e metallici, pertanto, si ha una distribuzione omogenea di elettroni; una distribuzione eterogenea è invece alla base di legami covalenti polari; il completo trasferimento elettronico da un atomo all'altro caratterizza infine i legami ionici. Il tipo di legame che si forma è determinato dalla differenza di elettronegatività tra gli atomi coinvolti.
Tra 0 e 0,4 |
Legame covalente |
|
|
Sodio |
0,9 |
Tra 0,4 e 2,5 |
Legame eteropolare |
|
|
Idrogeno |
2,1 |
Tra 2 e 2,6 |
Legame eteropolare tendente allo ionico |
anidro |
|
Carbonio |
2,5 |
Tra 2,6 e 3,3 |
Legame ionico |
in acqua |
|
Azoto/Cloro |
3 |
|
|
|
|
Ossigeno |
3,5 |
|
|
|
|
Fluoro |
4 |
Si chiama metallico il legame fra elementi metallici; in questo caso gli elettroni sono delocalizzati su tutti gli atomi e perciò sono in grado di muoversi liberamente nel solido, dando luogo alle tipiche caratteristiche di conducibilità elettrica e termica, di lucentezza, di malleabilità e di duttilità dei metalli. Tutti i metalli allo stato solido sono costituiti da un reticolo ordinato di atomi privi dell'elettrone più esterno (cationi). Gli elettroni di valenza sono liberi di muoversi in tutto il metallo e di formare legami non direzionali. Ciò spiega il motivo per cui i metalli conducono bene l’elettricità e sono generalmente malleabili.
I legami elettrostatici sono:
Il legame ionico che si instaura quando gli atomi di un metallo, trasformati in ioni positivi (cationi), si legano con gli ioni negativi (anioni) di un non metallo; la forza di tale legame è puramente di natura elettrostatica. Grazie alla mobilità degli ioni, i composti ionici conducono l'elettricità quando sono in soluzione acquosa o allo stato fuso.
È dunque una attrazione tra cariche intere opposte.
Il legame ione - di polo che s’instaura tra uno ione (+ o -) e una molecola di polo e visti il numero di legami molto alti è preferibile allo ionico perché è molto più conveniente.
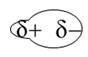 I legami di Van der Waals : Di polo – di polo, di polo – di polo indotto, di polo indotto - di polo indotto.
I legami di Van der Waals : Di polo – di polo, di polo – di polo indotto, di polo indotto - di polo indotto.
Il di polo è una molecola costruita con un legame eteropolare con i poli parzialmente positivi o negativi.
Il legame di polo – di polo è il legame a idrogeno che è molto più forte (per la differenza di elettronegatività) e frequente degli altri due e si forma quando un atomo di idrogeno, legato per mezzo di un legame covalente a un atomo più elettronegativo (come ad esempio, O, N, F), ha interazioni elettrostatiche con gli atomi (di O, N, F, Cl) di un'altra molecola. [ La presenza del legame idrogeno tra le molecole d'acqua spiega la temperatura di ebollizione di 100 °C; in sua assenza infatti, l'acqua bollirebbe a - 80 °C e a temperatura ambiente sarebbe quindi allo stato aeriforme.
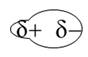 Il di polo – di polo indotto avviene tra un di polo e un molecola con un legame omeopolare che viene indotto a una squilibrio di cariche diventando un di polo.
Il di polo – di polo indotto avviene tra un di polo e un molecola con un legame omeopolare che viene indotto a una squilibrio di cariche diventando un di polo.
Quando questo di polo indotto induce un omeopolare si tratta del legame di polo indotto - di polo indotto.
Valenza
H; Li; Na; K |
1+ |
Cu |
1+ 2+ |
C |
2+ 4+ |
B 3+ |
Mg; Ca |
2+ |
Hg |
1+ 2+ |
Cl; Br; I |
1+ 3+ 5+ 7+ 1- |
|
Zn |
2+ |
Sn; Pb |
2+ 4+ |
O |
2- |
|
Al |
3+ |
N; P |
3+ 5+ 3- |
F |
1- |
|
Fe |
2+ 3+ |
S |
4+ 6+ 2- |
Si |
4+ |
|
Negli atomi, gli elettroni degli orbitali più interni sono attratti dal nucleo in modo molto intenso e non intervengono nelle interazioni con altri atomi. Solo gli elettroni che si trovano nelle zone più esterne dell'atomo, detti elettroni di valenza, possono essere coinvolti nella formazione di legami chimici; se si utilizza la notazione più vecchia, che impiega i numeri romani per distinguere i diversi gruppi della tavola periodica, il numero di elettroni di valenza è fornito dal gruppo cui l'atomo appartiene.
Così, gli elementi dei gruppi IA (o 1) e IB (o 11) hanno un solo elettrone di valenza; ne hanno due gli elementi dei gruppi IIA (o 2) e IIB (o 12) e quattro gli elementi dei gruppi IVA (o 4) e IVB (o 14). Tutti gli elementi dell'ottavo gruppo del sistema periodico (cioè neon, argo, cripto, xeno e rado) sono gas poco reattivi che esistono solo in forma monoatomica; in seguito alla scarsa reattività vengono chiamati gas nobili. A eccezione dell'elio, essi sono caratterizzati dall'avere otto elettroni negli orbitali più esterni, e questa configurazione elettronica conferisce loro bassa energia e quindi elevata stabilità. Tutti gli elementi tendono, con la formazione di legami chimici, ad assumere una struttura stabile raggiungendo la configurazione elettronica esterna caratteristica del gas nobile più vicino nella tavola periodica. Tale comportamento è stato riassunto nella regola dell'ottetto enunciata dal chimico americano Gilbert Newton Lewis.
I metalli nei gruppi IA (o 1) e IB (o 11) della tavola periodica tendono a perdere un elettrone per formare ioni con una carica positiva, quelli dei gruppi IIA (o 2) e IIB (o 12) tendono a perdere due elettroni così da formare ioni con due cariche positive; analogamente si verifica per gli altri gruppi. Gli alogeni (gruppo VIIB o 17) tendono ad acquistare un elettrone per formare ioni con carica negativa mentre gli elementi del gruppo VIB (o 16) ne acquistano due formando ioni con due cariche negative.
Si consideri ad esempio la molecola di cloro (Cl2): ciascun atomo ha 35 elettroni, uno in meno rispetto all'atomo di argo, il gas nobile più vicino nella tavola periodica, cosicché quando due atomi di cloro formano un legame covalente omeopolare condividendo due elettroni, entrambi raggiungono una configurazione elettronica con 36 elettroni. Generalmente si rappresenta la coppia di elettroni condivisi con la formula Cl:Cl. L'atomo di ossigeno ha in totale otto elettroni, due in meno rispetto al gas nobile più vicino, il neon; quando due atomi di ossigeno si legano per formare la molecola O2, mettono in compartecipazione quattro elettroni, due per ogni atomo. In questo caso si forma tra i due atomi un doppio legame, O;O. Allo stesso modo gli atomi di azoto nella molecola corrispondente condividono tre elettroni formando un legame triplo, N…O. Nel diossido di carbonio, sia il carbonio (con sei elettroni propri) sia l'ossigeno (con otto) riescono a raggiungere il numero di elettroni del neon formando due doppi legami: O;C;O. In tutte queste formule di legame sono rappresentati solo gli elettroni coinvolti nei legami stessi.
Nomenclatura
1 valenza - ossido di … o anidride + … ica
2 valenze - minima …osa
massima …ica
 4valenze ipo … osa
4valenze ipo … osa
……… osa
……… ica
per … ica
Formazione di ossidi basici e di idrossidi dai metalli
Una reazione in cui un elemento chimico reagiscono con l’ossigeno si chiama reazione di ossidazione. Si ottiene così un ossido basico che fatto reagire con l’acqua forma l’idrossido o base.
Formazione di ossidi acidi e di acidi ossigenati o ossoacidi dai non metalli
Quando un non metallo si combina con l’ossigeno forma un ossido acido o anidride. Quest’ultimo reagendo con l’acqua forma un acido che, poiché contiene ossigeno, è detto ossoacido.
Formazione degli idracidi
Un particolare gruppo di non metalli: gli alogeni (gruppo VII A) e lo zolfo reagiscono con l’idrogeno formando gli idracidi.
Nomenclatura IUPAC
Nei composti binari contenenti ossigeno si usa l’espressione di ossido di più il nome , quando invece esistono più atomi di ossigeno o dell’altro elemento si usano i prefissi:
(Mono-); di-; tri-; tetra-; penta-; esa-; epta-.
Nei composti binari non contenenti ossigeno si aggiunge –uro all’elemento che si trova a destra della formula seguito da di e il nome del secondo elemento.
In caso di più atomi si usano i prefissi sopraindicati
Negli idrossidi si usa l’espressione idrossido di più il nome e a seconda di quanti gruppi OH si aggiunge di-; tri-; tetra-.
Negli ossiacidi si usa acido più il nome dell’acido con il suffisso –ico. Viene anche precisato il numero di ossigeni con i prefissi monoosso-; diosso-; triosso-;….
Si aggiunge i soliti prefissi al non metallo. (es. H2Cr2O7 acido eptaossodicromico VI )
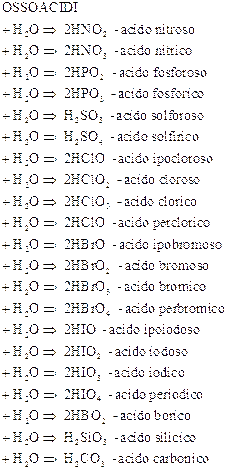
Formazione dei sali
Un sale (con l’acqua) è il prodotto di una reazione di neutralizzazione tra un acido e una base(idrossido).
 BASE + ACIDO SALE + ACQUA
BASE + ACIDO SALE + ACQUA
Trasformazioni chimiche
Legge dei volumi di combinazione (Gay-Lussac)
Nel 1808 Gay-Lussac enunciò la legge omonima sui gas: la legge di Gay-Lussac, detta “dei volumi” o delle “combinazioni gassose”, stabilisce in una reazione chimica tra sostanze allo stato gassoso, i volumi delle sostanze gassose che si combinano con i volumi delle sostanze prodotte nella reazione stanno tra loro secondo rapporti espressi da numeri semplici interi.
Per esempio nella sintesi dell’acqua, i volumi dei gas reagenti e dei gas prodotti stanno fra loro nei seguenti rapporti: idrogeno : ossigeno : vapore acqueo
2 : 1 : 2
Legge di Avogadro
Per spiegare la legge di Gay-Lussac Avogadro suggerì che alcuni elementi allo stato gassoso fossero costituiti da molecole biatomiche. Avogadro formulò anche una legge fondamentale della chimica che afferma che a temperatura e pressione identiche, volumi uguali di gas differenti contengono lo stesso numero di molecole.
La mole
La mole Quantità di sostanza che contiene un numero di particelle (atomi, ioni o molecole) uguale al numero di atomi contenuti in dodici grammi di carbonio 12. Per definizione, una mole di una qualunque sostanza contiene sempre lo stesso numero di particelle; tale numero è detto numero di Avogadro e il suo valore, determinato mediante tecniche diverse, è fissato a 6,022 x 1023 (ovvero 600.000 milioni di milioni di milioni). Così, poiché un atomo di carbonio ha massa pari a circa dodici volte quella dell'atomo di idrogeno, 12 g di carbonio e 1 g di idrogeno allo stato atomico contengono lo stesso numero di particelle.
Numero di Avogadro indicato con il simbolo NA o N0, equivale a 6,022045 × 1023, media approssimata dei dati ottenuti mediante metodi sperimentali chimici e fisici indipendenti.
L’equazione chimica
Una equazione chimica indica:
Dal punto di vista qualitativo
- quali sono i reagenti e i prodotti
- le formule dei reagenti e dei prodotti
Dal punto di vista quantitativo
- il numero di molecole dei reagenti o dei prodotti
- il numero degli atomi di ciascun elemento coinvolto
- il numero delle masse molari di ciascuna sostanza coinvolta
- il numero di moli di ciascuna sostanza coinvolta
- il numero di grammi di ciascuna sostanza reagente o prodotta
I tipi di reazioni chimiche
Reazione di sintesi
In una reazione di sintesi, due o più sostanze si combinano insieme per formare un prodotto di reazione.
 A + B AB
A + B AB
Reazione di decomposizione
In una reazione di decomposizione una singola sostanza (composto) si decompone producendo due o più sostanze più semplici (elementi o composti)
 AB A+B
AB A+B
Reazione di spostamento
In una reazione di spostamento (o semplice sostituzione ) un elemento chimico reagisce con un composto spostando, e quindi sostituendo, un altro elemento presente nel composto
- Un metallo reagisce con un certo composto spostando un altro elemento meno reattivo presente nel composto.
 A + BC B + AC
A + BC B + AC
- Un non metallo reagisce con un certo composto spostando un altro elemento meno reattivo presente nel composto.
 A + BC C + BA
A + BC C + BA
Reazione di doppio scambio
In una reazione di doppio scambio ( o doppia sostituzione ) due composti si scambiano reciprocamente i propri costituenti, formando due composti differenti
 AB + CD AD + CB
AB + CD AD + CB
Le reazioni avvengono tra reagenti in soluzione acquosa e si dividono in
- Reazione di neutralizzazione
- Formazione di un precipitato insolubile
- Formazione di una sostanza gassosa
Reazione di dissociazione
Una reazione in cui da una molecola si ottengono due ioni
Gas
Definizione
Il gas è una sostanza che si trova in un particolare stato di aggregazione. La materia può esistere in tre stati diversi, solido, liquido e gassoso, caratterizzati da proprietà microscopiche e macroscopiche differenti. I solidi hanno forma ben definita e sono difficilmente deformabili; i liquidi hanno volume proprio ma assumono la forma del recipiente che li contiene; infine i gas non hanno volume definito e si espandono rapidamente occupando tutto lo spazio a disposizione; inoltre hanno densità minore rispetto a quella dei liquidi e dei solidi.
La legge del gas perfetto
La teoria atomica della materia definisce gli stati di aggregazione, o fasi, in termini microscopici. Le molecole di un solido occupano posizioni fisse all’interno di un reticolo regolare e la loro libertà di movimento è limitata a piccole vibrazioni attorno ai siti reticolari. Al contrario, non vi è alcun ordine spaziale macroscopico nei gas: le molecole si muovono a caso, trattenute solo dalle pareti del recipiente che le contiene.
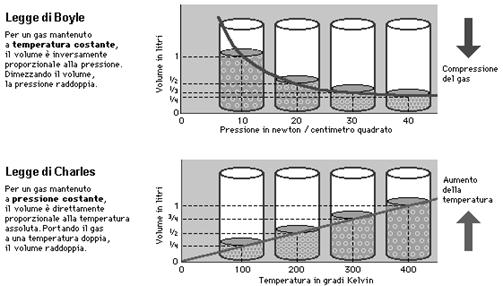 Le variabili macroscopiche che caratterizzano lo stato di un gas, quali pressione (P), volume (V) e temperatura (T), sono correlate per mezzo di relazioni empiriche. La legge di Boyle stabilisce che in un gas, in condizioni di temperatura costante, il volume è inversamente proporzionale alla pressione; la legge di Gay-Lussac afferma che, a volume costante, la pressione è proporzionale alla temperatura assoluta. Combinando queste due leggi si ottiene la legge generale, nota anche come equazione di stato del gas perfetto: PV/T= R (per mole). R è una costante universale, la cui scoperta rappresentò una pietra miliare della scienza moderna.
Le variabili macroscopiche che caratterizzano lo stato di un gas, quali pressione (P), volume (V) e temperatura (T), sono correlate per mezzo di relazioni empiriche. La legge di Boyle stabilisce che in un gas, in condizioni di temperatura costante, il volume è inversamente proporzionale alla pressione; la legge di Gay-Lussac afferma che, a volume costante, la pressione è proporzionale alla temperatura assoluta. Combinando queste due leggi si ottiene la legge generale, nota anche come equazione di stato del gas perfetto: PV/T= R (per mole). R è una costante universale, la cui scoperta rappresentò una pietra miliare della scienza moderna.
Leggi del gas
Leggi fisiche che descrivono il comportamento dei gas in funzione delle variabili di stato, quali volume, temperatura e pressione. Esse si riferiscono in particolare ai gas "ideali" (in cui si trascurano le interazioni reciproche tra particelle costituenti e l'attrito interno), ma il più delle volte sono sufficienti per una descrizione esauriente del comportamento generale dei gas. Esistono comunque delle correzioni che rendono conto più specificatamente delle caratteristiche dei gas "reali".
La legge di Boyle (isoterma), così chiamata dal nome del chimico britannico Robert Boyle, afferma che: "il prodotto della pressione e del volume di una massa fissata di gas è costante in qualunque trasformazione isoterma, cioè in qualunque processo in cui la temperatura sia mantenuta costante". L'espressione in formule di questa legge è: P x V = costante.
La legge di Charles (isobara) prende il nome del chimico francese J.-A.-C. Charles. Nel suo enunciato originale, essa dice che in qualunque trasformazione isobara, cioè a pressione costante, il volume di un gas aumenta di una frazione pari a 1/273 del volume da esso occupato alla temperatura di 0 °C, per ogni aumento di temperatura di 1 grado Celsius. Fu questa una delle prime occasioni in cui emerse l'esigenza di definire un valore di temperatura che corrispondesse a -273 ° C. In base a tale valore, detto zero assoluto, venne stabilità la scala della temperatura assoluta. Se si misura la temperatura rispetto a questa scala (in cui 0 °C corrisponde approssimativamente a 273 K [273,15K] ), la legge di Charles può essere riformulata più semplicemente nel seguente modo: il volume di un gas nelle trasformazioni a pressione costante è proporzionale alla temperatura assoluta. In formule tale legge si scrive: V a T.
La legge delle pressioni (isocora) afferma che nelle trasformazioni a volume costante, la pressione di un gas è proporzionale alla temperatura. In simboli: P a T.
Queste tre leggi possono essere combinate in un'unica utilissima equazione, che prende il nome di equazione di stato dei gas perfetti, e che può essere scritta nella forma PV = n RT, dove n rappresenta il numero di moli di gas contenute nel campione e R è una costante, detta costante dei gas. In alternativa l'equazione di stato può essere espressa dalla relazione (P1 V1) / T1 = (P2 V2) / T2 dove l'indice "1" si riferisce ai valori di pressione, volume e temperatura del gas a uno stadio della trasformazione, e l'indice "2" si riferisce a uno stadio successivo. Se, ad esempio, si trova che il volume di un campione di idrogeno è di 100 cm cubi in condizioni di temperatura di 25 °C (298 K) e di pressione atmosferica pari a 97,0 kPa (kilopascal), si può ricorrere a questa equazione per calcolare quale sia il volume occupato dalla stessa quantità di gas in condizioni di temperatura e pressione standard (cioè 273,15 K e 101,325 kPA).
È possibile ricavare le leggi dei gas a partire da considerazioni teoriche basate sulla teoria cinetica dei gas. In questa teoria i gas ideali vengono considerati come costituiti da particelle infinitamente piccole (puntiformi), che danno luogo a urti perfettamente elastici, e che non interagiscono l'una con l'altra mediante alcun tipo di forza. Questi assunti valgono solo approssimativamente per i gas reali, il cui comportamento devia infatti leggermente da quello prescritto dalle leggi. In generale, la deviazione del comportamento di un gas da quello ideale si fa più pronunciata quanto più ci si avvicina alla sua temperatura di liquefazione.
Teoria cinetica dei gas
L’avvento della teoria atomica permise di dare un’interpretazione teorica delle leggi empiriche che descrivono il comportamento dei gas: il volume rappresenta lo spazio disponibile per il moto delle molecole; la pressione, che può essere misurata con un manometro fissato alla parete del contenitore, rappresenta la variazione media della quantità di moto subita dalle molecole quando entrano in collisione con le pareti e vengono di conseguenza riflesse; la temperatura è proporzionale all’energia cinetica media delle molecole, cioè al quadrato della loro velocità media.
La riduzione di queste grandezze macroscopiche alle variabili di posizione, velocità, quantità di moto ed energia cinetica delle molecole permette di studiare il comportamento dei gas in termini statistici, sulla base dei principi della meccanica classica.
La teoria che collega le proprietà dei gas alla meccanica classica prende il nome di cinetica dei gas; oltre a fornire l’interpretazione teorica dell’equazione di stato dei gas perfetti, essa consente di dedurre una serie di altre proprietà dei gas, come la legge di distribuzione delle velocità molecolari e le proprietà di trasporto.
Tabella sintetica di alcuni elementi
Elemento |
Simbolo |
|
|
Numero Atomico |
Massa Atomica |
Configurazione Elettronica esterna |
Idrogeno |
H |
1°gruppoA e 1° periodo |
Metallo |
1 |
1 |
1s1 |
Litio |
Li |
1°gruppoA e 2° periodo |
Metallo |
3 |
7 |
[He]2s1 |
Sodio |
Na |
1°gruppoA e 3° periodo |
Metallo |
11 |
23 |
[Ne]3s1 |
Potassio |
K |
1°gruppoA e 4° periodo |
Metallo |
19 |
39 |
[Ar]4s1 |
Magnesio |
Mg |
2°gruppoA e 3° periodo |
Metallo |
12 |
24 |
[Ne]3s2 |
Calcio |
Ca |
2°gruppoA e 4° periodo |
Metallo |
20 |
40 |
[Ar]4s2 |
Ferro |
Fe |
8°gruppoB e 4° periodo |
Metallo |
26 |
56 |
[Ar]4s2 3d6 |
Rame |
Cu |
1°gruppoB e 4° periodo |
Metallo |
29 |
63,5 |
[Ar]4s1 3d10 |
Zinco |
Zn |
2°gruppoB e 4° periodo |
Metallo |
30 |
65 |
[Ar]4s2 3d10 |
Mercurio |
Hg |
2°gruppoB e 6° periodo |
Metallo |
80 |
200,5 |
[Xe]6s2 4f14 5d10 |
Boro |
B |
3°gruppoA e 3° periodo |
Non metallo |
5 |
11 |
[He]2s2 2p1 |
Alluminio |
Al |
3°gruppoA e 2° periodo |
Metallo |
13 |
27 |
[Ne]3s2 3p1 |
Carbonio |
C |
4°gruppoA e 2° periodo |
Non metallo |
6 |
12 |
[He]2s2 2p2 |
Silicio |
Si |
4°gruppoA e 3° periodo |
Non metallo |
14 |
28 |
[Ne]3s2 3p2 |
Stagno |
Sn |
4°gruppoA e 5° periodo |
Metallo |
50 |
119 |
[Kr]5s2 4d10 5p2 |
Piombo |
Pb |
4°gruppoA e 6° periodo |
Metallo |
82 |
207 |
[Xe]6s2 4f14 5d10 6p2 |
Azoto |
N |
5°gruppoA e 2° periodo |
Non metallo |
7 |
14 |
[He]2s2 2p3 |
Fosforo |
P |
5°gruppoA e 3° periodo |
Non metallo |
15 |
31 |
[Ne]3s2 3p3 |
Ossigeno |
O |
6°gruppoA e 2° periodo |
Non metallo |
8 |
16 |
[He]2s2 2p4 |
Zolfo |
S |
6°gruppoA e 3° periodo |
Non metallo |
16 |
32 |
[Ne]3s2 3p4 |
Fluoro |
F |
7°gruppoA e 2° periodo |
Non metallo |
9 |
19 |
[He]2s2 2p5 |
Cloro |
Cl |
7°gruppoA e 3° periodo |
Non metallo |
17 |
35 |
[Ne]3s2 3p5 |
Bromo |
Br |
7°gruppoA e 4° periodo |
Non metallo |
35 |
80 |
[Ar]4s2 3d10 4p5 |
Iodio |
I |
7°gruppoA e 5° periodo |
Non metallo |
53 |
130 |
[Kr]5s2 4d10 5p5 |
Soluzione
In chimica, miscela omogenea di due o più sostanze; la sostanza presente in quantità maggiore, che può essere solida, liquida o gassosa, è detta solvente, mentre quella presente in quantità minore, in genere solida o liquida, è detta soluto. Raramente miscele di gas, come l'atmosfera, sono dette soluzioni. Le soluzioni appaiono omogenee e il soluto non può essere separato tramite filtrazione, a differenza di quanto avviene nei colloidi o nelle sospensioni, in cui le particelle di soluto sono di dimensioni molecolari e finemente disperse tra le molecole del solvente. Si dice soluzione solida una miscela di metalli che ha subito un processo di solidificazione mantenendo le proporzioni fra i costituenti.
Solubilità
Alcuni liquidi, ad esempio acqua e alcol, si sciolgono fra loro in qualsiasi proporzione; al contrario se si scioglie zucchero in acqua, non si potrà superare un limite fissato, che dipende dalle condizioni di pressione e temperatura, e la soluzione può quindi divenire satura. La solubilità di un composto in un solvente è definita, per valori fissati di pressione e temperatura, come la quantità massima di quel composto che può sciogliersi in soluzione e, tranne poche eccezioni come gas o sali organici di calcio, cresce all'aumentare della temperatura del solvente. In generale, le soluzioni di molecole strutturalmente simili a quelle del solvente hanno solubilità elevate.
Proprietà fisiche delle soluzioni
Quando si aggiunge del soluto a un solvente, molte delle proprietà di quest'ultimo variano; in particolare all'aumentare della concentrazione di soluto, si alza il punto di ebollizione e si abbassa il punto di solidificazione (o congelamento). Per questo motivo, si può inibire il congelamento dell'acqua contenuta nel radiatore di un'automobile aggiungendovi una sostanza antigelo, ad esempio 1,2-etandiolo (HOCH2CH2OH), sotto forma di soluto. Inoltre, la pressione di vapore del solvente si abbassa all'aumentare della concentrazione di soluto.
Un'altra importante proprietà delle soluzioni è la capacità di esercitare pressione osmotica. Se due solventi vengono separati da una membrana semipermeabile (una membrana che permette il passaggio delle molecole di solvente ma non di quelle di soluto), le molecole del solvente si sposteranno dalla soluzione a concentrazione più bassa a quella a concentrazione più alta, con l'effetto di diluire quest'ultima.
Liquidi
Sostanze che si trovano nello stato liquido della materia
I legami tra le molecole di un liquido hanno intensità intermedia tra quelli che caratterizzano lo stato solido e lo stato gassoso. L’analisi dei liquidi mediante raggi X ha mostrato l’esistenza di un certo grado di regolarità nella disposizione delle molecole entro alcuni diametri molecolari. In alcune sostanze, inoltre, le particelle hanno un orientamento preferenziale, che determina un’anisotropia rispetto ad alcune proprietà (che variano a seconda della direzione). In opportune condizioni di temperatura e di pressione, quasi tutte le sostanze possono esistere allo stato liquido, anche se alcuni solidi sublimano, cioè passano direttamente dallo stato solido a quello gassoso. La densità di un liquido è solitamente minore del valore che caratterizza la medesima sostanza allo stato solido; fanno eccezione alcune sostanze, come ad esempio l’acqua.
I liquidi sono caratterizzati da un attrito interno, che si oppone allo scorrimento tra stati adiacenti, detto viscosità. Questa grandezza normalmente diminuisce all’aumentare della temperatura e aumenta al crescere della pressione; inoltre è in relazione con la complessità delle molecole che costituiscono il fluido: in particolare è bassa nei gas inerti liquefatti e alta negli oli pesanti. La pressione del vapore in equilibrio con il liquido, chiamata tensione di vapor saturo, dipende solo dalla temperatura ed è una proprietà caratteristica di ogni liquido. Anche il punto di ebollizione, di solidificazione e il calore di evaporazione (cioè la quantità di calore richiesta per far evaporare una massa unitaria) variano da sostanza a sostanza. In alcuni casi i liquidi possono essere riscaldati a temperature maggiori del punto di ebollizione (fluido surriscaldato) o raffreddati oltre il punto di solidificazione.
Evaporazione
Processo che si verifica quando una sostanza passa gradualmente dallo stato liquido allo stato gassoso, senza ebollizione. Le molecole di un liquido si muovono in modo disordinato e casuale (moto di agitazione termica) con una velocità media che dipende dalla temperatura. Per valori della temperatura minori del punto di ebollizione, le molecole che si trovano presso la superficie libera con velocità superiore alla media possono avere energia sufficiente per vincere le forze attrattive esercitate dalle particelle interne del liquido e passare nell’aria sovrastante sotto forma di gas. Naturalmente, soltanto le molecole più veloci possono sfuggire, pertanto la velocità media del moto di agitazione termica diminuisce e con essa l’energia media delle molecole e quindi la temperatura del liquido. Come conseguenza di ciò l’evaporazione produce raffreddamento.
Se un liquido evapora in un recipiente chiuso, lo spazio sopra la superficie libera si riempie rapidamente di vapore, e l’evaporazione è presto bilanciata dal fenomeno opposto: la condensazione. Per completare il processo, quindi, è necessario rimuovere il vapore man mano che si forma. Per questa ragione un liquido evapora più velocemente quando la sua superficie è ventilata o quando il vapore viene asportato mediante una pompa.
Punto di ebollizione
Temperatura alla quale la pressione di vapore di un liquido eguaglia la pressione atmosferica al di sopra del liquido stesso. Per temperature inferiori al punto di ebollizione (p.e.), si ha evaporazione solo dalla superficie del liquido; durante l'ebollizione, il vapore si forma anche all'interno del liquido, e man mano che le bolle di vapore salgono verso la superficie causano la turbolenza e il gorgoglìo associati all'ebollizione. L'evaporazione continua, finché si fornisce calore al liquido, senza aumento di temperatura: l'ebollizione infatti avviene a temperatura costante qualunque sia la quantità di calore fornita.
Il punto di ebollizione aumenta al crescere della pressione del liquido; alla pressione di una atmosfera (101.325 pascal), l'acqua bolle a 100 °C, mentre a 217 atmosfere, il processo avviene alla temperatura di 374 °C. Al di sopra di questo valore, detto temperatura critica, l'acqua diventa vapore saturo.
Al contrario, ad altitudini elevate, quando diminuisce la pressione dell'aria, l'acqua bolle a temperature inferiori a 100 °C; ad esempio, a una quota di 1800 m sopra il livello del mare, il p.e. è di circa 94 °C. Per valori della pressione inferiori a 600 pascal, il punto di ebollizione è circa 0 °C.
I punti di ebollizione delle diverse sostanze variano moltissimo: il valore più basso è quello dell'elio, -268,9 °C, mentre il più alto conosciuto è quello del tungsteno, circa 5900 °C. I punti di ebollizione indicati nei vari articoli sono misurati a pressione atmosferica.
Condensazione
Transizione di una sostanza dallo stato di vapore allo stato liquido. La condensazione si realizza per compressione o per raffreddamento ed è favorita se le pareti del recipiente vengono portate a una temperatura inferiore rispetto al vapore in esso contenuto; in questo caso infatti la sostanza cede con facilità il calore latente di evaporazione precedentemente assorbito. Il processo comporta la riduzione del volume occupato dal vapore, della velocità delle molecole che lo costituiscono e della loro mutua distanza.
La distillazione, la formazione di nuvole, la precipitazione di pioggia, la formazione di rugiada e di neve, sono fenomeni di condensazione.
In chimica, si dice reazione di condensazione il processo secondo cui gli atomi di una o più molecole semplici si combinano per formare un nuovo composto più complesso, di peso molecolare maggiore di ciascuno dei reagenti.
Solidi
Ramo della fisica che ha per oggetto lo studio delle proprietà delle sostanze liquide e solide, inclusi i cristalli e i materiali amorfi, quali ad esempio vetri e ceramiche; si occupa anche delle caratteristiche di alcuni composti chimici, di particolari sostanze organiche e di vari polimeri. Nata come disciplina nel XX secolo, la fisica dello stato solido si avvalse degli esperimenti di diffrazione di raggi X per studiare la struttura dei cristalli, giungendo a risultati fondamentali e rivoluzionari, quali la scoperta dei semiconduttori e lo sviluppo della teoria microscopica della superconduttività. Queste ricerche produssero importanti dispositivi come transistor, fibre ottiche e laser a semiconduttore. La fisica dello stato solido è attualmente in rapido sviluppo e una caratteristica della tecnologia del XXI secolo sarà probabilmente l’introduzione di nuovi materiali con proprietà inusitate, scoperte mediante le ricerche nell’ambito di questo campo di studi.
Una delle più importanti conquiste di questa disciplina è la teoria delle “bande” di energia dei solidi. Un elettrone legato al nucleo di un atomo isolato può occupare solo un insieme discreto di livelli di energia; invece, in un solido cristallino, costituito da moltissimi atomi identici disposti in una struttura reticolare estremamente regolare, i livelli energetici sono organizzati in bande “permesse” di energia separate da bande “priobite”. Poiché la struttura delle bande è una proprietà del cristallo nel suo insieme, ogni atomo può contribuire con un elettrone esterno (o di valenza) a riempire le bande permesse. In accordo col principio di esclusione enunciato da Wolfgang Pauli, gli elettroni occupano ciascuno dei livelli di energia a coppie, in relazione ai due possibili valori dello spin (spin in su, o positivo, e spin in giù, o negativo). In prossimità dello zero assoluto, tutti i livelli di energia più bassi del cristallo sono completamente occupati, mentre per valori maggiori della temperatura gli elettroni acquistano energia e possono riempire i livelli più alti. Il cosiddetto “livello di Fermi” rappresenta la linea di demarcazione al di sopra e al di sotto della quale i livelli sono con buona approssimazione rispettivamente vuoti e pieni; questo livello permette di definire le proprietà conduttrici o isolanti dei vari materiali.
Se il livello di Fermi si trova in mezzo a una banda permessa, il solido è un conduttore; in questo caso, infatti, anche piccole energie possono determinare transizioni elettroniche tra i livelli energetici e questa mobilità di particelle cariche è responsabile delle proprietà che caratterizzano i materiali conduttori: la capacità di condurre elettricità e calore e di assorbire la radiazione luminosa. Esempi tipici di sostanze conduttrici si trovano, in generale, tra i metalli. Se il livello di Fermi si trova in cima a una banda permessa e vi è un salto di energia (gap) relativamente grande tra questa e la successiva banda permessa, il solido è un isolante, come il diamante o il quarzo. In questo caso, solo grandi energie possono eccitare gli elettroni, provocando il salto della banda proibita; di conseguenza i materiali isolanti sono cattivi conduttori di calore e di elettricità, non assorbono la luce e sono spesso trasparenti. Infine, se il livello di Fermi è vicino alla sommità di una banda permessa ma questa confina con una banda proibita piuttosto stretta, il solido è un semiconduttore, come il silicio.
Un campo attivo di ricerca della fisica dello stato solido è lo studio dei superconduttori, cioè di quei materiali che, a temperature estremamente basse, alcuni gradi sopra lo zero assoluto, manifestano improvvise variazioni delle proprietà elettriche e magnetiche, associate alla scomparsa della resistenza elettrica. In assenza di resistenza, una corrente lanciata in un anello superconduttore circola indefinitamente, senza richiedere alimentazione e senza dissipazione di energia. In pratica sono stati realizzati anelli superconduttori capaci di sostenere correnti elettriche per mesi, senza un’apprezzabile diminuzione di intensità.
Per la maggior parte del XX secolo i fenomeni di superconduzione furono osservati solo alla temperatura dell’elio liquido (-268,9 °C). Il raggiungimento e il mantenimento di simili temperature ha costi rilevanti, tali da rendere svantaggioso dal punto di vista economico l’impiego di materiali superconduttori; tuttavia, negli anni Ottanta la scoperta di una classe di materiali ceramici che manifestano transizioni allo stato superconduttivo a temperature notevolmente maggiori di quella di liquefazione dell’aria (circa -200 °C) ha aperto nuove possibilità di applicazione della superconduttività, forse per dispositivi elettronici ad alta velocità o per più efficienti linee di trasporto dell’energia elettrica.
Punto di solidificazione
Temperatura alla quale una sostanza passa dallo stato liquido a quello solido, a una determinata pressione. Il punto di solidificazione di un liquido puro (non mescolato) coincide con il punto di fusione della stessa sostanza allo stato solido e può essere interpretato come la temperatura alla quale gli stati liquido e solido sono in equilibrio. Se si fornisce calore a una miscela solido-liquido di una stessa sostanza che si trova al punto di solidificazione, la temperatura rimane costante finché la miscela non è completamente liquefatta, e tutto il calore viene assorbito come calore latente di fusione. Allo stesso modo, se si sottrae calore a una miscela solido-liquido al suo punto di congelamento, la sostanza si manterrà alla stessa temperatura finché non sarà completo il processo di solidificazione; in questo caso il trasferimento di calore avviene in corrispondenza alla transizione tra lo stato liquido e quello solido.
Tutti i solidi fondono se vengono scaldati fino al punto di fusione, al contrario può accadere che sostanze liquide rimangano tali anche se raffreddate oltre il punto di solidificazione; in altre parole un liquido può essere "sovraraffreddato" per un determinato intervallo di tempo. La spiegazione di questo fenomeno risiede nella teoria molecolare, secondo cui le molecole di un solido si trovano in una situazione di ordine, vincolate a occupare posizioni fisse, mentre uno stato disordinato in cui esse sono libere di muoversi è caratteristico dello stato liquido. Perché un liquido solidifichi è necessaria la presenza di un nucleo, ossia un punto di ordine molecolare, attorno al quale le molecole possano cristallizzare, assumendo posizioni determinate all'interno del reticolo cristallino in formazione.
Il punto di solidificazione di una soluzione, sempre più basso di quello del solvente puro, dipende dalla concentrazione molecolare del soluto ma anche dal fatto che questo sia o meno un elettrolita: infatti le soluzioni non elettrolitiche hanno punti di solidificazione più alti di quelle degli elettroliti, a parità di concentrazione.
Analogamente, nelle miscele e nelle leghe il processo di solidificazione può avvenire a temperatura inferiore rispetto a quanto sarebbe per i singoli componenti.
Il punto di solidificazione per la maggior parte dei liquidi aumenta all'aumentare della pressione. Un'eccezione a questo comportamento si ha per le sostanze che si espandono in seguito a un processo di congelamento, come ad esempio l'acqua. Ponendo un peso su un blocco di ghiaccio, la parte appena sotto al peso comincerà a liquefarsi ma ritornerà solida, senza variazioni di temperatura, non appena la pressione verrà rimossa.
Cristallo.
Solido caratterizzato da una disposizione periodica e ordinata di atomi ai vertici di una struttura reticolare che prende il nome di reticolo cristallino. La presenza di una tale organizzazione atomica conferisce al cristallo una forma geometrica definita, dotata di particolari relazioni di simmetria e delimitata da superfici piane e lisce. I cristalli si formano per solidificazione graduale di un liquido o per sublimazione di un gas. Gli angoli tra facce corrispondenti di due cristalli della stessa sostanza, indipendentemente dalla dimensione e dalle differenze superficiali di forma, sono sempre identici.
La materia allo stato solido presenta nella maggior parte dei casi una struttura cristallina; fanno eccezione materiali detti amorfi, come ad esempio il vetro, che dal punto di vista strutturale sono più simili ai liquidi che non ai solidi.
Le condizioni per la formazione
La formazione e le caratteristiche di una struttura cristallina dipendono dalla rapidità e dalle condizioni del processo di solidificazione. Gli stessi liquidi che quando solidificano gradualmente in profondità nella crosta terrestre formano il granito, qualche volta vengono eruttati in superficie come lava vulcanica e si raffreddano rapidamente, formando una roccia vetrosa chiamata ossidiana. Se il raffreddamento è un poco più lento si forma una roccia criptocristallina o afanitica, con cristalli troppo piccoli per potere essere distinti a occhio nudo. Quando il raffreddamento avviene con lentezza ancora maggiore, si forma una roccia di struttura porfirica, nella quale solo alcuni cristalli sono grandi abbastanza da essere visibili. Se la composizione è la stessa del granito, questa forma porfirica prende il nome di riolite.
Ogni minerale che costituisce una roccia è presente in forma di cristalli piccoli ma omogenei. Le sostanze che solidificano per prime durante il raffreddamento della roccia fusa presentano uno sviluppo normale delle proprie forme cristalline; diversamente quelle che cristallizzano per ultime, costrette a occupare gli interstizi rimanenti, presentano un aspetto esterno deformato. Durante il processo di cristallizzazione, si formano cristalli omogenei che si separano dalle miscele liquide. Questa caratteristica viene sfruttata anche per purificare sostanze cristalline: ad esempio le sostanze chimiche organiche vengono quasi invariabilmente purificate per ricristallizzazione.
In alcuni gruppi minerali gli ioni di un elemento possono essere sostituiti da ioni di un altro elemento, lasciando invariata la struttura cristallina e formando una serie di soluzioni solide. Quando vi è una completa e continua gradazione di composizione chimica da un membro estremo all'altro, la serie viene detta isomorfa. Un esempio è fornito dalla varietà di feldspato detta plagioclasio, che forma una serie completa di composizione, compresa tra quella del puro alluminosilicato di sodio (albite) e quella del puro alluminosilicato di calcio (anortite). Altri gruppi di minerali che formano serie isomorfe sono quelli dell'apatite, della barite, della calcite e dello spinello.
Può capitare che il processo di cristallizzazione non avvenga e la soluzione di partenza divenga soprassatura (in modo analogo una sostanza può esistere allo stato liquido a temperature inferiori del suo punto di solidificazione). La tendenza a cristallizzare diminuisce all'aumentare della viscosità del fluido; in particolare se una soluzione diviene notevolmente soprassatura e superraffreddata, la viscosità può raggiungere un livello tale da rendere quasi impossibile la cristallizzazione; un'ulteriore evaporazione del solvente o un ulteriore raffreddamento producono dapprima una sorta di sciroppo e infine un vetro. Alcune sostanze mostrano una forte tendenza a formare nuclei di cristallizzazione, cosicché, se una soluzione contenente tali sostanze viene raffreddata lentamente, avviene la crescita di pochi grandi cristalli, al contrario se il raffreddamento è rapido si formano numerosi cristalli di dimensioni minuscole.
Cristallografia
Lo studio dell'accrescimento, della forma e delle caratteristiche geometriche dei cristalli è detto cristallografia.
Quando le condizioni lo permettono, ogni elemento o composto chimico cristallizza in una forma definita e caratteristica che corrisponde a una determinata disposizione degli atomi nel reticolo. Così ad esempio il sale da cucina (vedi Cloruro di sodio) forma cristalli cubici (ovvero gli atomi sono ordinatamente disposti ai vertici di un cubo) mentre il granato più comunemente si presenta in dodecaedri (solidi con 12 facce) o trisottaedri (con 24 facce).
Teoricamente sono possibili 32 classi di cristalli raggruppate in sei sistemi cristallini, definiti in base alla lunghezza e all'orientamento degli assi di simmetria, linee ideali che definiscono le proprietà di simmetria del cristallo. Quasi tutti i minerali comuni sono compresi in una dozzina di classi appartenenti a sistemi diversi. Le proprietà chimiche e fisiche dipendono dalla particolare disposizione atomica, cosicché cristalli appartenenti a un determinato sistema cristallino hanno caratteristiche comuni.
Cubico
Questo sistema comprende cristalli con tre assi mutuamente perpendicolari e di uguale lunghezza.
Tetragonale
Questo sistema comprende cristalli con tre assi mutuamente perpendicolari, due dei quali con uguale lunghezza.
Ortorombico
Questo sistema comprende cristalli con tre assi mutuamente perpendicolari, ognuno di lunghezza diversa.
Monoclino
Questo sistema comprende cristalli con tre assi di lunghezza diseguale, due dei quali (non perpendicolari) giacciono su un piano ortogonale al terzo.
Triclino
Questo sistema comprende cristalli con tre assi diseguali e non mutuamente perpendicolari.
Esagonale
Questo sistema comprende cristalli con quattro assi, tre dei quali giacciono su uno stesso piano, simmetricamente spaziati e di uguale lunghezza; il quarto asse è perpendicolare agli altri tre. Alcuni cristallografi dividono il sistema esagonale in due, denominando il settimo sistema trigonale o romboedrico.
Pochi elementi e composti possono cristallizzare in più sistemi cristallografici, dando luogo a sostanze che, seppure identiche in quanto a composizione chimica, posseggono proprietà fisiche diverse. Un esempio è fornito dal carbonio che cristallizza nel sistema trigonale come grafite e nel sistema cubico come diamante; questa forma, pur appartenendo allo stesso sistema del cloruro di sodio e del granato, è in una classe differente: cristallizza infatti in tetraedri (solidi a quattro facce) o ottaedri (solidi a otto facce).
Altre proprietà dei cristalli
La forma di un minerale dipende dalle caratteristiche della sua struttura cristallina. Ad esempio l'argentite, un minerale dell'argento, cristallizza nella stessa classe del granato e del sale, ma si trova solitamente in irregolari masse criptocristalline. La fluorite, minerale relativamente comune, cristallizza nella stessa classe del granato formando cristalli cubici; tuttavia quando viene fratturata, essa tende a sfaldarsi in frammenti ottaedrici perfetti. Il sale forma frammenti cubici dalla sfaldatura perfetta, mentre il granato non presenta piani di sfaldatura ben definiti. Alcune sostanze inoltre tendono a formare cristalli multipli.
Alcuni cristalli manifestano proprietà elettriche come la piezoelettricità o la piroelettricità (ossia acquistano carica elettrica se vengono compressi o riscaldati), e per questo motivo sono sfruttati industrialmente. Un esempio è fornito dal quarzo che trova un vasto impiego in elettrotecnica ed elettronica. Nei transistor, le speciali proprietà dei cristalli di germanio e di silicio li rendono utilizzabili per amplificare correnti elettriche. Un altro dispositivo elettronico, la batteria solare, prevede l'uso di cristalli di silicio o di solfuro di cadmio per convertire la luce solare in energia elettrica.
In anni recenti sono stati messi a punto diversi metodi per preparare cristalli singoli di sostanze normalmente criptocristalline. Ad esempio è possibile ottenere grandi cristalli singoli di metalli mediante un semplice metodo che consiste nel fondere il metallo in un contenitore conico, che viene poi allontanato molto lentamente dal forno a cominciare dal vertice. In condizioni propizie, alla punta del cono si forma un singolo nucleo di cristallizzazione, che continua ad accrescersi fino a riempire l'intero contenitore. Tali cristalli singoli spesso sono notevolmente diversi dai metalli nella loro forma solita. Cristalli puri e particolari vengono attualmente prodotti con tecniche avanzate, come l'epitassia a fascio molecolare, per essere usati come semiconduttori e nei circuiti integrati.
Quando i raggi X incidono sulla superficie di un un cristallo, gli atomi disposti simmetricamente agiscono come reticolo di diffrazione e deflettono i raggi secondo schemi regolari dai quali è possibile risalire alla natura e alle caratteristiche strutturali del cristallo; la disposizione degli atomi può essere visualizzata direttamente per mezzo di dispositivi elettronici.
Una regola di base della cristallografia, considerata valida per lungo tempo, stabiliva che la simmetria pentagonale fosse incompatibile con la periodicità traslazionale propria dei cristalli. La scoperta, nel 1984, di una lega di alluminio e magnesio che sembra contravvenire a questa regola potrebbe indicare la possibilità dell'esistenza di una nuova fase di materia solida, diversa dai cristalli e dai vetri.
Reazioni Chimiche
Processo in cui si verifica una trasposizione di atomi o di gruppi di atomi, in seguito alla quale si ottengono sostanze con composizioni molecolari diverse da quelle di partenza. La qualità e la quantità di prodotti che è possibile ottenere partendo da determinati reagenti sono legate al tipo di reazione e alle condizioni in cui essa viene condotta. In ogni caso, in ogni trasformazione rimangono invariate alcune grandezze, come la massa, la carica e il numero di atomi presenti.
Equazioni Chimiche
I simboli chimici e le formule usate per descrivere una reazione mettono in evidenza i cambiamenti che si verificano nel passaggio da reagenti a prodotti. L'equazione chimica di combustione del gas metano, CH4, in presenza di ossigeno, O2, con formazione di anidride carbonica, CO2, e acqua, H2O, può essere così rappresentata:

Poiché nelle reazioni chimiche la massa atomica totale resta invariata, lo stesso numero di atomi deve apparire da entrambe le parti dell'equazione. Pertanto, la reazione può essere espressa come:

Per semplificare la notazione, nelle equazioni chimiche bilanciate gli uni sono sottintesi, mentre sono sempre indicate le cariche elettriche e il numero di atomi
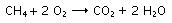
Le reazioni chimiche sono bilanciate non solo rispetto alla conservazione della carica e del numero di atomi dello stesso tipo, ma anche della massa di ciascun elemento, indicata nella tavola periodica.
Così, 16,05 unità di massa atomica (uma) di CH4 reagiscono con 64,00 uma di O2 a dare 44,01 uma di CO2 e 36,04 uma di H2O:
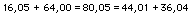
In altre parole, una mole di metano reagisce con due moli di ossigeno, producendo una mole di diossido di carbonio (o anidride carbonica) e due moli di acqua. Nella reazione è quindi rispettata la conservazione della carica, del numero di atomi e della massa (la somma delle masse dei reagenti è infatti uguale a quella dei prodotti).
Tipi di reazioni chimiche
Per comprendere i meccanismi delle reazioni chimiche è fondamentale lo studio del legame ionico e covalente.
Esempi di reazioni che coinvolgono ioni sono:
Ag+ + Cl- Â AgCl
oppure
3 Ca2+ + 2 PO43- Â Ca3(PO4)2
in cui la doppia freccia indica la reversibilità del processo.
Nelle reazioni che coinvolgono la formazione di un singolo legame covalente, ad esempio nelle reazioni acido-base come
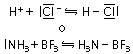
la coppia elettronica può provenire da uno solo dei due reagenti. Il doppietto elettronico della base riempie l'orbitale vuoto dell'acido, formando un legame covalente (vedi Acidi e basi).
Nelle reazioni di ossidoriduzione i reagenti acquistano o perdono elettroni:
2 Fe2+ + Br2 Â 2 Fe3+ + 2 Br-
In queste reazioni uno dei reagenti viene ridotto, ossia acquista elettroni e diminuisce il proprio numero di ossidazione, mentre l'altro viene ossidato, ossia cede elettroni, aumentando il proprio numero d'ossidazione. Molte reazioni di ossidoriduzione, come l'ossidazione dei metalli, la combustione e i processi metabolici associati alla respirazione, coinvolgono l'ossigeno atmosferico. Altre, invece, non richiedono la presenza dell'ossigeno; un esempio è la reazione
Pb + PbO2 + 4H+ + 2SO42- ± 2PbSO4 + 2H2O
che si verifica all'interno degli accumulatori delle autovetture, producendo corrente elettrica.
L'unione di due gruppi di atomi per formare una nuova molecola è detta reazione di addizione, mentre la scissione di una molecola in più frammenti prende il nome di decomposizione. La polimerizzazione è una reazione di addizione in cui più molecole si uniscono a formare lunghe catene o reticoli (vedi Polimeri).
L’energia dei processi chimici
Nelle reazioni chimiche vale il principio di conservazione dell'energia. Formalmente, affinché una reazione possa avvenire, è necessario rompere alcuni legami presenti nelle molecole dei reagenti e quindi formarne altri, in modo da ottenere le molecole dei prodotti. Per rompere un legame bisogna fornire una certa quantità di energia, che viene liberata quando il legame si riforma. I legami ad alta energia sono detti "forti" proprio perché per romperli è necessaria una notevole quantità di energia.
Se nei prodotti si formano legami più forti di quelli rotti nei reagenti, si verifica un'emissione di energia sotto forma di calore e la reazione viene detta esotermica. Se, invece, si formano legami più deboli bisogna fornire energia e la reazione è detta endotermica. Poiché i legami forti hanno una maggiore tendenza a formarsi di quelli deboli, le reazioni esotermiche spontanee sono più comuni di quelle endotermiche.
Esistono, tuttavia, anche reazioni endotermiche spontanee, come la dissoluzione dei sali in acqua. La spontaneità di una reazione non dipende, infatti, dalla sua natura endotermica o esotermica, né dalla variazione di entropia che l'accompagna, ma dalla sola variazione di energia libera del sistema: quindi, le reazioni sono spontanee se si verifica una diminuzione di energia libera. Vedi anche Chimica fisica; Termodinamica.
Velocità e meccanismi di reazione
Alcune reazioni, come le esplosioni, avvengono molto rapidamente, mentre altre, come la formazione della ruggine, richiedono molto tempo. Secondo la cinetica chimica, che studia le velocità di reazione, perché una reazione avvenga si devono verificare tre condizioni: i reagenti devono collidere; devono avere orientamento ed energia adeguati a formare uno stato di transizione; e devono essere in grado di convertire tale stato in prodotto. La reazione è veloce solo se le tre condizioni si verificano facilmente.
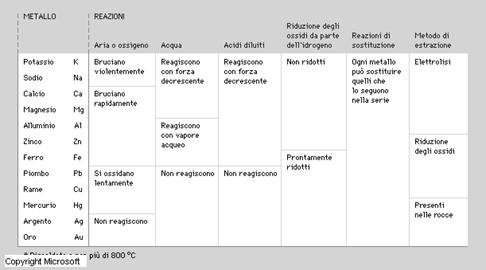
La velocità di reazione può essere modificata non solo da un catalizzatore, ma anche da variazioni di temperatura e concentrazione. Alzando la temperatura l'energia cinetica delle molecole dei reagenti aumenta, facendo aumentare il numero e l'energia delle collisioni e, di conseguenza, la probabilità di raggiungere lo stato di transizione. Anche l'aumento di concentrazione, rendendo più frequenti le collisioni tra molecole, accelera le reazioni.
I passaggi attraverso i quali si verifica una reazione sono definiti dal "meccanismo di reazione".
Equilibrio chimico
Al procedere di una reazione, la concentrazione dei reagenti e, di conseguenza, la velocità di reazione diminuiscono; contemporaneamente, aumenta la concentrazione dei prodotti e diventa sempre più probabile la loro collisione, che porta a riformare i reagenti. Quando la velocità di reazione inversa eguaglia quella della reazione diretta si arriva allo stato di equilibrio chimico.
La perturbazione di un sistema all'equilibrio è regolata dal principio di Le Châtelier (dal nome del chimico Henri-Louis Le Châtelier), secondo il quale, se si provoca una modificazione in un sistema in equilibrio, quest'ultimo evolve in modo da neutralizzare il più possibile la modificazione. Quindi, in una reazione in cui si formano prodotti gassosi, un aumento della pressione esterna favorisce l'andamento in senso opposto; oppure, l'aumento di concentrazione di un reagente sposta la reazione verso destra, in modo da consumare la sostanza aggiunta, mentre la diminuzione di concentrazione fa spostare l'andamento della reazione in senso opposto.
Acidi e basi
Classi di composti chimici che presentano proprietà opposte. Gli acidi hanno sapore aspro, conferiscono colorazione rossa alla tintura di tornasole e spesso reagiscono con i metalli liberando idrogeno gassoso; le basi hanno sapore amaro, conferiscono al tornasole colorazione blu e sono viscide al tatto. Mescolando soluzioni acquose di un acido e di una base, si sviluppa una reazione detta di neutralizzazione, che ha la caratteristica di procedere rapidamente e di produrre un sale. L'acido solforico e l'idrossido di sodio NaOH, ad esempio, producono acqua e solfato di sodio secondo la reazione:
H2SO4+ 2NaOHÁ2H2O + Na2SO4
Prime teorie
Il primo passo verso la comprensione delle proprietà di acidi e basi fu compiuto intorno al 1834 dal fisico inglese Michael Faraday, con la scoperta della loro proprietà di essere elettroliti, sostanze che, sciolte in acqua, generano una soluzione contenente particelle cariche (vedi Ioni), permettendo la conduzione di corrente elettrica. Nel 1887 il chimico svedese Svante Arrhenius (e in seguito il chimico tedesco Wilhelm Ostwald) propose un criterio di classificazione per acidi e basi: in base a tale metodo si definisce acido un composto che, in soluzione acquosa, determina una concentrazione di ioni idrogeno (protoni) maggiore di quella che si riscontra in acqua pura, e basico un composto che, nelle medesime condizioni, determina un aumento di concentrazione di ioni idrossido OH-.
La teoria di Arrhenius, per quanto di grande semplicità e chiarezza, limitava però la definizione a specie contenenti rispettivamente idrogeno e ossidrili, e poteva essere applicata solo a soluzioni acquose.
Teoria di Brønsted-Lowry
Nel 1923 il chimico danese Johannes Brønsted e, indipendentemente, il chimico britannico Thomas Lowry proposero una nuova teoria che estendeva la classificazione di Arrhenius a soluzioni non acquose; essi definirono acide le sostanze con tendenza a donare protoni (ioni idrogeno H+) e basiche quelle con tendenza ad acquistarli.
Secondo la definizione di Brønsted-Lowry, un acido si trasforma nella corrispondente base cedendo un protone; analogamente una base che acquista un protone si trasforma nell'acido coniugato. Si definisce "forte" un acido che dona velocemente tutti i protoni a una base, cosicché un acido è tanto più forte quanto più è debole la sua base coniugata. Alla luce di quanto detto, si consideri la reazione di equilibrio fra un generico acido (1) e una generica base (2):
Acido (1) + Base (2)ÁAcido (2) + Base (1)
La reazione effettiva procede prevalentemente nella direzione che porta alla formazione dell'acido e della base più deboli; ad esempio la reazione di HCl in ambiente acquoso
HCl + H2OÁH3O+ + Cl-
procede prevalentemente da sinistra a destra (equilibrio spostato verso destra), perché, mentre l'acido cloridrico è forte, gli ioni Cl- e H3O+ (acido coniugato di H2O) costituiscono rispettivamente una base e un acido deboli.
Al contrario nella reazione
HF + H2OÁH3O+ + F-
l'equilibrio è spostato verso sinistra perché H2O è una base più debole rispetto a F-, e HF è un acido più debole (in acqua) di H3O+. La teoria Brønsted-Lowry fornisce una spiegazione del comportamento anfotero dell'acqua: essa è una base in presenza di un acido più forte (ad esempio HCl) che ha quindi maggior tendenza a dissociarsi, e un acido nella reazione con una base più forte (ad esempio l'ammoniaca). Così si ha
HCl + H2OÁH3O+ + Cl-
e
NH3+ H2OÁNH4+ + OH-
Misura della forza di un acido e di una base
La forza di un acido o di una base può essere valutata attraverso la misura della concentrazione degli ioni H3O+ e OH-, che saranno stati prodotti in soluzioni acquose rispettivamente acide o basiche per cessione o sottrazione di protoni. Sulla base di questo criterio, sono state messe a punto due scale, note come pH e pOH, i cui valori corrispondono rispettivamente al logaritmo, cambiato di segno, della concentrazione dello ione ossonio e dello ione idrossido in soluzione acquosa:
pH = -log [H3O+]
pOH = -log [OH-]
All'acqua pura corrisponde pH uguale a 7,0; l'aggiunta di un acido produce un aumento della concentrazione dello ione ossonio [H3O+] e una conseguente riduzione del valore del pH che fornisce una misura della forza dell'acido in analisi.
La formulazione più recente della teoria di acidi e basi, dovuta a Gilbert Newton Lewis, definisce gli acidi come sostanze capaci di "accettare" e le basi come capaci di "donare" una coppia di elettroni per formare un legame covalente. Questo schema interpretativo ha il vantaggio di mantenere validità anche in presenza di solventi diversi dall'acqua, e non implica la formazione di sali o di coppie coniugate acido-base nelle reazioni di neutralizzazione. Secondo l'esposizione di Lewis, l'ammoniaca è classificata come base poiché può donare un doppietto elettronico al trifluoroborano (classificato perciò come acido) per formare un addotto acido-base:
H3N: + BF3ÁH3N-BF3
pH
Grandezza che esprime la concentrazione di ioni idrogeno di una soluzione. Il termine, che deriva dal francese pouvoir hydrogène, "potere d'idrogeno", viene definito come il logaritmo della concentrazione di ioni (protoni) H+ cambiato di segno: cioè pH = -log10[H+], dove [H+] è la concentrazione di ioni H+ espressa in moli per litro. Siccome gli ioni H+ si legano alle molecole d'acqua per formare ioni idronio (H3O+), il pH è anche espresso in funzione della concentrazione di questi ioni.
Nell'acqua pura a 22 °C, gli ioni H3O+ e ossidrile (OH-) esistono in uguali quantità; la concentrazione di ogni specie è 10-7 moli/litro, cosicché il pH dell'acqua pura è -log (10-7), ossia il log 107, cioè 7. Se si aggiunge un acido all'acqua, tuttavia, si forma un eccesso di ioni H3O+, la cui concentrazione può variare fra 10-6 e 10-1 moli/litro, a seconda della forza e della quantità di acido. Per questo motivo, le soluzioni acide hanno pH variabile fra 6 (per un acido debole) e 1 (per un acido forte). Al contrario, una soluzione basica ha bassa concentrazione di ioni H3O+ e un eccesso di ioni OH-, di conseguenza il pH varia fra 8 (per basi deboli) e 14 (per basi forti).
Il pH di una soluzione può essere misurato tramite titolazione, che consiste nella neutralizzazione di un acido (o di una base) con una quantità misurata di base (o di acido) a concentrazione nota, in presenza di un indicatore (composto il cui colore dipende dal pH). Il pH di una soluzione può anche essere determinato direttamente misurando il potenziale elettrico che insorge su elettrodi particolari immersi in soluzione.
Fonte: http://www.valeriano.altervista.org/testi/chimicadue.doc
Sito web: http://www.valeriano.altervista.org
Autore del testo: non indicato nel documento di origine
Parola chiave google : Chimica tipo file : doc
Visita la nostra pagina principale
Chimica
Termini d' uso e privacy