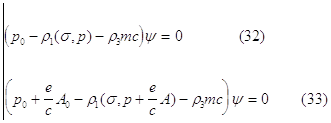Elettrone
Elettrone
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Elettrone
L’ELETTRONE
Abstract
Beginning from its discovery, the electron marked the development of modern physics.
This is a survey of its properties, seen in relation to the development of phisics in our century.
In the first part, the meaning of g factor and the experiments to determine its measure are explained.
In the second part, its role in the development of relativistic and quantum mechanics is pointed out.
Storicamente si comincia a parlare di atomo di elettricità, come particella leggera portatrice di una carica elettrica negativa elementare, negli ultimi decenni del secolo scorso (G.J. Stoney 1874), per potere spiegare l’esistenza degli elementi chimici e le leggi dell’elettrolisi, enunciate fin dal 1833 da M. Faraday. Solo nel 1891 lo stesso Stoney introdusse il termine elettrone.
In quell’epoca esisteva un dibattito animato sulla natura dei raggi catodici; alcuni pensavano che si trattasse di flussi di molecole, altri di perturbazioni dell’etere.
Fu il fisico francese Jean Perrin che nel 1895 dimostrò che la radiazione catodica, emessa in un tubo a gas rarefatto (Tubo di Perrin), è costituita da corpuscoli (gli elettroni) elettricamente carichi.
Le conclusioni di Perrin furono confermate qualche anno più tardi (1897) da Wiechart, Kaufmann, J.J. Thomson, i quali riconobbero che l’elettrone aveva una massa sia pure molto piccola ( circa 1800 volte più piccola dell’atomo di idrogeno).
Le proprietà dell’elettrone si deducono dallo studio delle azioni che esso subisce da parte di un campo elettrico o, quando è in moto, da parte di un campo magnetico.
Le proprietà dell’elettrone sono essenzialmente di possedere:
- una massa m ( Esperienza di Thomson);
- una carica elettrica e ( Esperienza di Millikan);
- un momento angolare intrinseco o momento angolare di spin s (Esperienza di Stern e Gerlach);
- un momento magnetico m ( come conseguenza di b e c).
Le quattro grandezze corrispondenti tuttavia non sono indipendenti.
L’elettrone può essere pensato infatti come una particella con una carica elettrica negativa distribuita sulla sua superficie. La particella ruota intorno al proprio asse generando una corrente elettrica che a sua volta dà luogo ad un campo magnetico esattamente come succede negli avvolgimenti di un elettromagnete.
Sia il momento angolare di spin sia il momento magnetico si rappresentano con vettori che hanno la stessa direzione ma verso opposto, data la negatività della carica elettronica.
Il momento magnetico m è proporzionale alla corrente elettrica che circola lungo il perimetro dell’elettrone.
La corrente elettrica è proporzionale alla carica totale e dell’elettrone e alla velocità di rotazione.
Quest’ultima è proporzionale al momento angolare di spin s e inversamente proporzionale alla massa m dell’elettrone.
Il fattore g
In conclusione la relazione che lega le quattro grandezze è :
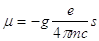 (1)
(1)
in cui il fattore numerico 4p c è introdotto per rendere coerente il sistema numerico (c è la velocità della luce nel vuoto) e g è una costante di proporzionalità.
E’ interessante confrontare il rapporto m/s fra il momento magnetico e il momento angolare nel caso dello spin dell’elettrone e nel caso del moto orbitale dell’elettrone.
In quest’ultimo caso si ha:
mL= IA = ef(pr2) (2) in cui
I= intensità di corrente
A = area dell’orbita
e = carica elettrica
f = frequenza di rotazione
r = raggio dell’orbita
Poiché:
½L½= mvr =m(2pfr)r =2mfpr2=(2m/e)mL si ha
mL= -(e/2m)L (3)
Il segno - nella (3) indica che il momento magnetico è opposto al momento angolare L.
I due membri della (3) non sono coerenti.
Occorre moltiplicare il denominatore per 2pc; si ottiene infine:
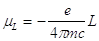 (4)
(4)
Confrontando la (1) con la (4) si ottiene:
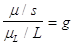 (5)
(5)
Cioè il rapporto tra il momento magnetico di spin e il momento angolare di spin è g volte l’analogo rapporto per il momento magnetico ed il momento angolare nel caso del moto orbitale dell’elettrone.
La costante di proporzionalità g (il fattore g) è un numero adimensionale, che è stato trovato, fin dalle prime misure che utilizzano il modello descritto, essere all’incirca uguale a 2.

Esperimento g meno 2
Fu effettuato da H.R Crane a partire dal 1950 presso l’Università del Michigan.
Un fascio di elettroni attraversava un campo magnetico con orientazione dell’asse di spin nota.
Il campo magnetico determinava 1) la precessione dell’asse (effetto trottola) e 2) una deviazione circolare o elicoidale dell’elettrone stesso (forza di Lorentz).
Se la frequenza della precessione di spin e la frequenza orbitale erano uguali il fattore g doveva essere esattamente 2.
L’esperimento misurava la differenze delle frequenze, cioè determinava g-2.
L’incertezza di questo metodo è dovuto alla sua natura statistica ( le misure sono fatte su un fascio e non su un singolo elettrone).
Esperimento del geonio
Fu effettuato da P. Ekstrom e D. Wineland alla Università di Washington a partire dal 1980.
L’esperimento elimina il principale fattore di incertezza dell’esperimento g-2 ( la natura statistica di esso), cercando di confinare un solo elettrone per un lungo periodo in uno spazio limitato.
L’elettrone viene intrappolato nello spazio tra elettrodi a forma di paraboloidi in cui agisce inoltre un campo magnetico uniforme. L’intera apparecchiatura, che ha un diametro di circa 4 cm, è immersa in elio liquido e sistemata nel nucleo di un magnete superconduttore. L’elettrone intrappolato è appoggiato, con l’apparecchiatura che lo contiene, sulla Terra, che costituisce, quindi, il nucleo intorno a cui gira l’elettrone intrappolato (geonio).
Facciamo il seguente ragionamento:
1) Supponiamo di considerare un elettrone stazionario in un campo magnetico uniforme.
L’elettrone ha due soli possibili livelli energetici distinti corrispondenti alle due orientazioni dell’asse di spin.
La differenza di energia tra questi livelli è il prodotto di tre grandezze:
- magnetone di Bohr definito come
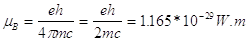
- campo magnetico esterno
- il fattore g
2) Supponiamo di considerare un elettrone in moto orbitale in un campo magnetico esterno (moto di ciclotrone).
L’elettrone possiede livelli energetici discreti corrispondenti a certe permesse dimensioni dell’orbita (le orbite permesse sono caratterizzate da un numero quantico intero n).
La differenza di energia tra livelli successivi è il prodotto di tre grandezze:
- magnetone di Bohr mB
- campo magnetico esterno B
- il fattore 2
Paragonando i due casi si vede che il fattore g è stato sostituito nel secondo dal 2.
Si può pensare quindi di misurare, nelle stesse condizioni, la separazione energetica degli stati nel primo e nel secondo caso; facendo il rapporto, il magnetone di Bohr e il campo magnetico si semplificano (essi compaiono sia al numeratore che al denominatore del rapporto) e quindi il rapporto misurato delle energie corrisponde a g/2.
Nella realtà le due condizioni ipotizzate di elettrone stazionario in cui si inverte solo lo spin o di elettrone in moto orbitale in cui cambia solo la dimensione dell’orbita non sono indipendenti ma coesistono.
Si possono immaginare due scale di livelli di energia a uguali distanze, una con spin verso il basso e l’altra con spin verso l’alto. Le due scale sono spostate l’una rispetto all’altra dell’energia necessaria per invertire lo spin.
Le transizioni possibili sono tre:
- Se lo spin è verso il basso, questo resta inalterato e l’orbita passa allo stato successivo.
L’energia necessaria per questa transizione è uguale al doppio del magnetone di Bohr moltiplicato per l’intensità del campo.
- Raggiunto lo stato successivo l’elettrone può invertire lo spin. In questo caso l’energia necessaria per la transizione è uguale al prodotto di g per il magnetone di Bohr per l’intensità del campo.
- L’elettrone può passare da un livello superiore della scala con spin verso il basso a quello immediatamente inferiore della scala con spin verso l’alto.
In questa terza transizione i livelli sono quasi coincidenti; la piccola differenza di energia è uguale a (g-2) per il magnetone di Bohr per l’intensità del campo.
Le tre possibili transizioni elencate corrispondono a tre frequenze della radiazione elettromagnetica che le determinano.
In conclusione:
- la frequenza fs necessaria per invertire lo spin è proporzionale a g
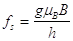 (6)
(6)- la frequenza fC necessaria per cambiare di una unità l’orbita di ciclotrone è proporzionale a 2
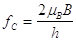 (7)
(7)- la frequenza fa che induce contemporaneamente una transizione dal livello superiore al livello inferiore e una inversione di spin (frequenza di anomalia) è proporzionale a (g-2)
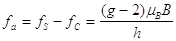 (8)
(8)
Le misure effettuate per determinare g sono:
- misura della frequenza di transizione di ciclotrone;
- misura della frequenza di anomalia
Il rapporto tra le frequenze è quindi uguale a
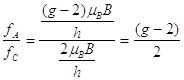 (9)
(9)
Per trovare g basta moltiplicare per 2 e aggiungere 2
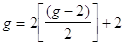 (10)
(10)
Sono state trovate ben undici cifre significative:
g = 2,0023193044
Negli anni quaranta l’elettrodinamica quantistica aveva fornito un metodo esplicito per il calcolo del fattore g.
Esso, in prima approssimazione, assume il valore 2. Le approssimazioni successive fornite dall’elettrodinamica quantistica sono in stretto accordo fino almeno alla 10a cifra decimale con i dati sperimentali.
Massa a riposo
L’esperienza di Thomson serve a determinare il rapporto e/m della carica sulla massa dell’elettrone.
Pur trattandosi di un esperimento dinamico si può ritenere che la velocità degli elettroni (dell’ordine di 106~107 m/s) sia piccola rispetto alla velocità della luce.
Si può dimostrare infatti che l’eventuale correzione relativistica è di qualche decimillesimo percentuale.
Per precisioni inferiori a tale limite la massa a riposo dell’elettrone si può ricavare dalla conoscenza della carica elettrica per mezzo dell’esperimento di Millikan e del rapporto e/m per mezzo dell’esperimento di Thomson.
Un modo alternativo di ricavare la massa a riposo dell’elettrone è stato proposto da Taylor B.N. ed altri ricavando il rapporto e/h tra la carica elettrica dell’elettrone e la costante di Planck e, dopo aver determinato e con un esperimento alla Millikan, ricavando il valore corretto di h.
Dalla conoscenza di e e di h si può ricavare m che è legata sia ad e che ad h.
Massa dinamica
Le proprietà dinamiche dell’elettrone sono correlate alla teoria della relatività ristretta e alla teoria quantistica.
Come è noto la teoria della relatività ristretta prevede una dipendenza della massa m dell’elettrone dalla sua velocità u secondo la ben nota formula:
 (11)
(11)
in cui m0 è la massa a riposo (cioè la massa misurata per u=0).
Già nel 1909 il fisico tedesco Bucherer aveva confermato in una serie di esperimenti la dipendenza prevista.
Significativo e didatticamente molto valido è l’esperimento della velocità limite o “esperimento del M.I.T.”, eseguito da W. Bertozzi nel 1963 .
In esso gli elettroni vengono accelerati prima da un acceleratore di Van der Graaff fino ad una energia massima Tmax=1.5 MeV e poi da un linac (acceleratore lineare) fino ad una energia massima Tmax= 15 MeV.
Siccome l’energia cinetica è fornita dal lavoro delle forze del campo elettrico, deve essere:
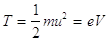 (12)
(12)
in cui e è la carica dell’elettrone, V la differenza di potenziale applicata, m la massa e u la velocità che dovrebbe raggiungere.
La relazione precedente può essere scritta:
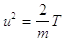 (13)
(13)
I risultati dell’esperimento sono sintetizzati nella seguente tabella e messi a confronto con i valori classici e quelli relativistici:
(1) |
(2) |
(3) |
(4) |
(5) |
T(MeV) |
(usper)2 |
(uclass.)2 |
usper./c |
(urel.)2 |
0.5 |
6.8*1016 |
17.6*1016 |
0.87 |
6.7*1016 |
1.0 |
7.7*1016 |
35.3*1016 |
0.91 |
8.0*1016 |
1.5 |
8.3*1016 |
53*1016 |
0.96 |
8.4*1016 |
4.5 |
8.8*1016 |
160*1016 |
0.99 |
8.9*1016 |
15.0 |
9.0*1016 |
530*1016 |
1.0 |
9.0*1016 |
Si nota immediata dal confronto dei dati della colonna (2) con quelli della colonna (3) e (5) come i valori sperimentali si accordino bene con le previsioni relativistiche e non si accordino affatto con le previsioni classiche.
Più recentemente si è determinato il rapporto e/m per velocità diverse con esperimenti alla Thomson.
Ancora una volta i dati sperimentali sono in ottimo accordo con le previsioni relativistiche.
L’elettrone nella meccanica quantistica
Si può dire che l’elettrone ha seguito le varie tappe della meccanica quantistica, costituendo un punto di riferimento essenziale per tutti i grandi fisici, che nella prima parte del nostro secolo hanno contribuito a definire quella che si è rivelata la teoria più completa e proficua per la comprensione dei fenomeni della natura.
1905
Einstein deduce l’equazione
E = hn - P (14)
che fornisce l’energia degli elettroni liberati da una superficie metallica quando è irradiata da luce di frequenza n (P è il lavoro di estrazione cioè l’energia necessaria per sfuggire dalla superficie) e rappresenta la prima equazione della teoria quantistica dell’interazione tra radiazione e materia.
L’equazione (14) fa delle previsioni del tutto innovative:
- E varia linearmente con n;
- la pendenza del grafico di E in funzione di n è indipendente dalla natura del materiale irraggiato;
- il valore di tale pendenza coincide con la costante di Planck.
1913
Con una celebre memoria sull’atomo di idrogeno Bohr trova la relazione tra le serie di righe dell’atomo di idrogeno rappresentate dalla formula empirica
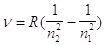 (15)
(15)
dove n è il numero d’onde della riga, n2 ed n1 sono degli interi , n2 è costante per una data serie ed R è una costante (la costante di Ryldberg) e la struttura dell’atomo stesso. Questo viene rappresentato come costituito da un nucleo pesante attorno a cui ruota un elettrone, che ai fini dell’emissione dello spettro caratteristico dell’atomo di idrogeno ha i seguenti comportamenti:
- Esistono solo certe orbite discrete, che soddisfano opportune condizioni quantiche. In contraddizione alla teoria classica, l’elettrone non emette radiazione quando si trova in una di tali orbite.
2)Viene emessa o assorbita radiazione quando l’elettrone passa da una all’altra di tali orbite e la differenza di energia fra gli stati corrispondenti viene emessa o assorbita come quanto di luce di energia hn (nè la frequenza della radiazione emessa o assorbita), valendo quindi la relazione:
hn = En1-En2 (16)
le E essendo le energie degli stati iniziale e finale.
In base a tale modello Bohr è in grado di ricavare una espressione analitica della costante di Rildberg
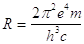 (17)
(17)
(con ovvio significato dei simboli) che si accordava con un errore non superiore a qualche punto percentuale con i valori misurati (13,597 eV).
1923
Con una memoria intitolata A quantum theory of the scattering of X-rays by light elements Compton assume che la radiazione X è costituita da quanti aventi energia E = hn e quantità di moto P=h/l (l è la lunghezza d’onda della radiazione). Secondo questa concezione quantistica si prevede che un quanto di luce, colpendo un elettrone, dovesse perdere energia, aumentando quindi la propria lunghezza d’onda di una quantità pari a:
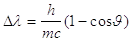 (18)
(18)
in cui J è l’angolo tra la direzione originaria del fotone e la direzione di quello diffuso.
Da notare che la relazione (18) si ottiene in modo semplice e diretto applicando all’interazione tra fotone ed elettrone il principio di conservazione dell’energia ed il principio di conservazione della quantità di moto. La verifica sperimentale della (18) ha contribuito in modo determinante all’affermazione della meccanica quantistica, rappresentando una prova inconfutabile dell’esistenza del quanto di luce.
Le difficoltà incontrate dalla teoria di Bohr a spiegare gli spettri degli atomi con due o più elettroni sono state il punto di partenza per lo sviluppo della meccanica ondulatoria (de Broglie, Schroedinger) e della meccanica quantistica (Heisenberg, Dirac), che sono formulazioni matematiche diverse della stessa teoria fisica.
1924
L’ipotesi di L.V. de Broglie di una dualità onda-corpuscolo espressa nel 1924 dalla famosa relazione l = h/mv per cui a un corpuscolo di massa m e velocità v è associata una lunghezza d’onda che dipende dalla costante h di Planck era più facilmente verificabile per un elettrone.
In realtà la prima verifica sperimentale fu fatta nel 1927 da Davisson e Germer nei laboratori della Bell Telephon . Essi utilizzarono elettroni con energia cinetica K=54 eV la cui lunghezza d’onda associata è, in base all’ipotesi di De Broglie:
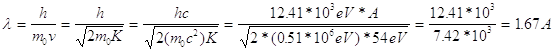
Si tratta, come si nota, di lunghezze d’onda dell’ordine di grandezza delle distanze interatomiche. Essi in effetti utilizzarono un cristallo di nichel, le cui distanze interatomiche, determinate con misure di diffrazione di raggi X erano dell’ordine di qualche A.
L’esperimento mise chiaramente in evidenza la diffrazione degli elettroni ed inoltre era quantitativamente in buon accordo con le previsioni di De Broglie.
1925
Pauli introduce il principio di esclusione per comprendere la formazione del sistema periodico e le proprietà di periodicità degli atomi. Si tratta di una ipotesi aggiuntiva, rispetto ai principi fondamentali della meccanica quantistica, che, pur integrandosi armonicamente con la nuova teoria, non ha ancora una adeguata giustificazione teorica.
Come si sa, il principio di esclusione afferma che in uno stesso atomo due elettroni non possono avere gli stessi numeri quantici n, l, m, s.
1926
Schroedinger ricava l’equazione d’onda di una particella in un campo esterno U (ovviamente pensava all’elettrone) e l’equazione degli stati stazionari:
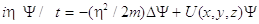 (19)
(19)
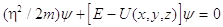 (20)
(20)
e, per l’elettrone libero:
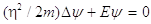 (21)
(21)
Nelle ultime tre equazioni Y è la funzione d’onda della particella, D è l’operatore Laplaciano D=¶2/¶x2+¶2/¶y2+¶2/¶z2 ed E=p2/2m (p rappresenta la quantità di moto) è l’energia della particella.
La soluzione dell’equazione (21) è un’onda piana del tipo:
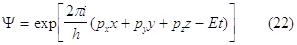
che si propaga nella stessa direzione di p, con una frequenza angolare 2pE/h e una lunghezza d’onda h/p ritrovando in tal modo, ancora, la lunghezza d’onda associata di de Broglie.
Inoltre la velocità di gruppo dell’onda (22) è:
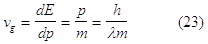
1926-27
Quasi contemporaneamente a Schroedinger, Heisenberg e Born sviluppano la meccanica quantistica per mezzo della rappresentazione matriciale pervenendo a risultati del tutto analoghi.
La definizione del principio di indeterminazione di Heisenberg è conseguente a considerazioni sul comportamento dell’elettrone. Esso infatti in alcune esperienze si comporta dal punto di vista meccanico come una particella. Questo comportamento sussiste solo in un campo limitato e quindi dovrebbe essere possibile dedurre il limite di applicabilità del modello corpuscolare.
Il ragionamento che fa Heisenberg a tale scopo è il seguente.
La posizione di un elettrone, come si evince dagli esperimenti in camera di Wilson, è nota con una incertezza Dq (pari almeno all’ampiezza della traccia della nebbiolina). Questo fatto può essere descritto anche secondo il modello ondulatorio mediante una funzione d’onda la cui ampiezza è sensibilmente diversa da zero in un dominio dell’ordine di grandezza di Dq. Una tale funzione d’onda può essere pensata come la risultante di onde parziali che interferiscono distruttivamente dovunque tranne in un dominio spaziale di ampiezza Dq (pacchetto d’onda).
Col passare del tempo il pacchetto d’onda cambia grandezza e forma diffondendosi nello spazio.
Occorre quindi una analisi attenta per definire la sua velocità. Rispetto a un osservatore esterno, la cresta del treno d’onde procede in una determinata direzione con una certa velocità; rispetto invece ad un osservatore solidale col pacchetto d’onde, essa va indietro verso la coda del treno diminuendo la propria ampiezza e poi scomparendo, mentre altre onde compaiono in avanti aumentando la propria ampiezza fino ad un valore massimo e poi scomparendo in coda a loro volta. Non è possibile cioè definire esattamente la velocità e , in conseguenza, l’impulso p.
Anche questo quindi è conosciuto con una incertezza Dp.
Il treno d’onda nel complesso si muove con una velocità più alta delle singole onde di cui è composto. Definiamo velocità di gruppo vg la velocità del treno (che a sua volta rappresenta l’elettrone) mentre la velocità delle singole onde è la velocità di fase.
Dalla meccanica ondulatoria era stata trovata (23) la velocità di gruppo dell’onda associata ad un elettrone libero.
Se ora immaginiamo il pacchetto d’onda di ampiezza Dq costituito da una opportuna sovrapposizione di onde piane tutte di lunghezze d’onda vicine al valore medio l0, ci saranno in totale Dq/l0 = n lunghezze d’onda nel pacchetto. Se indichiamo con Dl l’ampiezza dell’intervallo di lunghezze d’onda che fanno parte del pacchetto, deve valere la relazione:
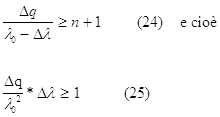
L’incertezza della velocità di gruppo, corrispondente all’intervallo Dl, è quindi:
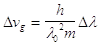 (26)
(26)
Poiché per definizione si ha che Dp=mDvg , combinando con la (25), si ottiene:
Dp*Dq ³ h (27)
La relazione trovata si può applicare a ciascun grado di libertà della particella e costituisce il limite del campo di applicabilità della teoria corpuscolare.
Heisenberg dedusse la sua relazione di indeterminazione attraverso una serie di esperimenti ideali che possono essere raggruppati in tre categorie, tutte riferentesi ad elettroni :
Misure di posizione di elettroni liberi
Supponiamo che un elettrone si muova sotto l’obbiettivo di un microscopio e che in un dato istante sia a l’angolo sotto cui sono ricevuti i raggi di lunghezza d’onda l e di frequenza n, provenienti dall’elettrone. Come si sa dall’ottica l’esattezza della posizione dell’elettrone è dell’ordine di:
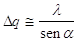 (28)
(28)
L’elettrone, illuminata dalla luce di lunghezza d’onda l riceve per effetto Compton un impulso di rinculo dell’ordine di grandezza hn/c con una incertezza sul momento
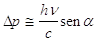 (29)
(29)
Combinando la (28) con (29) si ottiene Dp*Dq @ h
Un altro esempio di determinazione della posizione di un elettrone si ha nel caso in cui si fa passare un fascetto di elettroni attraverso la fenditura di uno schermo di larghezza d. In questo caso rappresentando l’elettrone con un’onda piana di De Broglie di lunghezza d’onda l ci sarà una dispersione dopo il passaggio dell’ordine di
Dq @ l/sena (30)
Quindi la componente dell’impulso parallela allo schermo avrà, dopo il passaggio una incertezza
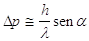 (31)
(31)
( h/l è l’impulso dell’elettrone nella direzione del raggio).
Combinando la (30) con (31) si ottiene ancora Dp*Dq @ h
Misure di velocità o d’impulso di elettroni liberi
Heisenberg pensa ad un dispositivo ideale, che sfrutta l’effetto Doppler.
Pensa anche ad un dispositivo che utilizza la curvatura di particelle cariche in moto in un campo magnetico. Anche in questi casi egli è capace di dedurre la relazione di indeterminazione.
Elettroni
legati
Si fa distinzioni tra due possibili casi:
si considera nota l’energia, cioè lo stato stazionario del sistema; in questo caso si deduce che l’indeterminazione nella conoscenza della posizione e dell’impulso è generalmente maggiore di Dp*Dq @ h
si rinuncia alla conoscenza dello stato stazionario; si fanno cioè esperimenti per la determinazione della posizione e dell’impulso distruttivi dello stato stazionario (è come se l’elettrone fosse libero). In questo caso l’incertezza sarà dell’ordine di Dp*Dq @ h.
1928
L’equazione dinamica di Schroedinger può essere considerata come la legge dinamica della microfisica, l’analogo quanto-meccanico delle equazioni di Newton della macrofisica classica.
All’epoca, invece, si aveva una conoscenza quasi nulla dell’elettrodinamica quantica e ancora meno dell’elettrodinamica quanto-relativistica.
In quell’anno Dirac dedusse le equazioni d’onda quanto-relativistiche dell’elettrone libero e dell’elettrone immerso in un campo elettromagnetico:
in cui le p, s e r sono degli operatori in rappresentazione metriciale, (s,p) è un prodotto tra matrici ed A0 ed A sono rispettivamente il potenziale scalare e il potenziale vettore del campo che agisce sull’elettrone.
Le equazioni di Dirac soddisfano la condizione di invarianza per trasformazioni di Lorentz, prevedono l’esistenza dello spin in presenza di un campo, la struttura fine dei livelli energetici dell’atomo di idrogeno ed inoltre, poiché la (33) ammette anche soluzioni con energia negativa, tali soluzioni sono compatibili solo se si ha a che fare con carica elettronica positiva (positone, la cui esistenza è stata scoperta successivamente).
La teoria quanto-relativistica nata a partire da quegli anni è stata capace di spiegare l’interazione tra elettroni e fotoni ed, in generale, tra materia e luce.
Diceva Feynman: “La teoria quantistica descrive tutti i fenomeni del mondo fisico, eccezion fatta per l’effetto gravitazionale e per i fenomeni radioattivi. Si tratta del gioiello della fisica...”
Note Bibliografiche
link sito web: http://digilander.libero.it/gugliotta1
Autore del testo: GUGLIOTTA CALOGERO
Liceo Scientifico E.Fermi Menfi (Ag.)
Elettrone
Visita la nostra pagina principale
Elettrone
Termini d' uso e privacy