Stati fisici della materia
Stati fisici della materia
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
GLI STATI FISICI DELLA MATERIA
La teoria cinetica della materia
Tra le particelle (atomi, molecole, ioni) che formano le varie sostanze esistono sempre delle forze, dette forze di coesione, che tendono a legarle le une alle altre. L'entità di tali forze, e dunque l'energia con cui le particelle sono legate tra loro, dipende dalla natura del legame chimico che intercorre tra di esse.
In aggiunta all'energia di coesione, tutte le particelle che formano la materia possiedono anche un'energia cinetica, ovvero di movimento, che non dipende dal legame chimico tra di esse, ma unicamente dalla temperatura. Abbiamo già incontrato questo concetto quando abbiamo parlato del modello particellare dei gas: esso in verità si applica a tutta la materia e non solo a quella nello stato aeriforme. L'entità dei movimenti delle singole particelle varia però dal moto libero in tutte le direzioni, dei gas, allo scivolamento tra particelle che rimangono sempre in contatto, come nei liquidi, fino alle semplici vibrazioni intorno a posizioni di equilibrio dei solidi. Solo allo zero assoluto tutte le particelle sono perfettamente immobili; questa immagine di un universo fatto da particelle in movimento è alla base in una teoria fisica, detta per questo teoria cinetica della materia. Del resto, oltre che nelle trasformazioni descritte dalle leggi dei gas, anche nella vita di tutti i giorni non è difficile osservare fenomeni che possono essere spiegati facendo riferimento al movimento delle particelle: ad esempio, noi percepiamo il profumo di un cibo perché da esso si liberano particelle allo stato aeriforme, che si spostano nell’aria fino a raggiungere il nostro naso. Per confermare che il movimento dipende dalla temperatura, possiamo rilevare che i cibi caldi odorano più di quelli freddi, mentre quelli surgelati non odorano per niente. Questo movimento spontaneo delle particelle da un punto all’altro di un sistema prende il nome di diffusione; essa avviene anche nei liquidi, anche se più lentamente che nei gas, come si osserva versando una goccia d’inchiostro in un bicchiere di acqua. La diffusione invece non si verifica all’interno dei solidi, anche se alcuni di essi, come la naftalina, passano direttamente, ed in modo spontaneo, allo stato gassoso.
L'energia di movimento, facendo agitare le particelle, tende a farle allontanare tra loro, fenomeno dimostrato anche dal fatto che, all’aumentare della temperatura, tutti i corpi si dilatano. Lo stato fisico assunto dalla materia dipende in definitiva da quale delle due forme di energia (di coesione oppure di movimento) prevale sull'altra.
Stato solido: l'energia di coesione è nettamente prevalente su quella di movimento, così che le particelle sono strettamente legate le une alle altre, tanto da occupare delle posizioni fisse nello spazio. Il movimento è limitato a piccole oscillazioni intorno a queste posizioni. I solidi hanno pertanto volume e forma propri.
Stato liquido: L'energia di coesione prevale ancora su quella di movimento, ma in modo meno netto che nei solidi. Le particelle del liquido possono scorrere le une sulle altre, variando così la forma generale del liquido, ma rimanendo però sempre a contatto tra loro e circa alla stessa distanza. I liquidi hanno dunque volume proprio, perché le particelle non possono essere ne' avvicinate né allontanate tra loro, ma assumono la forma del recipiente che li contiene.
Stato gassoso: l'energia cinetica prevale su quella di coesione e le particelle sono del tutto separate le une dalle altre e libere di muoversi in tutto lo spazio a loro disposizione. I gas non hanno quindi né forma né volume proprio, risultando comprimibili.
Passaggi di stato
Già sappiamo che qualunque sostanza, al variare della temperatura, può passare da uno all’altro dei tre stati della materia.
Verifichiamo adesso cosa succede scaldando un corpo allo stato solido: all'aumentare della temperatura le sue particelle oscillano in modo più ampio intorno alle loro posizioni fisse. Ad una data temperatura, che è caratteristica di ogni sostanza e che alla pressione di una atmosfera prende il nome di temperatura normale di fusione, la sostanza solida passa allo stato liquido, ove le particelle, pur essendo ancora legate tra di loro, hanno la possibilità di scivolare le une rispetto alle altre. Tale fenomeno prende il nome di fusione. Aumentando ancora la temperatura, e dunque l'energia di movimento delle particelle, queste si separano le une dalle altre, vincendo le forze di coesione, e passano allo stato gassoso. Quest'ultimo fenomeno prende il nome di evaporazione. L'evaporazione di un liquido può avvenire a varie temperature; è infatti noto che, in misura maggiore o minore, l'acqua evapora sempre da un recipiente tenuto aperto. In quest'ultimo caso però l'evaporazione avviene solo alla superficie del liquido. Esiste invece una temperatura, caratteristica di ogni sostanza, e che, alla pressione di un'atmosfera, prende il nome di temperatura normale di ebollizione, alla quale l'evaporazione avviene anche all'interno del liquido. Tale fenomeno si dice appunto ebollizione. Infatti le bolle che si formano nell'acqua in ebollizione sono proprio bolle di vapore acqueo che si forma all'interno del liquido stesso.
 Poiché nell'ebollizione le particelle si separano le une dalle altre, la temperatura normale di ebollizione di una sostanza può essere presa come misura della forza di coesione esistente tra le sue particelle.
Poiché nell'ebollizione le particelle si separano le une dalle altre, la temperatura normale di ebollizione di una sostanza può essere presa come misura della forza di coesione esistente tra le sue particelle.
Il fatto dunque che una certa sostanza, ad una data temperatura e quindi per una data energia di movimento delle sue particelle, sia solida, liquida o gassosa, dipende dalla forza di coesione tra le sue particelle medesime.
Seguendo il percorso inverso a quello sin qui descritto, ovvero raffreddando un gas, si riduce l'energia di movimento delle sue particelle fino al punto in cui il gas non passerà allo stato liquido. Tale fenomeno prende il nome di condensazione o liquefazione. Raffreddando ancora il liquido, ad una certa temperatura, ovviamente uguale a quella di fusione, questo passerà allo stato solido. Quest'ultimo processo prende il nome di solidificazione.
Il passaggio di stato che conduce direttamente dallo stato solido a quello gassoso prende il nome di sublimazione. Un esempio di sostanza che sublima è rappresentato dalla naftalina. Anche il passaggio di stato inverso, ovvero quello che conduce direttamente dallo stato gassoso a quello solido, prende il nome di sublimazione, ma viene anche detto brinamento, proprio perché ne è un esempio la formazione degli aghetti di ghiaccio della brina, che si formano di notte nei campi, direttamente dal vapore acqueo presente nell'aria.
Lo stato liquido
Il comportamento e le caratteristiche dei liquidi possono essere riassunte nel modo seguente:
- I liquidi hanno densità maggiore dei gas e minore dei solidi .
- I liquidi sono praticamente incompressibili; da ciò deriva che hanno volume proprio.
- I liquidi assumono la forma del recipiente che li contiene ed hanno la capacità di scorrere nelle condutture o lungo superfici .
- I liquidi diffondono l’uno nell’altro meno velocemente dei gas, a causa della maggior coesione tra le molecole.
 Abbiamo già parlato dell’evaporazione, ovvero del passaggio allo stato aeriforme delle molecole del liquido che si trovano alla sua superficie, fenomeno che avviene a qualsiasi temperatura. Cerchiamo adesso di capire, a livello delle molecole, in cosa consista tale fenomeno ed a quali cause sia dovuto. Innanzitutto all’interno del liquido le molecole non hanno tutte la stessa energia di movimento: alcune particelle infatti si agitano di più ed altre si agitano di meno, anche se l’agitazione media complessiva delle molecole aumenta all’aumentare della temperatura. Sappiamo inoltre che ogni particella è legata alle altre vicine, tuttavia quelle che si trovano alla superficie del liquido sono meno vincolate delle altre perché si legano solo nella parte inferiore, mentre restano libere in quella superiore, a contatto con l’aria. A questo punto non è difficile immaginare che molecole dotate di maggior agitazione, che si trovano vicino alla superficie, possano lasciare il liquido passando allo stato di vapore. Poiché a lasciare il liquido sono le molecole dotate di maggior agitazione, in seguito all’evaporazione il liquido nel suo complesso perderà una parte della sua energia di movimento e quindi si raffredderà.
Abbiamo già parlato dell’evaporazione, ovvero del passaggio allo stato aeriforme delle molecole del liquido che si trovano alla sua superficie, fenomeno che avviene a qualsiasi temperatura. Cerchiamo adesso di capire, a livello delle molecole, in cosa consista tale fenomeno ed a quali cause sia dovuto. Innanzitutto all’interno del liquido le molecole non hanno tutte la stessa energia di movimento: alcune particelle infatti si agitano di più ed altre si agitano di meno, anche se l’agitazione media complessiva delle molecole aumenta all’aumentare della temperatura. Sappiamo inoltre che ogni particella è legata alle altre vicine, tuttavia quelle che si trovano alla superficie del liquido sono meno vincolate delle altre perché si legano solo nella parte inferiore, mentre restano libere in quella superiore, a contatto con l’aria. A questo punto non è difficile immaginare che molecole dotate di maggior agitazione, che si trovano vicino alla superficie, possano lasciare il liquido passando allo stato di vapore. Poiché a lasciare il liquido sono le molecole dotate di maggior agitazione, in seguito all’evaporazione il liquido nel suo complesso perderà una parte della sua energia di movimento e quindi si raffredderà.
 Consideriamo adesso una certa quantità di un liquido qualsiasi, contenuta in un recipiente chiuso da un coperchio mobile, ma a tenuta stagna. Un dato numero di molecole di esso sfugge dallo stato liquido e va ad occupare, allo stato aeriforme, lo spazio soprastante la superficie del liquido compreso tra le pareti del recipiente. Contemporaneamente inizia però anche il processo inverso, infatti anche nel vapore che sovrasta il liquido la distribuzione dell’energia di movimento non è uniforme: alcune particelle si agitano di più, mentre altre si agitano di meno. Qualcuna di queste, che casualmente si trova vicino al liquido, ne urta la superficie e ritorna allo stato liquido. Nel contenitore chiuso il sistema si evolve fino a che la quantità di liquido che passa allo stato di vapore è pari a quella che, al contrario, ritorna allo stato liquido. Il sistema si trova a questo punto in una situazione di equilibrio, nel senso che la massa delle frazioni liquida ed aeriforme della sostanza non cambiano nel tempo, poiché i due processi inversi (vaporizzazione e condensazione) procedono coinvolgendo la stessa quantità di sostanza; un equilibrio di questo tipo viene detto dinamico. Se si aumenta il volume a disposizione del gas, alzando il coperchio, altro liquido evapora, fino a raggiungere un nuovo stato di equilibrio, in cui però il numero di molecole di gas per unità di volume è lo stesso di quello iniziale. Se viceversa si riduce il volume del gas, abbassando il coperchio, una certa quantità di gas condensa, fino a che il numero di particelle per unità di volume non ritorna quello iniziale. Il gas in equilibrio con la sua fase liquida esercita una pressione costante a temperatura costante: tale pressione viene detta tensione di vapore saturo di quel liquido a quella data temperatura. La tensione di vapore di un liquido non dipende dallo spazio a disposizione del gas, né dalla superficie di separazione liquido-gas, né dalla quantità di liquido, purché sia sufficiente a far raggiungere l’equilibrio al sistema: essa è infatti una proprietà intensiva e caratteristica del liquido stesso. La tensione di vapore aumenta all’aumentare della temperatura, sia perché aumenta l’energia cinetica delle particelle allo stato gassoso, sia perché aumentano le particelle che dal liquido passano al gas. Se l’evaporazione avviene in un recipiente aperto, lo spazio a disposizione è infinito, il sistema non raggiunge mai l’equilibrio, e la pressione della fase gassosa non eguaglia mai la tensione di vapor saturo del liquido a quella temperatura: nel tentativo di raggiungere l’equilibrio la velocità di evaporazione è sempre maggiore di quella di condensazione e dunque tutto il liquido finisce per evaporare. Anche nel caso del recipiente aperto tuttavia sulla superficie del liquido si esercita una pressione: la pressione atmosferica, il cui effetto è comunque quello di ostacolare l’evaporazione, impedendo che essa si verifichi anche all’interno del liquido, oltre che alla sua superficie. Infatti se riduciamo la pressione che si esercita sulla superficie del liquido, ad esempio utilizzando una pompa aspirante in un recipiente chiuso, ad un certo punto, quando la pressione esterna eguaglia la tensione di vapore del liquido a quella temperatura, l’evaporazione avviene anche all’interno del liquido, che pertanto comincia a bollire. L’ebollizione avviene dunque quando la pressione esercitata sul liquido uguaglia la sua tensione di vapore a quella temperatura. Per uguagliare le due pressioni possiamo però anche innalzare la tensione di vapore del liquido aumentandone la temperatura. Se si opera alla pressione atmosferica, ad esempio con un recipiente aperto, il liquido bolle quando la sua tensione di vapore raggiunge il valore di una atmosfera e la temperatura alla quale ciò avviene è detta temperatura normale di ebollizione di quel liquido. La temperatura di ebollizione rimane costante durante tutto il processo di ebollizione, qualunque sia la quantità di calore fornita al liquido. Tale temperatura corrisponde infatti all’energia cinetica necessaria a vincere le forze di coesione tra le molecole del liquido e rappresenta pertanto una proprietà caratteristica della sostanza in questione. Aumentando la quantità di calore fornito al sistema aumenta solo la velocità del processo di ebollizione.
Consideriamo adesso una certa quantità di un liquido qualsiasi, contenuta in un recipiente chiuso da un coperchio mobile, ma a tenuta stagna. Un dato numero di molecole di esso sfugge dallo stato liquido e va ad occupare, allo stato aeriforme, lo spazio soprastante la superficie del liquido compreso tra le pareti del recipiente. Contemporaneamente inizia però anche il processo inverso, infatti anche nel vapore che sovrasta il liquido la distribuzione dell’energia di movimento non è uniforme: alcune particelle si agitano di più, mentre altre si agitano di meno. Qualcuna di queste, che casualmente si trova vicino al liquido, ne urta la superficie e ritorna allo stato liquido. Nel contenitore chiuso il sistema si evolve fino a che la quantità di liquido che passa allo stato di vapore è pari a quella che, al contrario, ritorna allo stato liquido. Il sistema si trova a questo punto in una situazione di equilibrio, nel senso che la massa delle frazioni liquida ed aeriforme della sostanza non cambiano nel tempo, poiché i due processi inversi (vaporizzazione e condensazione) procedono coinvolgendo la stessa quantità di sostanza; un equilibrio di questo tipo viene detto dinamico. Se si aumenta il volume a disposizione del gas, alzando il coperchio, altro liquido evapora, fino a raggiungere un nuovo stato di equilibrio, in cui però il numero di molecole di gas per unità di volume è lo stesso di quello iniziale. Se viceversa si riduce il volume del gas, abbassando il coperchio, una certa quantità di gas condensa, fino a che il numero di particelle per unità di volume non ritorna quello iniziale. Il gas in equilibrio con la sua fase liquida esercita una pressione costante a temperatura costante: tale pressione viene detta tensione di vapore saturo di quel liquido a quella data temperatura. La tensione di vapore di un liquido non dipende dallo spazio a disposizione del gas, né dalla superficie di separazione liquido-gas, né dalla quantità di liquido, purché sia sufficiente a far raggiungere l’equilibrio al sistema: essa è infatti una proprietà intensiva e caratteristica del liquido stesso. La tensione di vapore aumenta all’aumentare della temperatura, sia perché aumenta l’energia cinetica delle particelle allo stato gassoso, sia perché aumentano le particelle che dal liquido passano al gas. Se l’evaporazione avviene in un recipiente aperto, lo spazio a disposizione è infinito, il sistema non raggiunge mai l’equilibrio, e la pressione della fase gassosa non eguaglia mai la tensione di vapor saturo del liquido a quella temperatura: nel tentativo di raggiungere l’equilibrio la velocità di evaporazione è sempre maggiore di quella di condensazione e dunque tutto il liquido finisce per evaporare. Anche nel caso del recipiente aperto tuttavia sulla superficie del liquido si esercita una pressione: la pressione atmosferica, il cui effetto è comunque quello di ostacolare l’evaporazione, impedendo che essa si verifichi anche all’interno del liquido, oltre che alla sua superficie. Infatti se riduciamo la pressione che si esercita sulla superficie del liquido, ad esempio utilizzando una pompa aspirante in un recipiente chiuso, ad un certo punto, quando la pressione esterna eguaglia la tensione di vapore del liquido a quella temperatura, l’evaporazione avviene anche all’interno del liquido, che pertanto comincia a bollire. L’ebollizione avviene dunque quando la pressione esercitata sul liquido uguaglia la sua tensione di vapore a quella temperatura. Per uguagliare le due pressioni possiamo però anche innalzare la tensione di vapore del liquido aumentandone la temperatura. Se si opera alla pressione atmosferica, ad esempio con un recipiente aperto, il liquido bolle quando la sua tensione di vapore raggiunge il valore di una atmosfera e la temperatura alla quale ciò avviene è detta temperatura normale di ebollizione di quel liquido. La temperatura di ebollizione rimane costante durante tutto il processo di ebollizione, qualunque sia la quantità di calore fornita al liquido. Tale temperatura corrisponde infatti all’energia cinetica necessaria a vincere le forze di coesione tra le molecole del liquido e rappresenta pertanto una proprietà caratteristica della sostanza in questione. Aumentando la quantità di calore fornito al sistema aumenta solo la velocità del processo di ebollizione.
Le soluzioni
 Abbiamo già trattato le soluzioni l’anno passato, quando abbiamo affrontato il significato di soluto e di solvente, quello di solubilità, nonché quello di concentrazione, con i vari modi per indicarla. In proposito dobbiamo adesso aggiungere un nuova espressione della concentrazione, che risulterà molto utile nella trattazione degli argomenti successivi; essa è chiamata molarità e corrisponde al numero di moli di soluto presenti in un litro di soluzione. La sua unità di misura è quindi moli/ litro. E’ molto importante ricordare che il volume considerato è quello dell’intera soluzione (soluto + solvente) e non quello del solvente da solo. Per preparare quindi una soluzione che contenga 1 mole di soluto per litro di soluzione (concentrazione 1 M, che si legge “uno molare”) poniamo una mole del soluto in un recipiente graduato ed aggiungiamo il solvente (acqua ad esempio) fino ad arrivare al volume di un litro.
Abbiamo già trattato le soluzioni l’anno passato, quando abbiamo affrontato il significato di soluto e di solvente, quello di solubilità, nonché quello di concentrazione, con i vari modi per indicarla. In proposito dobbiamo adesso aggiungere un nuova espressione della concentrazione, che risulterà molto utile nella trattazione degli argomenti successivi; essa è chiamata molarità e corrisponde al numero di moli di soluto presenti in un litro di soluzione. La sua unità di misura è quindi moli/ litro. E’ molto importante ricordare che il volume considerato è quello dell’intera soluzione (soluto + solvente) e non quello del solvente da solo. Per preparare quindi una soluzione che contenga 1 mole di soluto per litro di soluzione (concentrazione 1 M, che si legge “uno molare”) poniamo una mole del soluto in un recipiente graduato ed aggiungiamo il solvente (acqua ad esempio) fino ad arrivare al volume di un litro.
Le proprietà colligative delle soluzioni
Le proprietà di una soluzione acquosa dipendono dalle proprietà dell’acqua, da quelle del soluto e dalla concentrazione. Sappiamo, ad esempio, che l’acqua salata è diversa dall’acqua zuccherata, sappiamo però che anche l’acqua salata non è sempre salata allo stesso modo. Esistono tuttavia alcune proprietà delle soluzioni che non dipendono dalle caratteristiche chimiche del solvente, bensì unicamente dalla concentrazione della soluzione. Le proprietà delle soluzioni che non dipendono dalla natura chimica del soluto, ma esclusivamente dalla concentrazione si definiscono proprietà colligative.
Vediamo adesso le più importanti proprietà colligative, cominciando dalla variazione della tensione di vapore che si registra in una soluzione rispetto al solvente puro. Prendiamo due contenitori di ugual volume e riempiamoli parzialmente, il primo con acqua pura, ed il secondo con una soluzione acquosa di un soluto meno volatile dell’acqua, come ad esempio il cloruro di sodio. In entrambi i contenitori alcune molecole di acqua passeranno allo stato di vapore nello spazio sopra il liquido, cosa che non accadrà per il cloruro di sodio, che resterà invece sciolto nella soluzione. A parità di volume però, nella soluzione si hanno meno molecole di acqua che non nel solvente pure, perché parte dello spazio è occupato dal cloruro di sodio disciolto; conseguentemente, il numero di molecole che evaporano dalla soluzione sarà minore di quelle che evaporano dal solvente puro. Se chiudiamo i due contenitori vedremo quindi che in quello della soluzione la pressione del vapore sarà minore di quella nel recipiente con acqua pura: in base alla definizione di tensione di vapore possiamo concludere pertanto che la tensione di vapore di una soluzione, ad una data temperatura, è sempre minore di quella del solvente puro. Tale fenomeno è indipendente dal tipo di soluto, purché abbia sia meno volatile dell’acqua , e dipende unicamente dal numero di particelle di soluto in un dato volume di soluzione, ovvero dalla concentrazione della soluzione. L’abbassamento della tensione di vapore che si verifica in una soluzione rispetto al solvente puro ha l’importante conseguenza di far innalzare la temperatura di ebollizione, fenomeno che prende il nome di innalzamento ebulliscopico. Si deve infatti raggiungere una temperatura più elevata perché la tensione di vapore raggiunga il valore della pressione esterna, innescando l’ebollizione. Per ragioni analoghe una soluzione ha una temperatura normale di solidificazione più bassa del solvente puro, fenomeno chiamato abbassamento crioscopico. Nel caso si aggiunga all’acqua un soluto più volatile di essa, come ad esempio alcol etilico, si ottiene comunque l’effetto dell’abbassamento crioscopico, mentre per quel che riguarda la temperatura di ebollizione le cose sono più complicate.
 Passiamo adesso ad analizzare una altro fenomeno che si verifica nelle soluzioni ed al quale abbiamo già accennato: la diffusione. Essa ha luogo semplicemente perché le molecole degli aeriformi e dei liquidi si muovono, come sappiamo, in modo casuale in tutte le direzioni dello spazio con una velocità che dipende dalla temperatura. Nel loro moto caotico e disordinato le particelle tenderanno quindi ad occupare tutto lo spazio loro disponibile disperdendosi. Quando versiamo una goccia di inchiostro nell’acqua le particelle dell’inchiostro, muovendo dalla zone in cui sono più concentrate, si allargheranno nell’acqua circostante, dirigendosi dunque verso le zone in cui la loro concentrazione è minore; all’opposto le molecole dell’acqua tenderanno a seguire il percorso inverso. Anche se il moto di agitazione non si arresta mai, quando la concentrazione (cioè la proporzione tra soluto e solvente) è uguale in ogni punto della soluzione le molecole di soluto che si spostano in un verso saranno esattamente controbilanciate da quelle che si spostano nel verso opposto e la distribuzione del soluto e del solvente resterà costante. La diffusione è quindi un fenomeno nel quale sia il soluto, che il solvente, si spostano dalle zone nelle quali la loro presenza relativa è maggiore verso le zone in cui la loro presenza relativa è minore. Poiché la concentrazione esprime la presenza relativa del solvente, che è opposta a quella del soluto, possiamo affermare che nella diffusione il soluto si sposta dalle zone di concentrazione maggiore verso le zone di concentrazione minore, mentre il solvente fa viceversa, fino a che non si abbia la stessa concentrazione in ogni punto della soluzione. Tale fenomeno è favorito dalla temperatura.
Passiamo adesso ad analizzare una altro fenomeno che si verifica nelle soluzioni ed al quale abbiamo già accennato: la diffusione. Essa ha luogo semplicemente perché le molecole degli aeriformi e dei liquidi si muovono, come sappiamo, in modo casuale in tutte le direzioni dello spazio con una velocità che dipende dalla temperatura. Nel loro moto caotico e disordinato le particelle tenderanno quindi ad occupare tutto lo spazio loro disponibile disperdendosi. Quando versiamo una goccia di inchiostro nell’acqua le particelle dell’inchiostro, muovendo dalla zone in cui sono più concentrate, si allargheranno nell’acqua circostante, dirigendosi dunque verso le zone in cui la loro concentrazione è minore; all’opposto le molecole dell’acqua tenderanno a seguire il percorso inverso. Anche se il moto di agitazione non si arresta mai, quando la concentrazione (cioè la proporzione tra soluto e solvente) è uguale in ogni punto della soluzione le molecole di soluto che si spostano in un verso saranno esattamente controbilanciate da quelle che si spostano nel verso opposto e la distribuzione del soluto e del solvente resterà costante. La diffusione è quindi un fenomeno nel quale sia il soluto, che il solvente, si spostano dalle zone nelle quali la loro presenza relativa è maggiore verso le zone in cui la loro presenza relativa è minore. Poiché la concentrazione esprime la presenza relativa del solvente, che è opposta a quella del soluto, possiamo affermare che nella diffusione il soluto si sposta dalle zone di concentrazione maggiore verso le zone di concentrazione minore, mentre il solvente fa viceversa, fino a che non si abbia la stessa concentrazione in ogni punto della soluzione. Tale fenomeno è favorito dalla temperatura.
Esistono in commercio delle membrane che possiedono pori sufficientemente ridotti da far passare molecole di piccole dimensioni, come l’acqua, ma non molecole grosse, come quelle di molti soluti. Esse assomigliano agli involucri dei salami e si definiscono semipermeabili a causa nella selettività con cui lasciano passare o meno le molecole in base alle loro dimensioni. Immaginiamo adesso di realizzare il seguente esperimento: prendiamo una bacinella con acqua pura ed inseriamoci verticalmente un tubo, contenente una soluzione acquosa concentrata, chiuso verso il basso da una membrana semipermeabile. Seguendo le leggi della diffusione il soluto cercherà di uscire dal tubo per dirigersi verso il contenitore col solvente puro, mentre l’opposto cercherà di fare l’acqua. A causa però della membrana semipermeabile è consentito esclusivamente il movimento del solvente, mentre non può avvenire quello del soluto.
Il movimento spontaneo delle molecole di solvente da una soluzione più diluita verso una più concentrata, attraverso una membrana semipermeabile, prende il nome di osmosi. L’ingresso di acqua nel tubo farà aumentare il livello del liquido al suo interno; a questo fenomeno si oppone però la pressione dovuta al peso della colonna liquida corrispondente al dislivello creatosi. Tale pressione, che cresce proporzionalmente al dislivello, rallenta l’entrata dell’acqua, fino a bloccarla completamente, facendo raggiungere al sistema uno stato di equilibrio . Anche l’osmosi rientra tra le proprietà colligative delle soluzioni, in quanto il fenomeno è indipendente dal tipo di solvente, dipendendo solo dalla concentrazione: maggiore è infatti la concentrazione della soluzione a contatto col solvente puro, maggiore sarà l’entità del dislivello. Potremmo anche immaginare di applicare dall’esterno una pressione sul livello del tubo per impedire l’ingresso dell’acqua attraverso la membrana semipermeabile; l’entità di tale pressione sarebbe uguale a quella esercitata dal dislivello creatosi nel tubo. Si definisce pressione osmotica di una soluzione la pressione che si deve applicare ad essa, a contatto col suo solvente puro tramite una membrana semipermeabile, perché non venga diluita. La pressione osmotica si indica col simbolo p ( pi greco) e si esprime con le stesse unità di misura di tutte le pressioni. Parlando della diffusione abbiamo visto che esiste grande analogia tra il movimento delle particelle di un gas ed il moto delle molecole entro una soluzione. Tale analogia è utilizzabile anche nella trattazione dell’osmosi, in quanto si è verificato sperimentalmente che alle soluzioni può essere applicata una legge analoga a quella dei gas perfetti, definita legge della pressione osmotica, la cui formulazione è la seguente: pV=nRT, ove p è la pressione osmotica, V il volume, T la temperatura assoluto, n il numero di moli ed R la costante universale dei gas. Due soluzioni che hanno la stessa pressione osmotica si definisco isotoniche (esse hanno la stessa concentrazione); quando viceversa tra due soluzioni vi è differenza di pressione osmotica quella a pressione osmotica maggiore (perché più concentrata) si dice ipertonica, mentre quella a pressione osmotica minore (perché meno concentrata) si dice ipotonica. I fenomeni osmotici hanno grande importanza sia in campo biologico, quanto nella nostra vita quotidiana.
La solubilità
Tutti i gas risultano completamente miscibili tra loro in tutte le proporzioni. Ciò significa che è possibile mischiare quantitativi variabili di gas di qualsiasi tipo ottenendo sempre una miscela omogenea. Non altrettanto accade per le soluzioni acquose, per le quali esiste un limite alla quantità di soluto che può essere sciolta, ad una data temperatura, in una certa quantità di solvente. E’ noto infatti che, continuando ad aggiungere sale ad un certo quantitativo di acqua, ad un certo punto il soluto non si scioglie più, rimanendo allo stato solido sul fondo del recipiente. Esiste dunque un limite alla concentrazione massima di una soluzione, ad una data temperatura, se si supera la quale l'eccesso di soluto non riesce più a sciogliersi e rimane in una fase separata rispetto al resto della soluzione. Quando si raggiunge questa situazione la soluzione si dice satura: se il soluto è un solido,  l'eccesso precipita e si deposita nel recipiente come corpo di fondo; se invece il soluto è un gas, nel liquido si formano delle bollicine, che migrano verso l'altro.
l'eccesso precipita e si deposita nel recipiente come corpo di fondo; se invece il soluto è un gas, nel liquido si formano delle bollicine, che migrano verso l'altro.
Per solubilità di soluto in un dato solvente si intende la quantità massima del primo che può essere sciolta nel secondo, prima di arrivare a saturazione. Essa corrisponde quindi alla concentrazione della soluzione satura e può essere espressa come quantità (in grammi nel caso di solidi e liquidi) o come volume (in litri nel caso dei gas) di sostanza disciolta per 100 grammi di solvente o di soluzione. La solubilità in acqua delle varie sostanze dipende dalla temperatura. In particolare, all'aumentare della temperatura aumenta la solubilità dei soluti solidi; è per questo motivo che si preferisce salare, o zuccherare, i cibi e le bevande quando sono caldi, perché col calore sale e zucchero si sciolgono più facilmente. Viceversa la solubilità dei soluti gassosi diminuisce all'aumentare della temperatura, mentre aumenta all'aumentare della pressione. Anche questo fatto può essere facilmente verificato, ad esempio con le bevande gassate, che sono soluzioni acquose di anidride carbonica. In una bottiglia chiusa di acqua gassata le bolle non si vedono, perché la pressione del tappo mantiene il gas in soluzione; non appena apriamo il tappo, la pressione nel recipiente diminuisce e con essa si riduce anche la solubilità del gas, che immediatamente si separa e forma le bolle. Questo fenomeno si accentua di molto se la bottiglie è calda: in queste condizioni le bolle si formano così velocemente da far uscire il liquido dal suo contenitore. Quando una sostanza si scioglie in acqua si dice che è solubile in essa, se invece la sostanza non si scioglie si dice che è insolubile; naturalmente tra questi due estremi esistono una serie infinita di casi intermedi, per cui i vari soluti possono essere più o meno solubili in acqua.
La chimica del consumatore
Dai dati riportati sull’etichetta dell’acqua minerale “Primavera” risulta che la sua concentrazione in sodio è pari 4,87 mg/L, mentre dai dati riportati sull’etichetta dell’acqua minerale “Vitasnella” risulta che la sua concentrazione in sodio è pari allo 0.002%. Quale delle due contiene meno sodio? Per confrontare i quantitativi è necessario convertire le due concentrazioni.
4,87 mg/L significa 4,87 mg per litro di soluzione, ovvero per 1000 g di soluzione.
 Dobbiamo allora impostare la seguente proporzione:
Dobbiamo allora impostare la seguente proporzione:
4,87:1 000 000 = X:100
L’acqua “Primavera” contiene quindi lo 0,000487 % di sodio
Per passare invece dalla concentrazione percentuale a quella espressa in mg/L dobbiamo risolvere la seguente proporzione:
 0,002:100 = X:1 000 000
0,002:100 = X:1 000 000
L’acqua “Vitasnella” contiene quindi 20 mg/L di sodio
Ecco quindi svelato un piccolo mistero: se non si conosce il significato della concentrazione e non si è capaci di passare da una unità di misura all’altra si possono prendere abbagli. Siamo quindi giunti alla conclusione che bevendo un litro di acqua minerale “Vitasnella” introduciamo 20 mg di sodio, sotto forma di ioni Na+; ma questo quantitativo è tanto o poco? In altri termini ha senso preferire acque minerali a basso contenuto in sodio? Questo elemento è presente nei cibi essenzialmente quale componente del comune sale da cucina, che corrisponde al composto chimico cloruro di sodio, la cui formula, come sapete, è NaCl. Verificando i pesi atomici nella tabella periodica osserviamo che PANa= 22,99 uma e PACl= 35,45 uma. Una molecola di NaCl pesa quindi 58,44 uma. Calcoliamo adesso quanto sodio è presente percentualmente del cloruro di sodio attraverso la seguente proporzione:
 Da ciò risulta che il cloruro di sodio è costituito per il 39,34 % di sodio (il restante 60,66% è ovviamente formato da cloro).
Da ciò risulta che il cloruro di sodio è costituito per il 39,34 % di sodio (il restante 60,66% è ovviamente formato da cloro).
Vediamo adesso quanto sodio è presente in 1g (1000mg) di sale da cucina.
 In un grammo di sale da cucina ci sono quindi 393,4 mg di sodio.
In un grammo di sale da cucina ci sono quindi 393,4 mg di sodio.
Impostando e risolvendo la seguente proporzione possiamo calcolare quanti litri di acqua “Vitasnella” si debbono bere per assumere il sodio contenuto in 1g di sale da cucina: 20mg : 1L = 393,4 mg : Xl X = 19,67 litri. Consumando quindi 1g di sale da cucina si assume lo stesso quantitativo di sodio che si assumerebbe bevendo 19,67 litri di acqua “Vitasnella”.
 Formule fondamentali da utilizzare negli esercizi:
Formule fondamentali da utilizzare negli esercizi:
ESERCIZI SULLA CONCENTRAZIONE MOLARE
1) Quante moli di NaCl vi sono in 40 mL di una soluzione 2M di cloruro di sodio?
Il testo ci fornisce il volume (40 mL) e la concentrazione (2M), mentre chiede il numero delle moli. Dobbiamo quindi applicare la formula 3) [moli = volume x molarità], ricordando che 40 mL = 0,04L.
0,04L x 2 moli/L = 0,08 moli.
2) Quanti grammi di cloruro di sodio vi sono in 50 mL di una soluzione 0.4 M di NaCl?
Come nell’esercizio precedente il testo ci fornisce il volume della soluzione (50 mL) e la concentrazione (0,4 M), ma stavolta chiede il peso in grammi del soluto. Inizialmente dobbiamo ricavarci il numero delle moli, utilizzando nuovamente la formula 3), ricordando che 50 mL=0,05L.
0,05L x 0,4 moli/L = 0,02 moli.
A questo punto, per calcolare il peso totale del composto, debbo applicare la formula 5) [peso = peso molare x moli] ricordando che il peso molare di NaCl è 58,5 g.
58,5 g/moli x 0,02 moli = 1,17 g
3) Calcolare la molarità di una soluzione contenente 40 grammi di KCl in 3.500 mL di soluzione. M
Il testo ci fornisce il peso del soluto (40g) ed il volume della soluzione, chiedendone la concentrazione.
 Innanzitutto debbo ricavarmi il numero delle moli, attraverso la formula 6),
Innanzitutto debbo ricavarmi il numero delle moli, attraverso la formula 6),
ricordando che il peso molare di KCl è 74,6 g/moli.
40g : 74,6 g/moli = 0,54 moli
Ricordando che 3.500 mL = 3,5L, calcolo adesso la molarità della soluzione, utilizzando la formula 1)


4) Data una soluzione 0.5 M di HNO3, quanti mL di soluzione contengono 2 moli di acido?
In questo caso il testo ci fornisce la molarità (0,5M) e le moli (2), chiedendo quale sia il volume, espresso in millilitri. Applico quindi la formula 2)

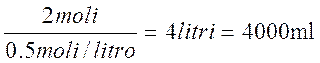
ESERCIZI SULLA MOLARITA’ 2°F
- Data una soluzione 0,9 M di nitrato di sodio, quante moli del sale sono contenute in 350 mL di essa? R:0,315
- Quante moli di acido carbonico sono contenute in 0,7 L di una soluzione 0,3 M R:0,21
- In un cilindro graduato si versano 10 cc di una soluzione 1.5 M di solfato di potassio. Quante moli di soluto sono presenti nella soluzione? R: 0.015
- Quante moli di carbonato di sodio sono contenute in 0.5 dm3 di una soluzione 0.5M? R: 0.25
- Calcolare il volume di una soluzione di ammoniaca 1.2 M che contenga 0.125 moli di soluto. R:0.104 L
- Quanti grammi di un composto del peso molare di 58,3 g/mol sono contenuti in 250 mL di una sua soluzione 0,2 M? R: 2,915 g
- Dovendo preparare 0,2 L di soluzione 0,6 molare di una sostanza di peso molare 143,4 g/mol, quanti grammi di essa è necessario impiegare? R:17,208 g
- Calcolare i grammi di un soluto di peso molecolare pari a 63 g/mol che si debbono impiegare per preparare 2 dm3 di una sua soluzione di concentrazione 12 M. R: 1512 g
- Dato un sale con peso molecolare pari a 58,5 g/mol, quanti grammi di esso vi sono in 50 cc di una sua soluzione con concentrazione 0.4 M? R: 1.16
- Calcola i grammi necessari per preparare 5L di soluzione 0,85 molare di una sostanza con peso molare pari a 331,2 g/mol. R:1407.6 g
- Prendete 159 grammi di un soluto con peso molecolare pari a 106,0 g/mol e scioglieteli in acqua, fino ad ottenere 750 mL di una soluzione. Quale concentrazione molare otteniamo? R:2 M
- Calcolate la concentrazione molare che si ottiene sciogliendo 67,05 g di un soluto con peso molare pari a 74,5 g/mol in 450 cc di soluzione. R: 2 M
- Quanti grammi di una sostanza con peso molecolare di 43 g/mol saranno sciolti in 500 cc di una sua soluzione se la concentrazione di quest’ultima è 0,1M? R: 2,15 g
- Per preparare 300 mL di soluzione 0,2M di un certo composto sono stati necessari 6 g del composto stesso. Quale è il suo peso molare? R: 100g/mole
- Dato un composto di peso molare 63 g/mol, quanti grammi di esso sono contenuti in 60 mL di in una sua soluzione di concentrazione 0,1 M? R:0,378 g
- In 0,25L di una soluzione di un sale con peso molare pari a 74,6 g/mol sono contenuti 3,73 g del sale medesimmo. Quale sarà la concentrazione della soluzione? R: 0,2M
- Sciogliendo 20 g di un composto con peso molare pari a 40 g/mol in 0,5 litri di soluzione, che concentrazione molare si ottiene? R: 1M
- Calcolare la concentrazione molare che si ottiene sciogliendo 34 g di un sale in 800 cc di soluzione. Il peso molare del sale è 85 g/mol. R: 0.5M
- Calcolare la molarità di una soluzione ottenuta sciogliendo in 400 cc di essa 45 g di un sale con peso molare pari a 69 g/mol. R: 1.5M
- In 300 cc di una soluzione sono disciolti 23.4 g di una sostanza. Quale è la sua molarità, se il peso molare del soluto è 58,5 g/mol? R:1.33
21) Quanti grammi di un composto con peso molare pari a 36,5 g/mol vi sono in 100 cc di una sua soluzione a concentrazione 10 molare? R: 36 g
I gas hanno mediamente una densità, a temperatura e pressione ambiente, di circa 10-3 g/cm3; i liquidi hanno mediamente una densità che oscilla intorno ad 1 g/cm3; mentre i solidi hanno densità che varia da un minimo di circa 2, ad un massimo di circa 20 g/cm3.
Si definisce viscosità la resistenza allo scorrimento di un liquido; liquidi molto viscosi sono ad esempio certi oli lubrificanti e certe resine.
Ovvero evapori più difficilmente dell’acqua stessa, in quanto dotato di una tensione di vapore minore di questa
A questo punto, in verità, il movimento dell’acqua non si è arrestato, ma continua attraverso la membrana in modo uguale nelle due direzioni, lasciando così inalterato il livello nel tubo
Per fase di un sistema si intende una parte di esso con caratteristiche chimiche e fisiche proprie, differenti da quelle delle parti, o fasi, circostanti. Ogni fase è distinguibile dalle altre ad occhio nudo o al microscopio.
fonte: http://www.liceodavincifi.it/_Rainbow/Documents/STATI%20FISICI%20DELLA%20MATERIA.doc
Autore: non identificabile dal documento
Stati fisici della materia
GLI STATI FISICI DELLA MATERIA
Il mondo fisico che ci circonda è costituito da materiali diversi.
Gli oggetti hanno una massa e occupano un determinato spazio ossia hanno un volume. I materiali possono esistere in tre forme diverse o meglio in tre stati fisici diversi tali stati fisici vengono anche denominati stati di aggregazione della materia.
LA MATERIA
La materia: tutto ciò che ha massa e dimensioni (occupa uno spazio) ed è soggetto alla forza di gravità.
I materiali si presentano allo stato solido, allo stato liquido e allo stato aeriforme (sotto forma di gas o di vapore).
Stato solido: le particelle costituenti la materia sono strettamente unite una all'altra in modo più o meno geometricamente ordinato. Dette particelle oscillano intorno al proprio punto di applicazione; da questo non possono, però, muoversi in quanto sono circondate da altre particelle.
Stato liquido: le particelle hanno una energia cinetica (energia di movimento) maggiore di quella dello stato solido, possono muoversi disordinatamente ed urtarsi tra loro. Minori rispetto allo stato solido sono le forze coesive, tanto che sulla superficie un certo numero di particelle, può sottrarsi del tutto all'attrazione delle altre, passando allo stato gassoso. I liquidi, infatti, esistono sempre in presenza del loro gas.
Stato aeriforme: le particelle si muovono in maniera caotica occupando tutto lo spazio a disposizione e le forze di coesione sono del tutto trascurabili. Gli aeriformi possono essere sia gas e sia vapori
GAS: stato della materia aeriforme alla temperatura e pressione ambientale (T = 25°C e Pressione = 1 atm) esempio ossigeno, metano, anidride carbonica, elio ecc..
VAPORE: stato della materia aeriforme alla temperatura e pressione diversa da quella ambientale (T = 25°C e Pressione = 1 atm) esempio vapor d’acqua, vapori di alcool etilico ecc..
Esiste un quarto stato di aggregazione, il plasma, che si ha portando un gas a temperature superiori a 5000 °C. In tale situazione uno o più elettroni esterni si staccano formando uno ione; il plasma è, quindi, formato da cationi e da elettroni in equilibrio tra loro. Le stelle sono, ad esempio, allo stato di plasma così come lo è la materia presente nei " tubi al neon ".
Il moto delle particelle diviene sempre più rapido, al crescere della temperatura, che tende a separare le molecole costituenti la materia. Fra le particelle ci sono forze di attrazione, di natura elettrostatica (fra cariche positive e negative), che si oppongono all’azione disgregatrice della temperatura. Tali forze di coesione sono particolarmente attive nei solidi, meno efficaci nei liquidi e del tutto trascurabili nei gas. Quando la temperatura è sufficientemente bassa, le forze di coesione predominano e quindi è possibile portare i gas, prima allo stato liquido e poi allo stato solido. Secondo il modello particellare, nei corpi:
La vignetta del collega Breschi rappresenta il comportamento delle particelle microscopiche nei solidi, nei liquidi e nei gas.

Il moto di atomi e molecole è tanto più intenso quanto più alta è la temperatura.
Tabella Proprietà caratteristiche dei tre stati d i aggregazione dei materiali

I corpi solidi, come le pietre, il vetro, il ghiaccio, hanno una definita massa, un volume e una forma propria.
I corpi liquidi, come l’acqua, il latte, il mercurio, hanno una massa e un volume definiti, come i solidi, ma assumono la forma della parte di recipiente che li contiene.
Infine ci sono gli aeriformi. I gas e i vapori hanno una massa propria, ma si espandono, sino ad occupare tutto il volume e ad assumere la forma del recipiente che li contiene. C’è un’altra differenza: i gas si possono comprimere, mentre i solidi e i liquidi sono, in larga misura, incomprimibili.
I PASSAGGI DI STATO
Le sostanze e i materiali possono passare, per effetto delle variazioni di temperatura o di pressione, da uno stato fisico ad un altro. Nella figura sono riportati tutti i possibili passaggi d i stato e le loro denominazioni.

Fornendo calore a un cubetto di ghiaccio (solido), alla temperatura di 0 °C, esso si trasforma in acqua (liquido). Tale passaggio da solido a liquido è chiamato fusione.
Riscaldando l’acqua si ottiene vapore d’acqua. Tale passaggio di stato dalla fase liquida a quella di vapore è chiamato evaporazione.
Alcune sostanze solide, per riscaldamento, si trasformano direttamente in vapore, senza passare per lo stato liquido. Questo processo è denominato sublimazione. Fra le sostanze che sublimano c’è la naftalina e gli altri prodotti, usati come antitarme. Anche la neve sublima. Alle basse temperature dell'alta montagna, la quantità di neve che diventa vapore, per sublimazione, è molto maggiore di quella che scorre via, passando allo stato liquido.
Comportamento opposto si ottiene, sottraendo energia termica (calore). Avvengono i passaggi di stato in senso inverso. Gli aeriformi possono trasformarsi direttamente in solidi e il fenomeno viene denominato brinamento. I gas possono pure trasformarsi in liquidi e il processo è chiamato liquefazione.
Mentre i vapori diventano liquidi attraverso un fenomeno denominato condensazione.
Infine, i liquidi, per raffreddamento, solidificano .
Bisogna però precisare che i gas non passano allo stato liquido per semplice abbassamento della temperatura. Ad essi bisogna applicare anche una consistente pressione, se si vuol raggiungere la liquefazione. Per esempio, l’aria deve essere raffreddata alla sua temperatura critica (140,8°C) e deve essere sottoposta a una pressione di circa 37,2 atmosfere (pressione critica), prima
di diventare liquida.
LA CURVA DI RISCALDAMENTO DI UNA SOSTANZA PURA
Un eccellente metodo per verificare il grado di purezza di un solido consiste nel determinare la sua temperatura di fusione, denominata anche punto di fusione della sostanza.
Poni nel freezer a 18°C un bicchiere d’acqua distillata e un termometro. Il blocco di ghiaccio col termometro, estratto dal freezer, segnerà la temperatura di 18°C.
Lascia riscaldare, a temperatura ambiente, il bicchiere contenente ghiaccio e termometro e annota le temperature.
L’ambiente esterno fornisce il calore, necessario alla prima trasformazione fisica. Riportando su un grafico le temperature, in funzione del tempo, ottieni la cosiddetta curva d i riscaldamento ,rappresentata sotto.

La temperatura cresce prima in maniera regolare, passando da 18°C a 0 °C (area celeste). Poi, quando il ghiaccio inizia a fondere, si ha un gradino sulla curva. Segno evidente che il calore, ceduto dall’ambiente, non fa aumentare la temperatura del miscuglio acqua-ghiaccio.
La temperatura, a cu i coesistono acqua distillata e ghiaccio, è denominata temperatura di fusione.
La temperatura di fusione è una proprietà intensiva (cioè non dipende dalla quantità) dell’acqua distillata e di tutte le sostanze pure.
Perché durante la fusione la temperatura non sale, pur continuando a fornire calore al sistema eterogeneo acqua-ghiaccio?
Perché il calore assorbito serve a vincere le forze di coesione del solido e lo trasforma in liquido cioè il sistema assorbe calore per rompere le forze di coesione senza far aumentare la temperatura.
Terminata la fusione di tutto il ghiaccio, la temperatura ricomincia a salire. La lunghezza del gradino, chiamata sosta termica, dipende dalla quantità di ghiaccio, che deve fondere. Maggiore è la quantità di ghiaccio, più lungo sarà il segmento BC (area verde).
Continuando a riscaldare, la temperatura sale con regolarità, sino a 100 °C (area rosa). Nell’intervallo di temperatura 0 °C ÷ 100 °C l’acqua evapora. Il vapore esercita una pressione, detta anche tensione di vapore, che è minore della pressione esterna. A 100 °C e alla pressione di 1 atmosfera inizia la produzione tumultuosa del vapore e diremo che l’acqua bolle (area viola).
La lunghezza del tratto BC (sosta termica) dipende dalla quantità d’acqua. Sino a quando l’ultima goccia d’acqua non si sarà trasformata in vapore, la temperatura non ricomincerà a salire, pur continuando a fornire calore. Se la temperatura non varia, qual è il destino del calore ceduto al corpo? Il calore viene utilizzato per vincere le forze di coesione del liquido. Nel vapore tali forze risultano molto meno intense.
Scomparso il liquido, il riscaldamento farà aumentare la temperatura del vapore in maniera regolare e la curva ricomincerà a salire. Analoghe curve, come quella disegnata per l’acqua, si hanno con tutte le altre sostanze pure. Cambiano soltanto le temperature di fusione e di ebollizione, che saranno tipiche delle diverse sostanze pure (tab. 2).

E se sottoponi a riscaldamento una soluzione acquosa di sale, che è un sistema omogeneo come l’acqua distillata, avrai una curva uguale a quella descritta sopra? No. La curva sarà diversa.
Mancheranno le soste termiche così nette della fusione e dell’ebollizione. Cioè, durante la fusione la temperatura aumenterà gradualmente, mano a mano che scompare il solido e si forma il liquido. Altrettanto accadrà per l’ebollizione. In genere, i passaggi di stato delle soluzioni e dei miscugli avvengono a temperature che non rimangono costanti, durante il passaggio di stato.
Può l’acqua bollire a una temperatura più bassa o più alta di quella a pressione atmosferica? La risposta è sì. Se si abbassa la pressione esterna, l’acqua bolle sotto i cento gradi; se, invece, si aumenta la pressione esterna, l’acqua bolle a una temperatura superiore ai cento gradi. In alta montagna, dove la pressione è inferiore a 1 atmosfera, l’acqua bolle a circa 80 °C. Per questo motivo, la pasta cotta in montagna non raggiunge livelli elevati di qualità.
La pentola a pressione consente di rendere più veloce la cottura dei cibi, innalzando la temperatura di ebollizione del miscuglio a circa 110 °C. L’innalzamento è reso possibile
dall’aumento di pressione del vapore, che preme sul liquido e ostacola la ‘’normale’’ ebollizione del miscuglio a circa cento gradi.
Qual è la differenza fra evaporazione ed ebollizione ?
Nell’evaporazione, il vapore si forma solo nello strato superficiale del liquido.
 Riguarda solo gli strati superficiali del liquido. Le particelle di un liquido sono tenute assieme da diversi legami (forze di coesione). Tali particelle non hanno tutte la stessa energia cinetica, ossia energia di movimento. Tra le particelle in prossimità del liquido esistono particelle dotate di energia cinetica sufficiente per vincere le forze di attrazione fra le particelle e riescono a sfuggire dal liquido e a passare allo stato di vapore.
Riguarda solo gli strati superficiali del liquido. Le particelle di un liquido sono tenute assieme da diversi legami (forze di coesione). Tali particelle non hanno tutte la stessa energia cinetica, ossia energia di movimento. Tra le particelle in prossimità del liquido esistono particelle dotate di energia cinetica sufficiente per vincere le forze di attrazione fra le particelle e riescono a sfuggire dal liquido e a passare allo stato di vapore.
Inizialmente sono sempre di più le particelle che passano allo stato di vapore e che occupano lo strato sovrastante al liquido, contemporaneamente però le particelle che si trovano allo stato di vapore possono urtare la superficie del liquido e ritornare allo stato liquido. Nella fase iniziale il numero di particelle che nell’unità di tempo passano allo stato di valore è maggiore al n. di partic. che dallo stato di vapore ritorno allo stato liquido. Nel tempo, se il recipiente è aperto, la velocità delle partic. a evaporare sarà sempre maggiore alla velocità delle part. a ritornare liquide. In breve il liquido sarà completamente evaporato, infatti buona parte delle particelle che evaporano sfuggono completamente dal recipiente e si disperdono nell’aria.
Prima o poi tutto il liquido evaporerà. Nel tempo, se il recipiente è chiuso il numero di particelle che evapora sarà uguale al n. delle particelle che condensano: per ogni molecola che evapora ci sarà una molecola che condensa e si parla di equilibrio dinamico. La vaporizzazione è un processo spontaneo che colpisce tutti i liquidi che evaporano a qualsiasi temperatura, non esiste dunque una temperatura precisa di vaporizzazione. Essa è accelerata dall’aumento della temperatura: l’aumento della temperatura causa un maggior movimento delle molecole. La evaporazione è favorita dall’ampiezza della superficie di contatto con l’ambiente esterno.
Anche la ventilazione favorisce l’ evaporazione perché sposta le molecole già evaporate che così non ristagnano sulla superficie di evaporazione e non urtano le molecole del liquido così non tornano allo stato liquido. L’aria al di sopra di un liquido rallenta l’evaporazione, in assenza di aria l’evap. avviene più velocemente. Le particelle allo stato di vapore esercitano una pressione sulla superficie del liquido sottostante: si parla di tensione o pressione di vapore saturo, ed è la pressione esercitata in condizioni di equilibrio dalle particelle allo stato di vapore sul liquido.
Nell’ebollizione, le bolle di vapore si formano all’interno e in fondo al liquido e non solo in superficie.
La temperatura, a cu i la pressione del vapore eguaglia la pressione esterna, è detta temperatura di ebollizione oppure punto d i ebollizione del liquido puro esaminato.
Il punto di ebollizione è un’altra proprietà intensiva dell’acqua e di tutte le altre sostanze pure, allo stato liquido. La temperatura di ebollizione dell’acqua è sempre la stessa e non dipende dalla quantità d’acqua (una goccia, un litro, o più). Ciascuna sostanza pura si distingue da un’altra sostanza pura, per il diverso valore della temperatura di fusione e della temperatura di ebollizione.
I CALORI LATENTI DI FUSIONE E DI VAPORIZZAZIONE
L’energia termica, scambiata durante i passaggi di stato, di fusione e di ebollizione, è chiamato calore latente, perché non comporta aumenti o diminuzioni di temperatura. È un calore che non si vede (dal latino latere, cioè nascondere), ma serve a indebolire le forze di coesione di solidi e liquidi. Il calore da fornire a 1 grammo di ghiaccio, per farlo fondere, è più di sei volte inferiore al calore richiesto dalla vaporizzazione di 1 grammo d’acqua. Tale differenza dipende dal fatto che è più difficile vincere le forze di coesione di un liquido, che diventa vapore, che ridurre le forze di coesione di un solido.
PASSAGGI DI STATO E PRESSIONE
La temperatura di fusione e la temperatura di ebollizione di una sostanza sono condizionate dall’entità della pressione esterna. Prima di spiegare questo aspetto, si deve chiarire un punto importante: il passaggio dallo stato solido allo stato liquido di un corpo comporta sempre un aumento di volume, ad eccezione dell’acqua e di pochi altri materiali, per i quali il volume diminuisce con la fusione.
La riduzione della pressione esterna rende più facile l’ebollizione delle sostanze.
La fusione e la solidificazione sono poco influenzate dalle variazioni esterne della pressione.
Perché? La pressione si può immaginare come qualcosa che prema sui solidi e sui liquidi. Quando il liquido si trasforma in vapore, deve aumentare di molto il proprio volume (di circa mille volte).
Una pressione esterna elevata contrasta questa espansione e l'ebollizione si avrà a temperatura più alta. Invece, la riduzione di pressione favorisce l’espansione e fa abbassare il punto di ebollizione .
Nel passaggio da solido a liquido, l'aumento di volume è molto piccolo e quindi non viene ostacolato dalla pressione elevata. Per l'acqua, una delle poche eccezioni, la pressione elevata favorisce leggermente la fusione, poiché nella trasformazione il suo volume si riduce. Pertanto l'acqua, sottoposta a pressione elevata, solidifica a temperatura leggermente inferiore a 0 °C. La pressione necessaria per far solidificare il ghiaccio a 1 °C è di 133 atmosfere. Un pattinatore di 70 kg, che prema sul ghiaccio con una superficie della lamina di appena 0,5 cm 2 raggiunge questa pressione.
SISTEMI OMOGENEI E SISTEMI ETEROGENEI
I materiali possono essere classificati anche come omogenei e come eterogenei. Esamina l’acqua contenuta in un bicchiere. Questa porzione di materia, cioè questo sistema, è un esempio di materia omogenea. L’omogeneità deriva dal fatto che il sistema acqua è visibilmente uniforme.
Ogni piccola porzione, dell’acqua contenuta nel bicchiere, avrà lo stesso colore e la stessa densità la stessa temperatura di ebollizione di qualsiasi altra porzione. Queste proprietà sono chiamate proprietà intensive . Siccome tutte le regioni, dentro l’acqua, hanno le stesse proprietà intensive, e non sono distinguibili l’una dall’altra, dirai che il corpo è omogeneo o meglio il sistema è omogeneo.
Supponi di versare nel bicchiere anche alcuni cucchiai d’olio di oliva. Siccome l’olio è un liquido che non si scioglie in acqua, ti aspetterai di vedere due strati liquidi: l’acqua sotto e sopra l’olio
Tale visibile non uniforme porzione di materia è chiamata sistema eterogeneo . Quante serie di proprietà intensive si possono scrivere per i due liquidi nel bicchiere ? Avrai la serie delle proprietà intensive dell’acqua (colore, densità, ecc...) e quella dell’olio (colore, densità, ecc..). Il liquido nel bicchiere sarà costituito da due distinte fasi liquide, e ciascuna avrà la propria serie di proprietà
intensive. Alla luce di quanto descritto, come definisci la fase ?
Si dice fase una porzione di materia, fisicamente distinguibile, che ha uniformi proprietà intensive ( colore, densità, temperatura di ebollizione ecc ...) .
Le fasi sono porzioni di materiali omogenei, cioè sono sistemi omogenei, fisicamente distinguibili perché delimitati da un contorno esterno, ben definito e visibile.
Riassumendo: un sistema può essere omogeneo oppure eterogeneo, a seconda che sia costituito da una sola fase oppure da due o più fasi.
SOSTANZE PURE E MISCUGLI
I materiali possono anche essere suddivisi in due distinte categorie: le sostanze pure e i miscugli.
Sia le sostanze pure che i miscugli possono essere omogenei ed eterogenei.
La sostanza pura
Secondo il linguaggio comune l’acqua potabile e l’acqua minerale sono pure. Altrettanto puri sono il latte e l’aria, che respiriamo in alta montagna. Quindi la parola purezza, nel linguaggio comune è sinonimo di "non contaminato". Un significato più preciso assume in chimica l’aggettivo puro.
Quando il chimico afferma che un corpo è puro vuol dire soltanto che l’oggetto indicato è formato da una sola sostanza. Quindi, passando alla definizione:
un sistema è puro solo se formato da una singola sostanza, la quale possiede proprietà caratteristiche e ha un a composizione costante.
L’acqua distillata è pura perché è acqua al 100% . Mentre non è pura l’acqua di rubinetto, perché in essa ci sono disciolte altre sostanze. Difatti, se lasci evaporare l’acqua potabile, troverai nel contenitore un residuo bianco. Anche l’aria di montagna e il latte non sono puri, da un punto di vista chimico, bensì sono costituiti da sostanze diverse.
Ma anche il concetto di purezza chimica si presta a qualche riflessione critica. L’idea di sostanza pura è un’astrazione, giacché tutte le sostanze reali sono più o meno impure. E allora come si denomina una porzione di materia che non è completamente pura ?
Il termine materiale sembra il più adatto a questo scopo. Se non si è sicuri della purezza della materia che compone un oggetto, un corpo o un sistema, è preferibile usare la parola materiale per indicarlo e non la parola sostanza. I materiali possono essere costituiti da sostanze pure oppure da miscugli di sostanze diverse.
C’è pure da dire che le impurezze non sono sempre indesiderabili e dannose. Per esempio, il silicio, un materiale semiconduttore usato nei circuiti elettronici, è considerato una delle sostanze più pure. Il silicio è puro per il 99,9999%. Le sue straordinarie proprietà, utilizzate in campo elettronico, sono dovute proprio alle impurezze che il silicio contiene.
I miscugli omogenei e i miscugli eterogenei
I sistemi che esaminerai possono essere costituiti da una sola sostanza oppure da più sostanze.
Un sistema formato da una sola sostanza pura può essere omogeneo oppure fisicamente eterogeneo. Per esempio, l’acqua distillata purissima, allo stato liquido, costituisce un esempio di sistema omogeneo. A 0 °C l’acqua distillata pura si trova in parte in fase solida (ghiaccio) e in parte in fase liquida, pertanto il sistema è fisicamente eterogeneo. Anche se costituito da una sola sostanza pura, si tratta di un sistema formato da due fasi e quindi sicuramente eterogeneo. I 15 milioni di sostanze pure, sino ad oggi conosciute, si comportano alla stessa maniera dell’acqua, quando si trovano alle rispettive temperature di fusione.
Più semplice risulta definire i sistemi costituiti da due o più sostanze. A tali sistemi diamo il nome di miscugli o di miscele . Pure i miscugli possono essere omogenei ed eterogenei.
Se prendi del sale e lo sciogli completamente in acqua, avrai un miscuglio omogeneo. I grani di sale non saranno più visibili, neanche al microscopio, e otterrai una singola fase. Tutte le zone del miscuglio avranno le stesse proprietà intensive (colore, densità, ecc..). Anche acqua e alcol formano un miscuglio omogeneo. A tali miscugli omogenei darai il nome di soluzione alla quale
compete la seguente definizione.
Un miscuglio omogeneo d i due o più sostanze è chiamato soluzione. Il materiale più abbondante del miscuglio è il solventementre i materiali meno abbondanti si chiamano soluti.
Ci sono anche i miscugli eterogenei di due o più sostanze. Nei miscugli eterogenei le differenti parti (fasi) sono visibili al microscopio o addirittura a occhio nudo, come i minerali costituenti il granito. Come si definisce un miscuglio eterogeneo ?
Un miscuglio eterogeneo è costituito da componenti chimicamente definiti e da fasi fisicamente distinguibili.
La maggior parte dei materiali, che conosci, non sono sostanze singole, ma miscugli, più o meno complessi, di sostanze diverse. L’aria che respiri è un miscuglio omogeneo di azoto, di ossigeno e di altri gas, in percentuale minore.
Il latte è un classico esempio di miscuglio eterogeneo. Apparentemente il suo aspetto è uniforme; l’osservazione al microscopio, invece, rivela l’esistenza di minuscole goccioline di grasso, immerse in un liquido trasparente. Il fatto che il latte sia opaco dimostra la sua eterogeneità.
Le soluzioni non sono soltanto liquide, come acqua e sale oppure acqua e zucchero. Si conoscono soluzioni gassose, come l’aria che respiri. Ci sono pure le soluzioni solide, come l’acciaio, il bronzo e le altre leghe metalliche.
Nebbia, fumo, schiuma ed emulsione sono miscugli eterogenei
Comincia a definire i miscugli eterogenei gas liquido.
La schiuma è un tipico miscuglio costituito dalla dispersione di un gas in un liquido. Una soluzione saponosa si trasforma in schiuma, insufflando aria con una cannuccia. Il bianco d’uovo sbattuto incorpora un certa quantità d’aria e
si ottiene una schiuma.
La nebbia è formata da minuscole goccioline d’acqua disperse e sospese nell’aria. Anche le nubi sono un miscuglio eterogeneo acquaaria.
Infine, il fumo è un miscuglio eterogeneo di un solido in un gas. Il fumo dei camini è costituito, in buona parte, da particelle finissime di carbone disperse in aria. L’emulsione è un miscuglio eterogeneo tra due o più liquidi immiscibili . L’emulsione si ottiene agitando energicamente i liquidi immiscibili, in maniera da ottenere la formazione di minuscole goccioline, difficilmente separabili. La maionese è un esempio di emulsione, ottenuta agitando olio e tuorlo d’uovo.
Il sol è un miscuglio eterogeneo di un liquido disperso in un gas
I COLLOIDI SON O SPECIALI MISCUGLI
La distinzione fra miscugli omogenei e miscugli eterogenei non è netta. C’è una classe di materiali che si colloca a mezza strada fra i miscugli omogenei e quelli eterogenei. A questa classe appartengono i colloidi, che sono considerati ‘’pseudosoluzioni’’, in quanto, a un esame superficiale, appaiono come miscugli omogenei. In realtà, i colloidi sono sospensioni di grandi particelle (20.000 ÷ 100.000 nanometri di diametro) in un solvente. Differiscono dalle soluzioni,
perché le particelle sospese sono abbastanza grandi da diffondere la luce. Se la fase disperdente, liquida o gassosa, prevale su quella solida (fase dispersa), si ha un sol. Se, invece, prevale la fase solida si ha un gel. Sono colloidi alcuni componenti del citoplasma delle cellule, dell’albume dell’uovo, della gelatina, del budino, delle caramelle gommose, maionese, ecc. Quando i colloidi solidificano si ottiene una massa compatta.
Fonte: http://www.liceocottini.it/documenti/FAD/chimica/2_Gli%20stati%20fisici%20della%20materia.doc
Autore: non identificabile dal documento
Stati fisici della materia
Visita la nostra pagina principale
Stati fisici della materia
Termini d' uso e privacy