Celle galvaniche o pile
Celle galvaniche o pile
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Celle galvaniche o pile
Dunque le celle galvaniche sono dei dispositivi in grado di sfruttare reazioni redox spontanee per trasformare energia chimica in energia elettrica.
Una pila è costituita da due semicelle in cui vengono fatte avvenire separatamente le reazioni di ossidazione e di riduzione.
Consideriamo ad esempio il seguente processo spontaneo di ossidoriduzione
Zn + Cu2+ Zn2+ + Cu
dove lo zinco metallico si ossida in ione zinco perdendo due elettroni secondo la seguente semireazione
Zn Zn2+ + 2e-
e lo ione rame si riduce a rame metallico acquistando due elettroni secondo la seguente semireazione
Cu2+ + 2e- Cu
Se vogliamo costruire una pila che si basi su tale reazione è necessario separare le due semireazioni. In ciascuna semicella dovrà dunque essere posto uno dei due metalli in equilibrio con il proprio catione.
La semicella che contiene lo zinco verrà indicata come Zn/Zn2+
La semicella che contiene il rame come Cu2+/Cu.
Le specie chimiche che partecipano alla reazione in ciascuna semicella sono dette coppie redox. Ciascuna coppia redox viene sempre convenzionalmente scritta nel senso della reazione di riduzione.
Una pila che utilizza proprio la reazione di ossidoriduzione tra rame e zinco è la pila Daniell.
Le coppie redox utilizzate nella pila Daniell sono Cu2+/Cu e Zn2+/Zn.
Nella pila Daniell una barretta di zinco metallico viene immersa in una soluzione di solfato di zinco che, dissociandosi completamente, fornisce gli ioni Zn2+, mentre una barretta di rame metallico viene immersa in una soluzione di solfato rameico che fornisce gli ioni Cu2+.
In questo caso particolare le due barrette metalliche fungono anche da elettrodi, cioè da supporto per il passaggio degli elettroni da una semicella all'altra quando avviene la reazione. In altre pile, dove le specie chimiche che reagiscono non sono conduttrici, è necessario utilizzare elettrodi inerti (che non partecipano alla reazione) per consentire agli elettroni di muoversi.
Spesso il termine elettrodo viene utilizzato per indicare l'intera semicella.
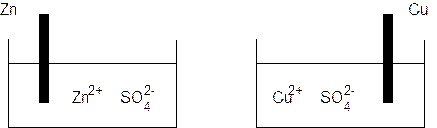
Finchè le due semicelle rimangono separate non si osserva naturalmente alcuna reazione. Ma se colleghiamo con un filo metallico i due elettrodi, lo Zinco, che ha una maggiore tendenza ad ossidarsi rispetto al Rame, perde elettroni. Gli elettroni, passando attraverso il conduttore metallico, vengono attirati dagli ioni rameici che li acquistano e si riducono.
In tal modo dello zinco metallico si ossida e passa in soluzione sotto forma di ione Zn2+ (lo ione zinco è solubile). La soluzione di solfato di zinco si arricchisce di ioni Zn2+ mentre l'elettrodo di Zinco si assottiglia.
Nell'altra semicella invece gli ioni rameici a contatto con l'elettrodo si riducono a rame metallico aderendo all'elettrodo stesso. La soluzione si impoverisce di ioni Cu2+ mentre l'elettrodo aumenta di peso.
Convenzionalmente l'elettrodo al quale avviene la reazione di ossidazione è detto Anodo, mentre quello al quale avviene la reazione di riduzione è detto Catodo.
Poichè in tal caso gli elettroni si muovono dall'anodo al catodo, l'anodo risulta essere l'elettrodo negativo, mentre il catodo è positivo.

Poichè mentre la reazione procede la soluzione di solfato di zinco tende ad arricchirsi di ioni positivi (Zn2+), mentre la soluzione di solfato rameico tende ad impoverirsi di ioni positivi (Cu2+), le due semicelle perdono la loro elettroneutralità.
La semicella anodica tende a caricarsi positivamente [Zn2+] > [SO42-], mentre la semicella catodica tende a caricarsi negativamente [Cu2+] < [SO42-].
In queste condizioni il passaggio di corrente elettrica si esaurirebbe ben presto, in quanto gli elettroni (negativi) dovrebbero allontanarsi da una soluzione positiva, che li attrae, per andare verso una soluzione negativa, che li respinge.
La perdita progressiva dell'elettroneutralità da parte delle due semicelle diventa perciò responsabile di un potenziale elettrico che agisce in senso contrario a quello originario. Quando l'intensità dei due potenziali assume lo stesso valore assoluto, la corrente cessa.
Per ovviare a tale inconveniente è quindi necessario garantire l'elettroneutralità delle due soluzioni. Per questo motivo le soluzioni vengono collegate con un dispositivo, detto ponte salino, che fornisce loro ioni di segno opposto.
Un esempio di ponte salino potrebbe essere un tubo contenente una soluzione molto concentrata di un elettrolita forte (ad esempio un sale), i cui ioni non interferiscano chimicamente con le reazioni in corso. Le due estremità del tubo vengono immerse nelle semicelle ed occluse con materiale filtrante in modo che gli ioni di carica opposta possano diffondere lentamente.
Se ad esempio utilizziamo un generico sale BA, in grado di dissociarsi in ioni B+ e A-, gli ioni B+ diffonderanno nella soluzione catodica, mentre gli ioni A- in quella anodica, garantendo l'elettroneutralità.

Il ponte salino può essere sostituito da un setto poroso che divida le due soluzioni (ad esempio porcellano non verniciata) e permetta all'eccesso relativo di ioni SO42- di diffondere verso la soluzione positiva e agli ioni Zn2+ in eccesso di migrare verso la soluzione negativa.

In generale una pila viene schematizzata, scrivendo per prima la reazione anodica come segue
Zn / Zn2+ // Cu2+ / Cu
ANODO PONTE CATODO
dove
Zn / Zn2+ rappresenta la semicella anodica (ossidazione)
// è il simbolo del ponte salino
Cu2+ / Cu rappresenta la semicella catodica (riduzione)
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Celle galvaniche o pile tipo file : doc
Celle galvaniche o pile
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Celle galvaniche o pile utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Celle galvaniche o pile
Termini d' uso e privacy