Energia interna E
Energia interna E
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Energia interna E
L'energia posseduta da un sistema viene definita Energia interna (E).
L'energia interna di un sistema dipende esclusivamente dalla pressione, dalla temperatura, dal volume e dalla composizione chimica del sistema (tipo ed intensità delle interazioni tra particelle costituenti).
Per questo motivo l'energia interna è una funzione di stato. Il suo valore dipende cioè dallo stato termodinamico del sistema e non dal modo in cui tale condizione è stata raggiunta.
L'energia interna di 100 g di acqua a 25°c e 1 atm è la medesima che l'acqua sia stata ottenuta per condensazione di 100 g di vapore, per reazione tra idrogeno ed ossigeno o per liquefazione di 100 g di ghiaccio.
Inoltre l'energia interna è una proprietà estensiva, è cioè proporzionale alla quantità di materia presente nel sistema.
100 g di acqua a 25°C e 1 atm possiedono un'energia interna doppia rispetto a 50 g di acqua nelle stesse condizioni termodinamiche.
L'energia interna di un sistema chimico è uguale alla somma dell'energia cinetica e dell'energia potenziale di tutte le molecole che formano il sistema.
E = (Ec + Ep)
L'energia cinetica di un corpo (Ec) è la capacità di compiere lavoro per effetto del suo moto. Essa dipende dalla massa m e dalla velocità v ed è pari a
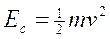
Nel caso di un sistema di molecole l'energia cinetica non è in realtà legata solo al movimento di traslazione, ma vi sono altri contributi connessi con i moti di rotazione e di vibrazione interna delle singole particelle.
La meccanica statistica ci insegna che il valore medio dell'energia cinetica di un sistema di particelle è legato alla temperatura del sistema dalla relazione
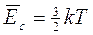
L'energia potenziale di un corpo è la sua capacità di compiere lavoro per effetto della sua posizione o dello stato in cui si trova.
Nel caso di un sistema di particelle l'energia potenziale viene comunemente definita energia chimica o di legame e presenta due componenti fondamentali. Una legata alla posizione reciproca delle molecole il cui valore dipende dalle forze attrattive intermolecolari (forze di Van der Waals), l'altra che dipende dalla posizione reciproca assunta dai protoni e dagli elettroni all'interno degli atomi e dalle interazioni elettromagnetiche che si producono tra le loro cariche.
Quando effettuiamo un lavoro per allontanare due corpi che si attraggono (come accade tra molecole o tra elettroni e nuclei) allora l'energia potenziale del sistema aumenta e le forze di attrazione tra i corpi diminuiscono.
Al contrario quando lasciamo che due corpi che si attraggono si avvicinino l'energia potenziale diminuisce e le forze di attrazione tra i corpi aumentano.
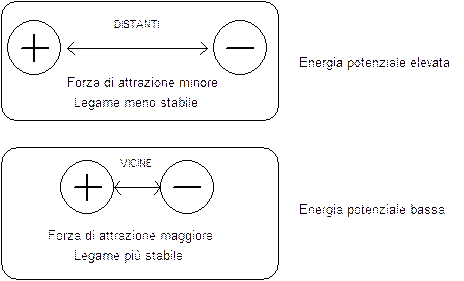
Le reazioni chimiche sono sempre accompagnate da modificazioni energetiche in cui l'energia potenziale varia a causa delle modificazioni delle posizioni reciproche di atomi e di elettroni che si riassestano per occupare nuove posizioni nelle molecole dei prodotti di reazione.
In altre parole ogni reazione chimica avviene grazie alla rottura ed alla formazione di legami che modificano l'intensità delle forze all'interno delle molecole e tra le molecole, andando a modificare l'energia potenziale del sistema.
Se i nuovi legami che si formano sono più deboli il sistema presenta un'energia potenziale maggiore rispetto a quella che caratterizzava nel complesso le molecole dei reagenti.
Se al contrario i nuovi legami che si formano sono più forti il sistema presenta un'energia potenziale minore rispetto a quella che caratterizzava nel complesso le molecole dei reagenti.
Se il sistema è isolato e non può quindi scambiare energia con l'ambiente esterno la reazione avviene grazie alla conversione di parte dell'energia interna da cinetica in potenziale o viceversa (trasformazione adiabatica).
In altre parole una reazione in un sistema isolato trasforma sempre parte dell'energia cinetica delle molecole (energia termica) in energia potenziale (energia chimica di legame) ed il sistema si raffredda, o, viceversa, trasforma parte dell'energia di legame in energia termica ed il sistema si riscalda.
Tale affermazione è una conseguenza del primo principio della termodinamica che afferma che l'energia non si può né distruggere né creare, ma può solo essere convertita da una forma in un'altra.
Se invece il sistema può scambiare energia con l'intorno, il primo principio della termodinamica ci informa che la quantità di energia che il sistema scambia con l'ambiente esterno è esattamente pari alla sua variazione di energia interna.
In altre parole l'energia totale dell'universo (sistema + ambiente esterno) rimane sempre costante.
In realtà non è possibile calcolare l'energia interna di un sistema, ma solo le variazioni di energia che caratterizzano due stati diversi di un sistema (ciò è dovuto al fatto che parte dell'energia interna di un sistema è costituita da energia potenziale di cui, come sappiamo, non è possibile determinare un valore assoluto).
Se ad esempio un sistema chimico reagisce trasformando dei reagenti in prodotti di reazione, noi siamo in grado di misurare solo la variazione di energia interna E che si verifica durante la reazione, espressa come differenza tra l'energia interna dei prodotti di reazione (energia interna dello stato finale, Ef) e l'energia interna dei reagenti (energia interna dello stato iniziale, Ei)
E = Ef - Ei
Non ci è invece possibile misurare i valori assoluti di Ef ed Ei.
In un sistema isolato E = 0 e la reazione avviene per conversione interna di una forma di energia in un'altra (cinetica in potenziale, o viceversa).
Nella maggior parte delle reazioni chimiche il sistema è in grado di scambiare energia con l'ambiente, per cui E 0.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Energia interna E tipo file : doc
Energia interna E
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Energia interna E utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Energia interna E
Termini d' uso e privacy