Energia libera e sistemi all'equilibrio
Energia libera e sistemi all'equilibrio
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Energia libera e sistemi all'equilibrio
Calcoliamo la variazione di Energia libera per il processo di solidificazione dell'acqua a 0°C
H2O(l) H2O(s)
sapendo che l'entropia dell'acqua e del ghiaccio a 0°C sono rispettivamente pari a 65,2 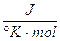 (i liquidi sono più disordinati dei solidi) e che il processo è esotermico (H = - 6,00 kJ/mol), poiché durante la solidificazione
(i liquidi sono più disordinati dei solidi) e che il processo è esotermico (H = - 6,00 kJ/mol), poiché durante la solidificazione
viene rilasciato il calore latente.
La variazione di Entropia durante il processo di solidificazione sarà pari a
S = 65,2 - 43,2 = 22,0 J/°K
La variazione di Energia libera sarà
Ciò significa che l'aumento di disordine dell'ambiente che si produce durante il processo di congelamento (a causa della dissipazione di calore) viene esattamente controbilanciato dall'aumento di ordine del sistema. In altre parole a 0°C il sistema non presenta alcuna tendenza, né verso la fase solida, né verso la fase liquida. L'indifferenza del sistema si traduce in uno stato di equilibrio tra liquido e solido.
In effetti ciò è esattamente quello che accade. A 0°C l'acqua non ghiaccia, ma vi è equilibrio tra la fase liquida e la fase solida.
Possiamo allora affermare che in generale un sistema raggiunge uno stato di equilibrio quando la variazione di Energia libera si annulla. In questo stato l'entropia dell'universo rimane costante ed il sistema non evolve spontaneamente in alcuna direzione.
E' allora evidente che il valore di G° di una reazione chimica deve essere in relazione allo stato di equilibrio che il sistema può raggiungere. In particolare in chimica le condizioni di equilibrio di un sistema vengono descritte tramite opportune costanti di equilibrio (kc, kp, ka, kb, kps, kw etc). Deve allora esistere una relazione che colleghi il G° di una reazione chimica alla relativa costante di equilibrio K.
Il G° di una sostanza è calcolato in condizioni standard (25°C, pressione parziale di 1 atm, concentrazione 1M). Si può dimostrare che il G in condizioni diverse da quelle standard varia con la concentrazione (o la pressione parziale per le sostanze gassose). Per una generica sostanza A la relazione è la seguente
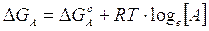
Per una generica reazione del tipo
aA + bB cC + dD
La variazione di Energia libera in condizioni non standard vale
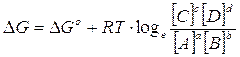
E' facile verificare che, se la reazione era spontanea e quindi con un G° negativo, man mano che i reagenti si trasformano nei prodotti di reazione il rapporto delle loro concentrazioni aumenta fino al punto in cui il G della reazione non si azzera.
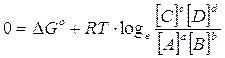
In queste condizioni ( G = 0) il sistema non presenta alcuna tendenza ad evolvere ne' verso i reagenti, ne' verso i prodotti di reazione. Il sistema ha raggiunto l'equilibrio ed il rapporto delle concentrazioni di equilibrio è proprio la costante di equilibrio K della reazione.
Potremo allora scrivere, per lo stato di equilibrio
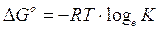
che rappresenta la relazione cercata tra G° e K. Tale relazione può essere ottenuta per qualsiasi costante di equilibrio.
Calcoliamo ad esempio il prodotto di solubilità kps dello ioduro di argento AgI, sapendo che i G° di formazione delle specie chimiche interessate all'equilibrio sono
G° AgI(s) = - 66,19 kJ/mol
G° Ag+(aq) = +77,11 kJ/mol
G° I-(aq) = - 51,57 kJ/mol
AgI(s) Ag+(aq) + I-(aq)
G° = (G°prodotti) - (G°reagenti) = [(+ 77,11) + (- 51,57)] - (- 66,19) = + 91,73 kJ
Calcoliamo ora la kps
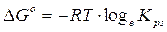
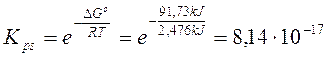
Calcoli analoghi possono essere fatti per tutte le altre costanti di equilibrio. A titolo di esempio calcoliamo la tensione di vapore dell'acqua a 25°C e la kb dell'ammoniaca.
1) Calcolare la costante di equilibrio kp dell'equilibrio di evaporazione dell'acqua
H2O(l) H20(g)
sapendo che il G° dell'acqua liquida e del vapor d'acqua vale rispettivamente - 237,13 kJ/mol e -228,57 kJ/mol.
G° = (G°prodotti) - (G°reagenti) = (-228,57) - (- 237,13) = + 8,56 kJ
Calcoliamo ora la kp
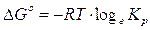
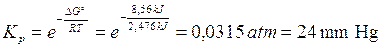
Poichè la concentrazione dell'acqua liquida viene considerata costante, la kp di tale trasformazione coincide con la pressione parziale della fase gassosa e quindi con la tensione di vapor d'acqua a 25°C.
2) Calcoliamo ora la kappa basica kb dell'ammoniaca NH3, sapendo che i G° di formazione delle specie chimiche interessate all'equilibrio sono
G° NH3(aq) = - 26,5 kJ/mol
G° H2O(l) = - 237,13 kJ/mol
G° NH4+(aq) = - 79,31 kJ/mol
G° OH-(aq) = - 157,24 kJ/mol
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
G° = (G°prodotti) - (G°reagenti) = [(- 79,31) + (- 157,24)] - [(- 26,5) + (- 237,13)] = +27,08 kJ
Calcoliamo ora la kb
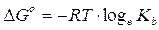

Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Energia libera e sistemi all'equilibrio tipo file : doc
Energia libera e sistemi all'equilibrio
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Energia libera e sistemi all'equilibrio utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Energia libera e sistemi all'equilibrio
Termini d' uso e privacy