Equilibri chimici omogenei ed eterogenei
Equilibri chimici omogenei ed eterogenei
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Equilibri chimici omogenei ed eterogenei
Si parla di equilibri in fase omogenea quando tutte le specie chimiche coinvolte nella reazione sono presenti in un'unica fase. Si definisce fase una porzione omogenea di un sistema, delimitata da una superficie di separazione fisicamente definita. Così ad esempio del ghiaccio in acqua liquida costituisce un sistema bifasico, mentre una soluzione è un sistema in fase unica. Sono tipicamente omogenei gli equilibri che decorrono in fase gassosa e quelli in soluzione.
Si parla invece di equilibri in fase eterogenea quando almeno una delle specie chimiche coinvolte nella reazione si trova in una fase diversa dalle altre. In tal caso risulta conveniente far comparire nella relazione di equilibrio solo le concentrazioni delle specie chimiche le cui concentrazioni possono variare in funzione delle condizioni sperimentali (in pratica le specie chimiche allo stato gassoso e i soluti).
Si tenga infatti presente che la concentrazione di un solido o un liquido allo stato puro è una costante.
Proviamo ad esempio a calcolare la molarità di un campione di ferro del peso di 50 g sapendo che la densità del ferro è pari a 7860 g/dm3 ed il suo peso molare è pari a 55,85 g/mol.

Come si può osservare la molarità è indipendente dal peso (W) del campione considerato. Infatti al crescere del peso del campione crescono proporzionalmente sia il numero di moli che il volume, in modo che il loro rapporto rimane comunque costante.
Tenendo conto di quanto detto, si è convenuto che, qualora in un equilibrio eterogeneo la concentrazione di una specie chimica risulti costante, essa vada inglobata nella costante di equilibrio.
Se ad esempio facciamo reagire della polvere di grafite solida, con dell'ossigeno gassoso per ottenere dell'ossido di carbonio, secondo la reazione
La relazione di equilibrio risulta essere

poichè però la concentrazione del carbonio solido è una costante si avrà

ESEMPIO
A 1200°K il carbonato di calcio si decompone in ossido di calcio e anidride carbonica con una kp = 4,5. Dopo aver introdotto 80 g di carbonato in un recipiente di 10 l a 1200°K , calcolare la pressione prodotta dall'anidride carbonica e la massa indecomposta del carbonato all'equilibrio.
Tenendo conto che sia il carbonato che l'ossido di calcio sono solidi, la relazione di equilibrio sarà
La pressione esercitata dall'anidride carbonica all'equilibrio è dunque di 4,5 atm
Calcoliamo ora quante moli di anidride carbonica devono essere presenti in un recipiente di 10 litri a 1200°K per produrre una pressione di 4,5 atmosfere.

poichè ciascuna mole di carbonato che reagisce produce 1 mole di ossido ed 1 di anidride, possiamo dedurre che, se si sono formate 0,46 moli di CO2, si devono essere decomposte altrettante moli di carbonato.
Poichè il peso molare del carbonato di calcio è di 100 g/mol, siamo in grado di calcolare quanti grammi di carbonato hanno reagito
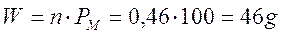
Rimarranno dunque indecomposti, una volta raggiunto l'equilibrio, (80 - 46) = 34 grammi di carbonato di calcio.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Equilibri chimici omogenei ed eterogenei tipo file : doc
Equilibri chimici omogenei ed eterogenei
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Equilibri chimici omogenei ed eterogenei utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Equilibri chimici omogenei ed eterogenei
Termini d' uso e privacy