Indicatori di pH
Indicatori di pH
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Indicatori di pH
Il pH di una soluzione viene normalmente misurato tramite uno strumento detto piaccametro. Per ottenere una indicazione qualitativa del pH di una soluzione si usano particolari sostanze chimiche dette indicatori.
Un indicatore è generalmente costituito da un acido o da una base debole che assume un colore diverso in relazione al pH della soluzione.
Il valore del pH in corrispondenza del quale un indicatore cambia colore è detto pH di viraggio.
Usando un indicatore unico non è quindi possibile sapere qual è il pH di una soluzione, ma solo se la soluzione presenta un pH superiore o inferiore al pH di viraggio di quell'indicatore.
Per conoscere il valore approssimato del pH di una soluzione è necessario utilizzare una striscia di carta impregnata con più indicatori (indicatore universale), che assume diversi colori a seconda del pH.
In realtà ciascun indicatore vira (cambia colore) in corrispondenza di un intervallo di pH (ad esempio tra pH 3,2 e pH 4,5), necessario affinché l'occhio possa apprezzare il cambiamento di colore.
Se indichiamo con HIn un generico indicatore costituito da un acido debole, il suo equilibrio di dissociazione sarà
HIn H+ + In-
La capacità dell'indicatore di assumere due diversi colori è legata al fatto che la forma indissociata HIn presenta un colore diverso dell'anione In-.
L'equilibrio dell'indicatore si sposta per il principio di Le Chatelier verso destra o verso sinistra, facendo prevalere una delle due forme colorate sull'altra, a seconda che esso si trovi in presenza di una soluzione basica o acida.
Infatti se aumentiamo la [H+] l'equilibrio dell'indicatore tende a spostarsi verso sinistra e prevale HIn, mentre se diminuiamo la [H+] l'equilibrio si sposta verso destra e prevale In-.
Così se l'indicatore viene posto in una soluzione acida, parte degli ioni H+ presenti in soluzione reagiscono con gli ioni In- per ridare la forma indissociata HIn e l'equilibrio dell'indicatore si sposta verso sinistra.
Mentre se l'indicatore viene posto in una soluzione basica, parte degli ioni OH- presenti in soluzione si associano con gli ioni H+ provenienti dalla dissociazione dell'indicatore per formare H2O indissociata (l'equilibrio di dissociazione dell'acqua è infatti molto spostato verso sinistra) . La diminuzione degli ioni H+ costringe l'indicatore a dissociarsi ulteriormente ed il suo equilibrio si sposta verso destra.
Naturalmente il punto di viraggio viene raggiunto quando la concentrazione della specie indissociata HIn eguaglia la concentrazione dell'anione In-.
punto di viraggio [HIn] = [In-]
Il pH di viraggio è facilmente determinabile conoscendo il valore della costante di dissociazione dell'indicatore, infatti
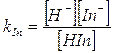
da cui
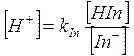
ricordando infine che al punto di viraggio [HIn] = [In-],
allora 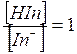
e quindi
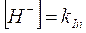
passando infine ai logaritmi, si dimostra che il pH di viraggio è uguale al logaritmo negativo della costante di dissociazione dell'indicatore o pK
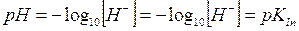
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Indicatori di pH tipo file : doc
Indicatori di pH
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Indicatori di pH utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Indicatori di pH
Termini d' uso e privacy