Conferme sperimentali del modello di Bohr
Conferme sperimentali del modello di Bohr
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Conferme sperimentali del modello di Bohr
Tra il 1913 ed il 1914 venne un'ulteriore conferma del modello atomico di Bohr, grazie agli esperimenti condotti da Moseleysugli spettri di emissione a righe nella regione della radiazione X di vari elementi chimici.
Quando un elettrone del primo livello energetico (livello K) viene espulso, in seguito ad una collisione con un elettrone proiettile o in seguito ad irradiazione con fotoni altamente energetici (gli elettroni del primo livello sono fortemente legati), il suo posto può essere occupato da un elettrone presente nei livelli superiori. Se l'elettrone proviene dal livello L (n = 2) la riga spettrale che si forma è detta K, se proviene dal livello M (n = 3) è detta K, e così via.
Se l'elettrone inizialmente espulso interessa il livello L, le righe che si formano per transizione elettronica dagli strati superiori M, N... sono dette L, L...
La serie K è sostanzialmente analoga alla serie di Lyman per l'idrogeno, ma si manifesta nella regione X.
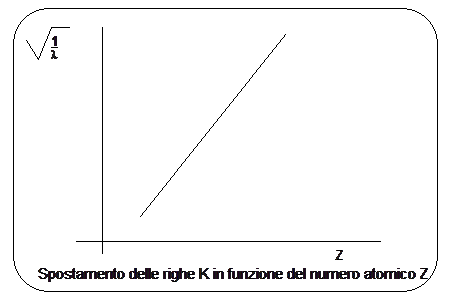 Le diverse righe della serie K presentano naturalmente un valore diverso nei vari elementi chimici, a causa delle differenze di energia esistenti tra livelli energetici dello stesso tipo in atomi aventi una diversa carica nucleare Z.
Le diverse righe della serie K presentano naturalmente un valore diverso nei vari elementi chimici, a causa delle differenze di energia esistenti tra livelli energetici dello stesso tipo in atomi aventi una diversa carica nucleare Z.
Moseley dimostrò che la riga più intensa di questi spettri (riga K) si spostava regolarmente quando si passava da un elemento al successivo nella tavola periodica e che la lunghezza d'onda di tale riga si poteva esprimere in funzione del numero atomico Z, attraverso una relazione sostanzialmente analoga alla relazione di Balmer
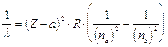
dove a è la costante di schermo, introdotta per tener conto del fatto che la carica del nucleo "vista" da ciascun elettrone è, a causa della presenza degli altri elettroni, inferiore a Ze.
Per la riga K la relazione diventa
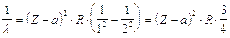
La relazione dimostra che la radice quadrata della lunghezza d'onda è inversamente proporzionale al numero atomico Z.
Ciò, oltre a confermare il modello di Bohr, permise, da una parte di dare al numero atomico Z il suo significato preciso di numero di cariche elettriche concentrate nel nucleo (e quindi anche di numero di elettroni orbitanti esternamente per rendere l'atomo neutro), dall'altra di ordinare correttamente gli elementi nella tavola periodica secondo il numero atomico crescente e non secondo il peso atomico crescente. Gli elementi devono infatti essere ordinati con lo stesso ordine con cui si succedono le righe della serie K. Risultò ad esempio che il Co precede il Ni e non viceversa .
Del 1914 sono gli esperimenti condotti da J. Francke G. Hertz (nipote di H. Hertz) che dimostrarono in modo conclusivo, non solo l'esistenza degli stati stazionari postulati da Bohr, ma anche che i salti quantici degli elettroni avvenivano effettivamente secondo le regole di quantizzazione teorizzate.
Nel 1921 Otto Sterne W. Gerlach verificarono un'altra conseguenza della teoria di Bohr. Infatti non solo le singole orbite, ma anche l'intero atomo deve possedere un momento angolare quantizzato, calcolato come vettore risultante dei singoli momenti interni.
In pratica quindi anche l'intero atomo (se possiede un momento magnetico risultante netto) può assumere solo orientazioni spaziali discrete.


Nella tavola periodica esistono quattro coppie di elementi (Ar/K, Co/Ni, Te/I, Th/Pa (Torio/Proattinio)) il cui ordine risulterebbe invertito se fossero ordinati secondo il peso atomico crescente. È notevole il fatto che Mendeleev decise di scambiarli di posto, pensando che il loro peso atomico fosse errato, classificandoli non in base al peso, ma alle loro caratteristiche chimiche
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Conferme sperimentali del modello di Bohr tipo file : doc
Conferme sperimentali del modello di Bohr
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Conferme sperimentali del modello di Bohr utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Conferme sperimentali del modello di Bohr
Termini d' uso e privacy