Il modello atomico di Bohr
Il modello atomico di Bohr
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Il modello atomico di Bohr
Preso in considerazione l'atomo di Idrogeno, Bohr introdusse alcune ipotesi in modo da far intervenire all'interno della struttura atomica la costante h.
1a ipotesi |
Esiste uno stato stazionario dell'atomo caratterizzato da particolari orbite circolari lungo le quali gli elettroni si muovono senza emettere radiazioni elettromagnetiche. Gli elettroni che percorrono tali orbite stazionarie possiedono una certa quantità ben definita di energia detta livello energetico dell'orbita.
Essendo gli elettroni in equilibrio in tali orbite la forza centrifuga (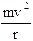 )
)
deve eguagliare la forza di attrazione coulombiana
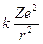 Per l’Idrogeno Z = 1 e la relazione diventa
Per l’Idrogeno Z = 1 e la relazione diventa
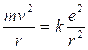
da cui si ricava il raggio
1) 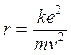
2a ipotesi |
A questo punto Bohr impose, del tutto arbitrariamente una condizione di quantizzazione. Tra le infinite orbite che soddisfano la 1) sono permesse solo quelle che soddisfano la seguente relazione
2) 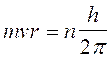
dove mvr è il momento della quantità di moto dell'elettrone in orbita attorno al suo nucleo, detto anche momento angolare orbitale. h/2p prende il nome di costante di Planck normalizzata e viene spesso indicata con 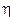 (acca tagliato) ed n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una condizione di quantizzazione del momento angolare, che si rivelerà in seguito fondamentale e caratteristica di qualsiasi corpo rotante.
(acca tagliato) ed n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una condizione di quantizzazione del momento angolare, che si rivelerà in seguito fondamentale e caratteristica di qualsiasi corpo rotante.
Tale condizione si esprime dicendo che il momento angolare dell'elettrone deve essere un multiplo intero di acca tagliato.
Il momento angolare quantizzato condiziona i valori che possono assumere il raggio delle orbite e l’energia totale (cinetica + potenziale) o livello energetico, che l’elettrone possiede.
Raggi e livelli energetici risultano pertanto anch’essi quantizzati in funzione di n.
Raggio quantizzato: Dalla condizione di quantizzazione del momento angolare si ricava la velocità che sostituita nella 1) fornisce la relazione quantistica del raggio
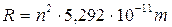
per n = 1
r = 5,292 10-11 m (= 52,92 pm = 0,5292 Å) è il raggio della orbita circolare più vicina al nucleo dell’Idrogeno ed è detto raggio di Bohr (ao) .
Energia quantizzata (livello energetico): L’energia associata ad un elettrone in moto su di un’orbita quantizzata si calcola come somma dell’energia cinetica (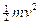 e la sostituiamo nell’espressione dell’energia cinetica, l’energia totale vale
e la sostituiamo nell’espressione dell’energia cinetica, l’energia totale vale
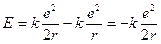
Sostituendo r con il valore quantizzato del raggio si ottiene
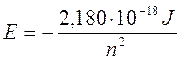
Il valore negativo dell'energia deriva dalla convenzione di porre pari a zero l'energia potenziale dell'elettrone a distanza infinita.
Per n = 1 l’elettrone si trova nello stato di minima energia possibile, detto stato fondamentale. Gli stati caratterizzati da n > 1 si dicono stati eccitati.
3^ Ipotesi |
L'atomo può passare dallo stato fondamentale ad uno eccitato assorbendo energia. In questo modo gli elettroni possono assumere l'energia necessaria per passare da un'orbita più interna ad una più esterna. L'energia assorbita affinché avvenga il salto quantico dell'elettrone, o transizione elettronica, deve essere esattamente uguale alla differenza di energia esistente tra il livello energetico superiore e quello inferiore. Quando l'elettrone si trova in un orbita superiore a quella in cui si trova normalmente, l'atomo possiede un surplus di energia che lo rende instabile (eccitato). L'elettrone è quindi destinato a tornare nell'orbita di partenza riemettendo l'energia precedentemente assorbita tramite un fotone la cui energia è appunto pari a
E2 – E1 = DE = hn
La radiazione emessa, avendo una frequenza univocamente determinata dalla differenza di energia esistente tra due particolari livelli energetici, è rigorosamente monocromatica ed apparirà come una ben determinata riga allo spettroscopio.
L’energia emessa durante una transizione da un livello n2 ad un livello n1, con n2 > n1, è
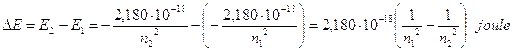
Ricordando che DE = hn e che c = ln, sostituendo opportunamente si ottiene 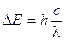 ed in definitiva
ed in definitiva
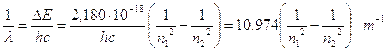
Per calcolare il numero d’onde
I numeri interi n ed m che nella relazione di Balmer non presentavano alcun significato fisico, nel modello atomico di Bohr diventano rispettivamente il numero quantico del livello più interno n1 ed il numero quantico del livello più esterno n2, tra i quali avviene la transizione.
- Ponendo nella n1 = 2 ed n2 intero superiore a due si possono trovare tutte le lunghezze d'onda delle righe spettrali prodotte dalle transizioni elettroniche dalle orbite più esterne verso la seconda orbita. Tale righe spettrali corrispondono ovviamente alla serie di Balmer.
- Ponendo invece n1 = 1 si ottengono le righe spettrali della serie di Lyman, le quali rappresentano dunque le transizioni elettroniche dalle orbite più esterne verso la prima e così via per le altre serie
- Ponendo infine n2 = ¥ si ottiene la lunghezza d’onda che deve possedere la luce con cui irraggiare l'atomo per estrarre l'elettrone e portarlo all'infinito. In altri termini è possibile calcolare teoricamente l'energia di ionizzazione dell'atomo.
Il numero quantico principale n può assumere teoricamente tutti i valori compresi tra 1 ed infinito. In pratica però tutti gli atomi conosciuti sistemano i loro elettroni al massimo in 7 livelli energetici, i quali vengono spesso indicati con le lettere K, L, M, N, O, P, Q.
Un altro aspetto notevole del modello di Bohr è che la costante di Rydberg viene ad essere calcolata in funzione di costanti note (come la carica dell’elettrone, la sua massa, la velocità della luce, etc) ed il suo valore risulta in ottimo accordo con il valore misurato sperimentalmente

Calcoliamo a titolo d’esempio il dislivello energetico esistente tra n = 2 ed n = 3, la frequenza e la lunghezza d'onda della riga spettrale (Ha) della transizione elettronica relativa.
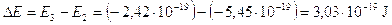
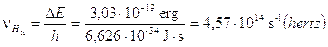
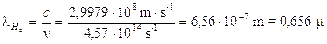
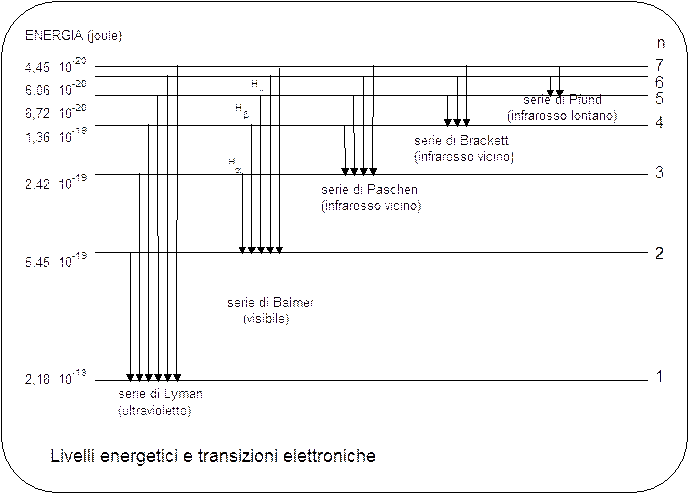
Il modello di Bohr è in grado di giustificare in modo soddisfacente solo il comportamento spettrale dell’Idrogeno e degli atomi idrogenoidi (ioni di altri elementi leggeri con un solo elettrone, come He+ e Li2+), mentre risulta inadeguato per atomi plurielettronici. D'altra parte quando Bohr impose la sua condizione di quantizzazione non poté darne alcuna giustificazione teorica, se non quella che in tal modo era possibile calcolare il valore numerico della costante di Rydberg e le righe spettrali dell’Idrogeno. Solo una decina di anni più tardi Louis De Broglie, avrebbe dimostrato che la condizione imposta da Bohr era una conseguenza della natura ondulatoria dell'elettrone.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Il modello atomico di Bohr tipo file : doc
Il modello atomico di Bohr
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Il modello atomico di Bohr utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Il modello atomico di Bohr
Termini d' uso e privacy