Legge di Hess 1840
Legge di Hess 1840
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Legge di Hess 1840
La somma algebrica dei calori prodotti o assorbiti durante un processo chimico a più stadi è uguale al calore prodotto o assorbito nel caso la stessa reazione avvenga attraverso uno stadio unico.
In termini moderni la legge di Hess afferma che il H di una reazione può essere ottenuto mediante somma algebrica dei H dei singoli stadi in cui si può eventualmente suddividere la reazione stessa.
Supponiamo ad esempio che la reazione
A B
possa essere suddivisa nei seguenti stadi
A X Y Z B
possiamo allora rappresentare le relative variazioni di entalpia attraverso il seguente grafico
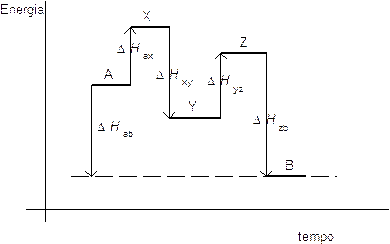
e la legge di Hess attraverso la seguente relazione
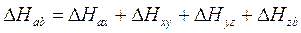
Naturalmente entrambe le leggi della termochimica sono una diretta conseguenza del fatto che l'entalpia è una funzione di stato e i valori che essa assume negli stati iniziale e finale sono indipendenti dal percorso effettuato.
Applicando le leggi della termochimica è possibile calcolare valori di H° non tabulati e calori di reazione che non possono essere misurati sperimentalmente.
Vediamo alcuni esempi
1) Vogliamo calcolare il H° di formazione del glucosio, sapendo che il suo H° di combustione è pari a - 2808 kJ/mol e che il H° di formazione dell'anidride carbonica gassosa e dell'acqua liquida sono rispettivamente -393,51 kJ/mol e -285,83 kJ/mol.
Il problema chiede di calcolare la variazione di entalpia della reazione di sintesi del glucosio a partire dagli elementi che lo costituiscono
6C + 6H2 + 3O2 C6H1206
Conosciamo il H° di combustione del glucosio
C6H1206 + 6O2 6H2O + 6CO2 H° = - 2808 kJ/mol
Per la legge di Lavoisier-Laplace il H° della reazione inversa vale
1) 6H2O + 6CO2 C6H1206 + 6O2 H°1 = + 2808 kJ/mol
Conosciamo inoltre i H° di formazione dell'anidride carbonica e dell'acqua. Per 6 molecole possiamo scrivere
2) 6C + 6O2 6CO2 H°2 = - 393,51 kJ/mol . 6moli = - 2361,06 kJ
3) 6H2 + 3O2 6H2O H°3 = - 285,83 kJ/mol . 6moli = - 1714,98 kJ
Osserviamo ora come sommando, membro a membro, le reazioni 1), 2) e 3) si possa ottenere la reazione di formazione del glucosio dai suoi elementi, di cui vogliamo calcolare l'entalpia
6H2O + 6CO2 C6H1206 + 6O2 +
6C + 6O2 6CO2 +
6H2 + 3O2 6H2O =

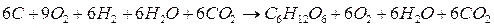
Semplificando le specie chimiche che compaiono in entrambi i membri si ottiene
4) 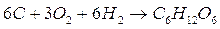
Poiché dunque la reazione 4) si può ottenere come somma delle tre reazioni parziali precedenti, applicando la legge di Hess, possiamo calcolare il suo H° come somma dei tre H° parziali.
H°4 = H°1 + H°2 + H°3
H°4 = (+ 2808) + (- 2361,06) + (- 1714,98) = - 1268,04 kJ
2) La determinazione sperimentale del H° di formazione dell'ossido di carbonio dagli elementi è estremamente difficoltosa, in quanto, oltre all'ossido di carbonio si forma sempre una certa quantità di anidride carbonica. Il H° può essere comunque calcolato per via teorica, applicando le leggi della termochimica.
La reazione di cui si vuole calcolare il H° è la seguente
1) 2C + O2 2CO H°1 = ?
Tale reazione non si produce però mai da sola, poiché parte dell'ossido di carbonio reagisce con l'ossigeno per dare anidride carbonica, secondo la reazione
2) 2CO + O2 2CO2 H°2 = - 566,0 kJ
della quale possiamo misurare sperimentalmente il H°
3) C + O2 CO2 H°3 = - 393,5 kJ
della quale possiamo misurare sperimentalmente il H°, ottenendo la completa ossidazione, mediante combustione del carbonio con un eccesso di ossigeno.
Osserviamo ora che la reazione 3) può essere ottenuta come somma delle prime due
2C + O2 2CO +
2CO + O2 2CO2 =

2C + 2O2 2CO2
Naturalmente bisognerà tener conto che il della reazione 3) dovrà essere moltiplicato per 2 per rendere omogeneo il numero di moli con le reazioni 1) e 2).
Potremo allora scrivere
H°1 + H°2 = H°3
e quindi
H°1 = H°3 - H°2
H°1 = (- 787,0 kJ) - (- 566,0 kJ) = - 221,0 kJ
Il H° di formazione dell'ossido di carbonio (per mole di CO) a partire dagli elementi costitutivi sarà allora pari a
-H° = - 110,5 kJ/mol
3) In generale per calcolare il H° di una reazione chimica è sufficiente sottrarre alla somma delle entalpie dei prodotti, la somma delle entalpie dei reagenti.
Si voglia ad esempio calcolare il H° della seguente reazione
CaCO3(s) + 2HCl(aq) CaCl2(s) +H2O(l) + CO2(g)
sapendo che le entalpie di formazione (valori tabulati) delle diverse specie chimiche sono
CaCO3(s) H° = - 1206,9 kJ/mol
HCl(aq) H° = - 167,2 kJ/mol
CaCl2(s) H° = - 795,8 kJ/mol
H2O(l) H° = - 285,8 kJ/mol
CO2(g) H° = - 393,5 kJ/mol
il H° della reazione sarà allora pari a
H° = [(- 795,8) + (- 285,8) + (- 393,5)] - [(-1206,9) + 2.(- 167,2)] = - 66,2 kJ
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Legge di Hess 1840 tipo file : doc
Legge di Hess 1840
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Legge di Hess 1840 utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Legge di Hess 1840
Termini d' uso e privacy