pH e pOH
pH e pOH
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
pH e pOH
Essendo [H+] e [OH-] espresse da valori molto piccoli risulta più comodo usare, per misurarle, una notazione logaritmica. Si conviene pertanto di esprimere la concentrazione degli ioni H+ in termini di pH, il quale risulta definito tramite la seguente relazione:
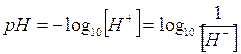
In modo del tutto analogo si può definire come unità di misura della concentrazione degli ioni OH- in una soluzione il pOH
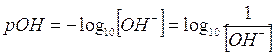
Tra pH e pOH esiste una semplice relazione che possiamo ottenere calcolando il logaritmo negativo di entrambi i membri del prodotto ionico dell'acqua
da cui
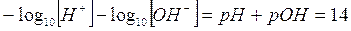
La somma del pH e del pOH è sempre uguale a 14
Poichè nelle soluzioni neutre 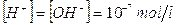 , allora per esse vale anche pH = pOH = 7
, allora per esse vale anche pH = pOH = 7
Costruiamo ora una tabella che metta in relazione il valore delle concentrazioni degli ioni H+ e degli ioni OH- con i valori del pH e del pOH
[H+]
|
pH
|
[OH-]
|
pOH
|
10-15 |
15 |
101 |
-1 |
10-14 |
14 |
100 |
0 |
10-13 |
13 |
10-1 |
1 |
10-12 |
12 |
10-2 |
2 |
10-11 |
11 |
10-3 |
3 |
10-10 |
10 |
10-4 |
4 |
10-9 |
9 |
10-5 |
5 |
10-8 |
8 |
10-6 |
6 |
10-7 |
7 |
10-7 |
7 |
10-6 |
6 |
10-8 |
8 |
10-5 |
5 |
10-9 |
9 |
10-4 |
4 |
10-10 |
10 |
10-3 |
3 |
10-11 |
11 |
10-2 |
2 |
10-12 |
12 |
10-1 |
1 |
10-13 |
13 |
100 |
0 |
10-14 |
14 |
101 |
-1 |
10-15 |
15 |
Come si può notare il pH può assumere anche valori negativi e valori superiori a 14. Si tratta comunque di casi piuttosto rari con concentrazioni di ioni H+ eccezionalmente basse o elevate.
Si noti inoltre come, essendo la scala del pH una scala logaritmica, ogni grado di pH corrisponde ad una variazione nella concentrazione degli ioni H+ pari a 10 volte. Così una soluzione a pH 2 presenta una concentrazione degli ioni H+ 1000 volte maggiore di una soluzione a pH 5.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : pH e pOH tipo file : doc
pH e pOH
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come pH e pOH utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
pH e pOH
Termini d' uso e privacy